 |
Окисление газообразным хлором и хлорсодержащими агентами
|
|
|
|
Метод окисления примесей хлором и его соединениями - один из самых распространенных способов очистки от ядовитых цианидов, а также сероводорода, сульфидов, метилмеркаптана и др.
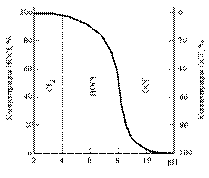
Хлор, как окислитель, в зависимости от реакции среды может на- ходиться в растворе в виде различных соединений (рис.13.2). В силь- нокислой среде возможно присутствие только молекулярного хлора, т.к. равновесие реакции взаимодействия хлора с водой сдвинуто влево:
Cl2 + H2O Û HOCl + HCl.
По мере уменьшения кислотности появляется хлорноватистая ки- слота НОСl, а в щелочной среде - гипохлориты.
В качестве реагентов, содержащих гипохлорит-ион ОСl–, служит
 хлорная известь, гипохло- рит каль-ция Са(ОСl)2 или гипохло-рит натрия NаОСl. Товар-ная хлорная известь содер-жит около 30-35 % актив-ного хлора, а гипо- хлорит кальция - 30-45 %. Сl2, НОСl и ОСl образуют свободный активный хлор, который является основ- ным обеззараживающим веществом. Хлорная из- весть содержит: Са(ОСl)2,
хлорная известь, гипохло- рит каль-ция Са(ОСl)2 или гипохло-рит натрия NаОСl. Товар-ная хлорная известь содер-жит около 30-35 % актив-ного хлора, а гипо- хлорит кальция - 30-45 %. Сl2, НОСl и ОСl образуют свободный активный хлор, который является основ- ным обеззараживающим веществом. Хлорная из- весть содержит: Са(ОСl)2,
Рис.13.2. Концентрация НОСl и ОСl– в
Са(ОН), Н О в различных
2 2
воде при изменении рН
соотношениях.
Окисление цианидов
гипохлоритами или хлором производят только в щелочной среде
(рН³10):
CN-+ OCl-® CNO-+ Cl-,
|
Образующиеся цианаты легко гидролизуются в воде или окисля- ются до элементарного азота и диоксида углерода:
CNO-
+ 2H O ® CO2-
+ NH+,
|
Окисление цианидов, а также сероводорода протекает быстро (1-3
мин.) и полно. Образующиеся цианаты постоянно гидролизуются.
При понижении рН cреды возможно протекание реакции прямого хлорирования цианида с образованием токсичного хлорциана:
CN-+ Cl2 ® CNCl + Cl-,
поэтому очень важно при окислении цианидов поддерживать щелоч- ную среду.
|
|
|
Хлор обладает бактерицидной реакцией, которая носит физиоло- гический характер. Он вступает во взаимодействие с протеинами и аминосоединениями, которые содержатся в оболочке бактерии и ее внутриклеточном веществе. Результатом таких взаимодействий являет- ся химическое изменение внутриклеточного вещества, распад структу- ры клетки и прекращение жизнедеятельности бактерий.
Высокой окислительной способностью обладает диоксид хлора СlО2. Водные растворы СlО2 относительно устойчивы в течение дли- тельного времени, при обработке сточных вод диоксидом не образует- ся токсичных продуктов прямого хлорирования (хлорциана, хлорфено- ла и др.) в любом диапазоне рН.
Окисление ционидов диоксидом хлора протекает по уравнению:
CN-+ 2ClO2 + 2OH-® CNO-+ 2ClO-+ H2O,
и наиболее интенсивно идет в щелочной среде при рН³10. До тех пор, пока концентрация цианидов в растворе остается высокой, окисления до азота и диоксида углерода не происходит; цианаты начинают окис- ляться, когда остаточное содержание цианидов достигает 2,5-3 мг/л при дозе ClO2, близкой к теоретической.
В зависимости от агрегатного состояния вводимых в воду хлора
или хлорсодержащих реагентов определяется технология обработки сточных вод и аппаратурное оформление процесса. Если воду обраба- тывают газообразным хлором или диоксидом хлора, процесс проводят в абсорберах; если реагенты находятся в растворе, то их подают в сме-
ситель и далее в контактный резервуар. Хлораторные установки вклю- чают складское хозяйство и устройства для дозирования. Необходимы также растворные и расходные баки, смесители, камеры реакций, от- стойники и другие сооружения. Рабочий раствор реагента готовят обычно в виде 5 % раствора по активному хлору. Для хлорирования газообразным хлором наиболее широко применяются вакуумные хло- раторы производительностью по хлору 0,08-20 кг/ч.
|
|
|
Потребность в реагентах для окисления Х, кг/сут, подсчитыва- ется по формуле:
 X = k × x × Q,
X = k × x × Q,
a
где k =1,2-1,3 - коэффициент запаса реагента; х - расход активного хлора, необ- ходимого для окисления, кг/м3; Q - расход воды, м3/сут; а - содержание актив- ного хлора в реагенте, в долях единицы.
|
|
|


