 |
15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
|
|
|
|
15. Реакция среды в растворах слабых кислот и оснований. Константа диссоциации. Реакция среды в растворах солей. Закон разведения Оствальда
Слабые кислоты: H2S, HF, CH3COOH, HNO2 (HnЭOm m-n< 2)
Слабые основания: NH4OH, Me(OH)n (Me-  , кроме щелочных и щелочно земельных).
, кроме щелочных и щелочно земельных).
Слабые кислоты и основания диссоциируют обратимо, равновесно, по ступеням, причём каждая последующая ступень протекает слабее предыдущей. Количественно диссоциацию слабых электролитов выражают с помощью α:


 - степень электролитической диссоциации, Kд - константа диссоциации (константа равновесия). Константа диссоциации - вид константы равновесия, которая показывает склонность к диссоциации.
- степень электролитической диссоциации, Kд - константа диссоциации (константа равновесия). Константа диссоциации - вид константы равновесия, которая показывает склонность к диссоциации.
 < < 1 и Kд< 1
< < 1 и Kд< 1
Диссоциация протекает с участием полярных молекул Н2О. Чем их больше, тем в большей степени протекает диссоциация.
Диссоциация слабой кислоты:
- Диссоциация CH3COOH происходит в 1 стадию:
CH3COOH↔ CH3COO-+Н+; 
- Дисоциация H3AsO4 протекает в 3 стадии:
1ст. H3AsO4↔ H++ H2AsO4-
Кд1= C(H2AsO4-)× C(H+)/C(H3AsO4)=6× 10-3
2ст. H2AsO4↔ H++ HAsO4-2
Кд2=1× 10-8
3ст. HAsO4↔ H++ AsO4-3
Кg3=3× 10-12
Кд1> Кд2 > Кд3>
α 1> α 2> α 3
Диссоциация слабых оснований протекает аналогично
NH4OH↔ NH4++OH-
Кд=1, 7× 10-5
Закон разбавления Оствальда.
Закон: 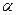 -степень электролитической диссоциации слабых электролитов, увеличивается при разбавлении раствора.
-степень электролитической диссоциации слабых электролитов, увеличивается при разбавлении раствора.
 ;
; 
Со – исходные вещества; 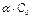 – продиссоциированные вещества
– продиссоциированные вещества
Со-  - не диссоциированные вещества;
- не диссоциированные вещества; 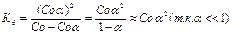
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы.
|
|
|
16. Буферные системы: определение понятия, типии буферной системы. Буферная емкость и pН буферной системы
Буферные системы — это биологические жидкости организма. Их защитная роль в поддержании нормального рН крови чрезвычайно велика. Любая буферная система представляет собой смесь слабой кислоты и ее соли, образованной сильным основанием
Слабые кислоты и основания, в отличие от сильных (диссоциирующих практически полностью), распадаются на ионы в очень небольшой степени. Поэтому, например, в растворе слабой кислоты, можно выделить:
- общую кислотность – концентрация растворённой кислоты, которую можно определить титрованием раствором щёлочи до полной нейтрализации;
- активную кислотность – концентрации свободных протонов в растворе;
- потенциальную или резервную кислотность, заключённоую в недиссоциированных молекулах кислоты.
Аналогично, слабые основания обладают тремя видами щёлочности.
Кроме того, слабые электролиты подчиняются закону разведения Оствальда, согласно которому степень диссоциации слабого электролита обратно пропорциональна корню квадратному из его концентрации:
α =  ,
,
где К – константа диссоциации, С – молярная концентрация;
или прямо пропорциональна корню квадратному из его разведения:
α = 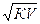 , где V – разведение
, где V – разведение
Как вы помните из курса средней школы, реакция среды в растворах солей определяется их способностью к гидролизу. Так, соли, образованные слабой кислотой и сильным основанием, подвергаясь гидролизу по аниону, смещают равновесие диссоциации воды в сторону образования гидроксид-анионов. Среда становится щелочной. Например:
|
|
|
СН3СОО- + Na+ + Н2О → СН3СООН + Na+ + ОН-
Соли, образованные слабым основанием и сильной кислотой, подвергаясь гидролизу по катиону, смешает равновесие диссоциации воды в сторону образования протонов.
Например: NН4+ + Сl- + Н2О → NН4ОН + H+ + Cl-
Буферные системы (БС) – водные растворы, препятствующие изменению рН при добавлении небольших количеств сильных кислот, оснований, а также при разбавлении и концентрировании.
Состав любой БС включает в себя 2 компонента в следующих вариантах:
а) слабая кислота и её соль, образованная сильным основанием;
б) слабое основание и его соль, образованная сильной кислотой.
Пример БС первого типа – ацетатный буфер:
СН3СООН/СН3СОО-+Na+
где СН3СООН – слабая кислота, а СН3СОО-+Na+ - соль, образованная сильным основанием (NaOH).
Пример БС второго типа – аммиачный буфер:
NH4OH/NH4+ + Cl-
где NH4OH – слабое основание, NH4+ + Cl- - его соль, образованная сильной кислотой (HCl).
Важнейшим компонентом БС является именно слабый электролит. Он обеспечивает резервную кислотность или основность.
Классификация кислотно-основных буферных систем:
Буферные системы могут быть четырех типов:
1. Слабая кислота и ее анион А- /НА:
ацетатная буферная система СН3СОО-/СН3СООН в растворе СН3СООNa и СН3СООН, область действия рН = 3, 8-5, 8.
Водород-карбонатная система НСО3-/Н2СО3 в растворе NaНСО3 и Н2СО3, область её действия – рН = 5, 4-7, 4.
2. Слабое основание и его катион В/ВН+:
аммиачная буферная система NH3/NH4+ в растворе NH3 и NH4Cl,
область ее действия – рН = 8, 2-10, 2.
3. Анионы кислой и средней соли или двух кислых солей:
карбонатная буферная система СО32-/НСО3- в растворе Na2CO3 и NaHCO3, область ее действия рН = 9, 3-11, 3.
фосфатная буферная система НРО42-/Н2РО4- в растворе Nа2НРО4 и NаН2РО4, область ее действия рН = 6, 2-8, 2.
Эти солевые буферные системы можно отнести к 1-му типу, т. к. одна из солей этих буферных систем выполняет функцию слабой кислоты. Так, в фосфатной буферной системе анион Н2РО4- является слабой кислотой.
4. Ионы и молекулы амфолитов. К ним относят аминокислотные и белковые буферные системы. Если аминокислоты или белки находятся в изоэлектрическом состоянии (суммарный заряд молекулы равен нулю), то растворы этих соединений не являются буферными. Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из ИЭС в форму «белок-кислота» или соответственно в форму «белок-основание»
|
|
|
Буферная ёмкость – это количество молей любой сильной кислоты или щёлочи, которое необходимо добавить к 1 л буферного раствора для смещения его рН на 1. Буферная ёмкость тем выше, чем больше концентрация компонентов и чем ближе их соотношение к единице.
Буферная емкость зависит от ряда факторов:
1. Чем выше концентрации компонентов буферного раствора, тем больше его буферная емкость.
2. Буферная емкость зависит от отношения концентраций компонентов, а, следовательно, и от рН буфера. При рН=рКа буферная емкость максимальна.
3. Установлено, что достаточное буферное действие наблюдается, если концентрация одного из компонентов превышает концентрацию другого не более, чем в 10 раз.
Интервал рН=рКа±1 называется зоной буферного действия.
4. При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации компонентов раствора.
|
|
|


