 |
Регуляция биосинтеза белка.
|
|
|
|
В живых организмах происходит избирательный синтез белков, различные белки образуются с неодинаковой скоростью. Например, у Е. coli содержание одних белков не превышает 10 молекул на клетку, у других достигает 500 тыс.; наиболее велико количество рибосомных белков. Соматические клетки всех тканей и органов многоклеточного организма имеют одинаковую генетическую информацию, но отличаются друг от друга по содержанию тех или иных белков. Так, для клеток эритроцитов характерно высокое содержание гемоглобина, кожи — коллагена, клетки поджелудочной железы вырабатывают много ферментативных белков. В отдельных клетках, тканях и органах содержание разных белков меняется с возрастом, с фазой развития. Все это свидетельствует о том, что в живых организмах существуют механизмы регуляции скорости белкового синтеза. Они функционируют под действием внутренних и внешних факторов на каждой из стадий сложного процесса синтеза белка. Количество белка может изменяться в результате специфического увеличения числа некоторых генов, регуляции на стадии транскрипции, процессинга мРНК. Скорость белкового синтеза определяется и временем жизни мРНК, регуляцией синтеза на уровне трансляции, посттрансляционной модификации белков.
У прокариотических организмов механизмы регуляции белкового синтеза наиболее хорошо изучены на стадии транскрипции. На этой стадии происходит, в частности, регуляция синтеза индуцибельных ферментов у бактерий, т. е. таких ферментов, количество которых резко возрастает при добавлении в питательную среду субстрата этих- ферментов (индуктора). Например, у Е. coli усиленный синтез ферментов метаболизма лактозы происходит только на среде с лактозой, когда она является единственным источником углерода и энергии. В ее отсутствие содержание этих ферментов в клетках очень мало. Индукция их синтеза у Е. coli подробно исследована Ф. Жакобом и Ж. Моно. Синтез этих ферментов происходит на лактозном опероне (ас-оперон).
|
|
|
Лактозный оперон Е. coli объединяет три структурных цистрона, кодирующих три фермента: галактозидпермеазу, β-галактозидазу и тиогалактозид-ацетилтрансферазу. Фермент галактозидпермеаза участвует в переносе лактозы через мембрану внутрь клетки; (З-галактозидаза непосредственно осуществляет расщепление лактозы на глюкозу и галактозу; роль тиогалактозид-ацетилтрансферазы пока исследована недостаточно. В настоящее время известна полностью первичная структура lас-оперона Е. coli, число и порядок чередования нуклеотидных пар в каждом функциональном его участке.
В большинстве исследованных случаев индуцибельными являются опероны, ответственные за синтез ферментов, катализирующих катаболические реакции (сбраживание сахаров, распад аминокислот и др.). Индукторами таких оперонов, переводящими активный репрессор в неактивную форму, являются субстраты этих катаболических ферментов. Репрессируемые опероны, как правило, системы синтеза анаболических ферментов, катализирующих реакции синтеза аминокислот, азотистых оснований и т. д. В качестве корепрессора, активирующего репрессор, выступают продукты, синтезируемые ферментами данного оперона.
Если ген-регулятор располагается перед группой оперонов, кодирующих ферменты, ответственные за разные промежуточные реакции синтеза одного и того же соединения, то он контролирует работу всех оперонов с участием единственного репрессора.
Помимо индуцибельных и репрессируемых ферментов в клетках существуют и конститутивные белки и в том числе конститутивные ферменты. Это такие белки и ферменты, количество которых несущественно изменяется в процессе жизнедеятельности организма. Они постоянно синтезируются клеткой, на скорость их синтеза существенно не влияет состав среды. Уровень конститутивного синтеза зависит от скорости синтеза мРНК, скорости прикрепления к ней рибосом, считывания матрицы и времени жизни мРНК. К конститутивным белкам относятся, например, ферменты, участвующие в расщеплении глюкозы у Е. coli. Оперон, отвечающий за синтез конститутивного белка, не содержит активно действующего оператора. Потеря активности оператором может произойти в принципе у любого оперона вследствие мутации. В таком случае действие репрессоров блокируется и идет неконтролируемый синтез белков.
|
|
|
В ядрах дифференцированных клеток эукариот большинство генов находится в репрессированном состоянии: одновременно транскрибируется в среднем только около 10% генов. Точное число активно работающих структурных генов различно в разных тканях и органах и на разных стадиях развития. Например, в ретикулоцитах, где идет синтез глобинов, число копий глобиновых мРНК превосходит 150 000 на клетку, а в других клетках того же организма их либо крайне мало, либо совсем не удается обнаружить.
Все структурные гены эукариот предлагают условно разделять на три типа;
1) гены, функционирующие во всех клетках организма (например, гены, кодирующие ферменты энергетического обмена);
2) гены, функционирующие только в тканях одного типа (в частности, гены, определяющие синтез миозина в мышечной ткани);
3) гены, нужные для выполнения клетками узких функций (например, гены, кодирующие синтез белка хрусталика).
ДНК эукариот ассоциирована с гистонами и другими белками, которые могут выполнять регуляторную функцию, влияя на РНК-полимеразную реакцию. Сродство гистонов к ДНК зависит от степени их фосфорилирования, метилирования и ацетилирования. Усиление этих процессов ведет к уменьшению способности гистонов связываться с ДНК, что приводит к увеличению ее активности. Предполагают, что такую модификацию гистонов катализируют кислые белки, обладающие ферментативной активностью. С помощью гистонов у эукариотических организмов осуществляется в значительной мере групповая репрессия работы генов — одновременное групповое подавление активности генов во всем ядре, в целой хромосоме или в большом ее участке.
|
|
|
Активация биосинтеза белка в хлоропластах у растений может происходить под действием света как в результате того, что некоторые репрессирующие системы хлоропласта являются фоточувствительными, так и в связи с увеличением активности РНК-полимеразы.
У эукариот существует и такой механизм, обеспечивающий детерминированное направление развития групп клеток, как отбор и избирательное размножение клеток, продуцирующих нужный белок (например, клонирование клеток, синтезирующих антитела).
Структура антител, механизм их образования. Появление белков-антител в сыворотке и тканях человека и позвоночных животных в ответ на введение генетически чужеродных соединений (антигены) является основой гуморальной иммунной реакции. Антигенами называются вещества, которые несут признаки генетической чужеродности и при введении в организм вызывают развитие специфических иммунологических реакций. Типичными антигенами являются чужеродные белки, полисахариды микроорганизмов.
Антигенные свойства могут проявлять нуклеиновые кислоты, сложные липиды, некоторые низкомолекулярные вещества (ряд гормонов, лекарств), химически синтезированные соединения, если они связаны с носителем-белком, полисахаридом и др. Такие вещества получили название гаптенов. Наименьшая молекулярная масса веществ, против которых удалось получить антитела без их присоединения к другим крупным молекулам, составляет около 1000 (например, олигопептиды, содержащие более 8 аминокислотных остатков).
Антитела — вещества гликопротеиновой природы, образующиеся в ответ на введение в организм антигена и обладающие способностью к специфической реакции с антигеном. Кроме сыворотки крови антитела обнаружены в экскреторных жидкостях (молоко, выделения слезных желез, слюна и др.), а также па поверхности некоторых типов клеток лимфатической системы. Встреча антигена с соответствующим антителом приводит к образованию комплекса. При выпадении этого комплекса в осадок происходит реакция преципитации. Если антитела, взаимодействуя с антигенами, вызывают склеивание клеток, их называют агглютининами, если же они вызывают лизис, их называют лизинами.
|
|
|
Антитела обнаруживают высокую специфичность в отношении чужеродных белков, вызвавших их образование. Различные белки одного и того же организма вызывают образование различных антител. Так, если иммунизировать кролика гемоглобином лошади, то образовавшиеся при этом антитела не способны реагировать с другими белками лошади. Неодинаковы в иммунологическом отношении гомологичные белки разных организмов. Примером могут служить гемоглобины. Антитела, образовавшиеся в организме кролика в ответ на введение гемоглобина лошади, реагируют наиболее активно с гемоглобином лошади и значительно слабее с гемоглобинами других млекопитающих.
Антитела представляют собой растворимые белки плазмы, относящиеся к иммуноглобулинам (преимущественно к γ~глобулинам). По седиментационным и электрофоретическим характеристикам, а также по появлению в очень больших количествах при некоторых состояниях организма иммуноглобулины человека подразделяют на пять классов; IgG, IgM, IgA, IgD и IgE. Первые три представлены количественно более существенно, два последних называются минорными классами. Содержание IgG, IgM и IgA (относительно общего содержания иммуноглобулинов) в крови здорового человека составляет 70—80, 5—10 и 10—20% соответственно.
Будучи гликопротеинами, иммуноглобулины всегда содержат углеводы, количество которых по отношению к общей массе колеблется от 2—3% в IgG до 10—12% в IgA и IgM.
В состав иммуноглобулинов человека могут входить L-цепи одного из двух типов: ϰ (каппа) либо λ(ламбда). Тяжелых цепей антител существует пять типов: α, γ,  , ε, μ. Они определяют классы антител: в IgM входит μ-цепь, в IgG—γ, в IgD — δ, в IgE — ε, в IgA — α. Каждая тяжелая цепь может вступать в ассоциацию с любой из легких цепей. В сыворотке крови здорового человека содержится смесь множества различных иммуноглобулинов. Их исключительно большая гетерогенность не позволяет выделить из смеси и исследовать структуру какого-либо одного индивидуального иммуноглобулина.
, ε, μ. Они определяют классы антител: в IgM входит μ-цепь, в IgG—γ, в IgD — δ, в IgE — ε, в IgA — α. Каждая тяжелая цепь может вступать в ассоциацию с любой из легких цепей. В сыворотке крови здорового человека содержится смесь множества различных иммуноглобулинов. Их исключительно большая гетерогенность не позволяет выделить из смеси и исследовать структуру какого-либо одного индивидуального иммуноглобулина.
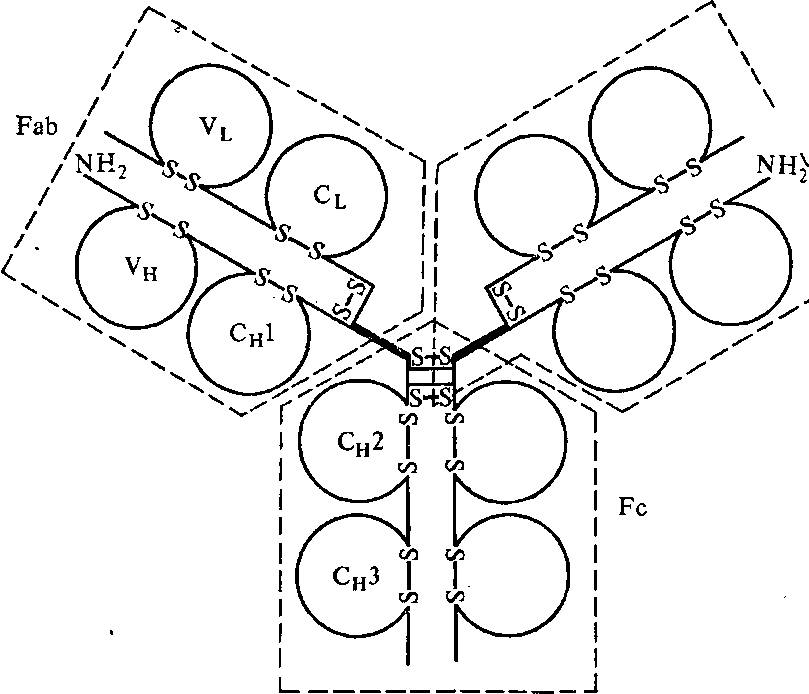
| Рис. 12. Схема молекулы Ig человека |
Определение аминокислотной последовательности иммуноглобулинов показало, что молекулу антитела можно разделить на участки, или домены. Одни из них характеризуются постоянной последовательностью аминокислот, они называются константными участками (С), у других — сильно различающиеся последовательности, это — вариабельные участки (V). Константные участки антител функционируют при связывании комплемента, обеспечивают перенос антител через плацентарный барьер (у человека и некоторых млекопитающих иммунитет от матери к ребенку может передаваться в процессе внутриутробного развития в результате переноса антител из крови матери через плаценту).
|
|
|
Всего в молекуле IgG 12 доменов: по 4 на тяжелых и по 2 на легких цепях. Молекулярная масса каждого домена примерно одинакова — около 12 500. Первые домены (Vl и Vн) составлены из вариабельных участков легких и тяжелых цепей, остальные — из константных участков легких или тяжелых цепей — Сl и СH. Активные центры антител формируются доменами вариабельных участков. В этом участвует от 4 до 8 аминокислотных остатков с широкой вариабельностью по видам аминокислот и их сочетаниям. Эти участки называются гипервариабельными областями легких и тяжелых цепей.
Синтез иммуноглобулинов осуществляется обычными механизмами белкового синтеза, но L- и Н-цепи образуются двумя различными типами полирибосом. В процессе синтеза антител наблюдается кооперативное взаимодействие клеток трех типов, которые образуются в костном мозге: В-лимфоцитов, T-лимфоцитов и макрофагов.
По современным представлениям, иммунная система способна отличить друг от друга около 105—107 различных антигенов.
При взаимодействии антигенов с антителами происходит включение системы комплемента. Она состоит из нескольких (около 10) сывороточных белков крови. Каскадный механизм их активации запускается в результате образования комплекса антиген — антитело. В итоге действие комплемента приводит к лизису чужеродных веществ и к активации лейкоцитов. Таким образом, комплемент вместе с антителами и специализированными клетками участвует в защите организма хозяина от инфекций.
Организм на протяжении своей жизни встречается с разными бактериями и антигенами, поэтому в норме плазма содержит огромное число различных антител. В частности, иммунитет к определенным бактериям или вирусам обусловлен присутствием соответствующих «своих» специфических антител. Искусственный активный иммунитет получают путем введения в организм убитых бактерий, а также токсоидов — обработанных формальдегидом (поэтому обезвреженных) токсинов дифтерийной или столбнячной палочки. В результате прививок таким путем полученными вакцинами у человека вырабатываются специфические антитела, способные реагировать с определенным видом живых бактерий или естественным токсином, т. е. возникает иммунитет.
Наиболее активными в создании прочного искусственного иммунитета являются вакцины из живых ослабленных микробов. Их получают путем выращивания патогенных микроорганизмов при воздействии неблагоприятных факторов (прогревание при субоптимальных температурах, добавление в питательную среду некоторых веществ и т.д.). Против ряда инфекций живые вакцины являются практически единственным средством специфической профилактики (сибирская язва, туляремия, чума). Широко применяют живые вакцины против оспы, бешенства, полиомиелита и многих других заболеваний. В последнее время стали использовать также химические вакцины, которые готовят путем экстрагирования антигенных фракций из культур соответствующих микроорганизмов. Успешно проводят исследования по химическому синтезу антигенов, значительно более простых по структуре, чем природные. Все более реальным становится получение синтетических вакцин.
Временный пассивный иммунитет создается в результате введения антител, выработанных другим, иммунным организмом какогото животного. Для лечения дифтерии и столбняка, например, используют плазму иммунизированных лошадей, которая содержит антитела к соответствующим токсинам.
Антитела образуются только у позвоночных животных, однако это не означает, что беспозвоночные не обладают иммунитетом. Иммунная система развилась из распознавания клеток друг другом при помощи комплементарных поверхностных рецепторов, различения «своего» и «чужого». Так как иммунная система функционирует во взаимодействии с комплексом гистосовместимости, их эволюция должна рассматриваться совместно.
У морских звезд и кольчецов происходит отторжение пересаженной ткани, ее разрушение. У членистоногих имеются неиндуцируемые механизмы агглютинации чужеродных веществ. Тимус и селезенка, а с ними и антитела появляются только у позвоночных. Строение цепей антител изменялось в процессе эволюции позвочночных животных. Бесчелюстные (или круглоротые, куда относятся миноги и миксины) содержат иммуноглобулины с μ-подобными тяжелыми цепями.
Диссимиляция белков
Расщепление белков в процессе пищеварения. Роль белков в питании. В организме человека и животных непрерывно происходит разрушение клеток, расщепление и расходование белков: распад «устаревших» молекул белка всех тканей, шелушение эпителия, рост ногтей, рогов, копыт, расход пищеварительных и других ферментов, расход гормонов, образование антител и т. д. Восполнение непрерывно расходующихся белков во всех этих процессах возможно лишь при поступлении достаточного количества их с пищей. Суточная потребность человека в белках составляет 80—100 г, а для людей физического труда — до 120—150 г, белков животного происхождения из них должно быть не менее 50—70 г. При недостатке белков быстро нарушается функционирование щитовидной железы, надпочечников, половых желез. Особенно чувствительна к белковому голоданию центральная нервная система, в первую очередь кора головного мозга. Даже при полном голодании человека мозг и сердце долго не теряют в массе, обновляют свои белки за счет их распада в мышцах, печени.
Различают белки пищи полноценные и неполноценные. Полноценные белки содержат все 10 незаменимых аминокислот, которые животные и человек в отличие от растений и микроорганизмов не способны синтезировать. В процессе эволюции утратилась способность к их синтезу, так как эти аминокислоты поступали в организм в достаточных количествах с растениями, микроорганизмами, другими животными.
К незаменимым аминокислотам относятся лизин, аргинин, гистидин, валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан. Этот перечень требует некоторых примечаний. Аргинин может синтезироваться в организме человека и других животных, но происходит это в очень небольших количествах. Поскольку тирозин образуется непосредственно из фенилаланина в одну стадию, потребность в фенилаланине является фактически потребностью в этих обеих аминокислотах, и тирозин можно отнести
к незаменимым аминокислотам. По этой же причине цистеин — заменимая аминокислота только в том случае, когда в пище есть метионин. Глицин, являющийся заменимой аминокислотой для всех животных, незаменим для цыплят.
В неполноценных белках отсутствует одна или несколько незаменимых аминокислот. К полноценным белкам относят казеин молока, альбумин яйца, молочный альбумин, глутамин пшеницы, к неполноценным — многие растительные белки (зеин -кукурузы, легумин - бобовых), они обычно бедны лизином, метионином, триптофаном. Недостатком растительных белков является также то, что в растительных продуктах содержание белков сравнительно невелико, поэтому при вегетарианском питании (только растительными продуктами) употребить их нужно очень много, чтобы покрыть суточную потребность организма в белках. Кроме того, некоторые растительные белки плохо перевариваются.
Животные продукты содержат большие количества белков, и их нужно сравнительно немного для обеспечения организма (особенно важно, что животные белки являются обычно полноценными). Все это объясняет, почему в суточном рационе более половины белков должно быть животного происхождения.
Одним из продуктов распада является мочевая кислота, которая при избытке откладывается в суставах (заболевание подагрой). Эти кислые вредные продукты нейтрализуются и выводятся из организма в соединении со щелочными минеральными веществами, которых много в растительной пище — овощах, фруктах. Этим в первую очередь и объясняется полезность сопровождения мясных блюд растительными гарнирами, в чем люди на жизненном опыте убедились с давних времен. Кроме того, избыточное одностороннее питание животными белками вызывает в кишечнике усиленные гнилостные процессы с образованием токсических веществ. Молочно-растительная пища благоприятно действует на кишечную микрофлору, задерживает гнилостные процессы.
Тканевые протеиназы животных. Во всех животных тканях обнаружены активные протеолитические ферменты как типа протеиназ (эндопептидазы, пептидил-пептидгидролазы), так и пептидаз. Особенно большая их активность отмечается обычно в интенсивно растущих или делящихся клетках, а также в клетках желез и других органов, характеризующихся высоким уровнем скорости белкового синтеза. Это объясняется тем, что синтез тканевых белков в значительной мере идет за счет аминокислот, образующихся при диссимиляции устаревших белковых молекул. Наряду с доставкой пластического материала для биосинтетических реакций внутриклеточный протеолиз может играть роль в специфических процессах: внутриклеточного переваривания в ходе морфогенеза у насекомых и позвоночных, в реакциях естественного иммунитета, образовании и распаде физиологически активных веществ (ферменты, гормоны).
Внутриклеточный протеолиз находится в основном в лизосомах, содержащих большой набор активных гидролаз, в том числе и кислых протеиназ. Внутриклеточные протеиназы, гидролизующие белки в слабокислой области рН, называются катепсинами. В настоящее время различают пять достаточно хорошо охарактеризованных типов катепсинов, которые обозначают буквами А, В, С, D, Е. Они отличаются оптимумом рН, субстратной специфичностью и рядом других свойств. На долю катепсина D у некоторых животных приходится около 2/3 общей протеолитической активности гомогенатов селезенки, почек. В отличие от катепсинов В и С он не относится к сульфгидрильным протеиназам, не ингибируется реагентами на сульфгидрильные группы. Катепсин Е по субстратной специфичности и другим свойствам близок к катепсину D.
Кроме катепсинов, являющихся кислыми тканевыми протеиназами, в различных органах и тканях обнаружены нейтральные и щелочные протеиназы (в эритроцитах, легких, скелетных мышцах, мозге). Их биологические функции и каталитические свойства исследованы пока недостаточно. Особую группу внутриклеточных протеиназ, имеющих оптимум в щелочной области рН, составляют калликреины, широко распространенные в тканях и жидкостях организма. Особенно активны они в крови, слюнных железах, поджелудочной железе. Под действием калликреина плазмы образуется брадикинин, а калликреинов поджелудочной и других желез — каллидин, превращаемый в крови аминопептидазой в брадикинин.
Протеиназы высших растений в большинстве случаев относятся к сульфгидрильному типу, активируются цистеином, глутатионом и другими восстановителями. Оптимальная зона их действия находится в слабокислом, нейтральном и слабощелочном рН и во многом зависит от природы субстрата. Типичный представитель — папайи из сока плодов дынного дерева (Carica papaya). Значительно реже встречаются растительные протеиназы, не активируемые восстановителями. Протеиназы насекомоядных растений (росянка, непентес) имеют резко кислый оптимум рН 3—3,5.
Микроорганизмы образуют в основном секретируемые протеиназы (экзоцеллюлярные), которые обеспечивают их низкомолекулярными продуктами распада белков окружающей среды. Внутриклеточными являются в основном пептидазы, которые расщепляют пептиды, проникшие в клетку из внешней среды. Значительно реже обнаруживаются внутриклеточные протеиназы. Широкой субстратной специфичностью обладают протеазы актиномицетов, гидролизирующие как глобулярные, так и фибриллярные белки.
Хорошо исследованы и широко используют в лабораторной практике и промышленности щелочные протеиназы Вас. subtilis — субтилизины, поскольку они гидролизуют белки глубже и с большей скоростью, чем многие другие протеиназы (в том числе пепсин и трипсин). Это типичные сериновые протеиназы, по строению активного центра очень близкие к химотрипсину.
Конечные продукты азотного обмена, эволюционные и экологические аспекты. В результате диссимиляции аминокислот у всех живых организмов образуется аммиак. Однако, будучи токсичным даже в самых малых концентрациях, он не накапливается в клетке, а быстро удаляется либо путем выведения во внешнюю среду, либо путем превращения в нетоксичные соединения. У многих организмов первичное связывание аммиака в клетках происходит путем образования амидов — глутамина и аспарагина. Как показал выдающийся агрохимик Н. Д. Прянишников, этот путь особенно характерен для растительных тканей, у которых в форме указанных амидов запасается постоянно дефицитный для растений азот. Однако и у животных образование глутамина (в несколько меньшей мере аспарагина) широко представлено, обнаружено в мышцах, мозге, печени, почках млекопитающих, жировом теле и гемолимфе насекомых.
У животных и человека образующийся в разных тканях и органах глутамин поступает в кровь, а затем в печень и почки, т. е. является своеобразной транспортной формой аммиака и временным его хранилищем. В последние годы обнаружено, что аспарагиновая и глутаминовая кислоты могут амидироваться, находясь в составе белковой молекулы, т. е. возможно амидирование белков.
У человека, а также всех млекопитающих, амфибий и ряда других животных основным конечным продуктом азотного обмена, выводимым из организма, является мочевина.
В 30-х годах Г. Кребс, подробно исследуя цепь реакций образования мочевины, нашел, что эта цепь имеет циклический характер и существенную роль в процессе играет орнитин. В связи с последним весь процесс биосинтеза мочевины получил название орнитинового цикла.
В первой реакции цикла взаимодействуют NH3, С02, две молекулы АТФ с образованием карбомоилфосфата, Фермент карбамоилфосфатсинтаза локализован в митохондриях печени, донором азота для этого фермента может служить только NH3. Карбамоилфосфат отдает свою карбамоильную группу орнитину, в результате образуется цитруллин. Эта реакция катализируется орнитинкарбамоилтрансферазой:
ОН NH2
I | Орнитин-карбамоил-
H2N—С—О~Р-ОН + H2N~CH2-CH2-CH2—СН-СООН ⇆
║ ║ трансфераза
О О
Карбамоилфосфат Орнитин
⇆ H2N—С—NH—СН2—СН2—СН2—СН—СООН + Н3Р04
║
О
Цитруллин
Вторая NH2-группа будущей молекулы мочевины включается в цикл с помощью аспарагиновой кислоты, образующейся за счет переаминирования между глутаминовой кислотой и оксалоацетатом. Превращение глутаминовой кислоты в аспарагиновую катализируется ферментом аспартатаминотрансферазой. Аминогруппа аспарагиновой кислоты конденсируется с карбамильной группой цитруллина. Реакция протекает в присутствии АТФ, катализируется аргининосукцинатсинтетазой. В результате образуется аргининосукцинат, который затем обратимо расщепляется до аргинина и фумарата.
Аргинин расщепляется аргиназой до мочевины и орнитина, который снова входит в цикл. Количество выделяемой из организма мочевины находится в зависимости от количества белков в пище и у взрослого человека в норме составляет 25—35 г/сут.
Таблица 9. Основные конечные продукты азотного обмена у разных групп животных
| Животные | Главный конечный продукт белкового обмена | Животные | Главный конечный продукт белкового обмена |
| Водные беспозвоночные Костистые рыбы Пластинчатожаберные Крокодилы Эмбрионы амфибий Взрослые амфибии Млекопитающие | Аммиак Аммиак, некоторое количество мочевины Мочевина Аммиак, некоторое количество мочевой кислоты Аммиак Мочевина | Черепахи Насекомые Наземные брюхоногие моллюски Ящерицы Змеи Птицы | Мочевина и мочевая кислота Мочевая кислота |
Далеко не у всех систематических групп животных основным конечным продуктом белкового обмена является мочевина. Таким образом, конкретные формы конечных продуктов азотного обмена определяются и уровнем эволюционного развития, и условиями внешней среды (среди последних главную роль играет обеспеченность водой).
В значительной мере аммониотелическими животными являются также пресноводные костистые рыбы, система химического связывания аммиака у них развита еще слабо. У костистых морских рыб на долю аммонийных солей приходится 40—60% суммарного азота мочи. Кроме того, у них довольно много выделяется триметиламиноксида 0 = N ==(СН3)3. Его образование связано, видимо, с окислительным расщеплением холина.
Небольшое количество аммонийных солей (3—6% общего азота мочи) обнаруживается и в моче человека, позвоночных животных. Однако для них это нетипичный конечный продукт азотного обмена. При некоторых заболеваниях (например, при диабете) в организме накапливаются кислые продукты метаболизма, наступает ацидоз. В таких случаях количество аммонийных солей в моче резко возрастает, NH3 используется для нейтрализации кислот. При этом организм экономит расходование других, полезных для него катионов (К, Mg и др.), поддерживает нормальное солевое равновесие.
Большинство наземных позвоночных животных — млекопитающие, амфибии (во взрослом состоянии), хрящевые рыбы — образуют группу уреотелических животных, основным конечным продуктом азотного обмена у них является хорошо растворимая в воде мочевина. Птицы и наземные пресмыкающиеся потребляют ограниченное количество воды, у летающих птиц она создает перегрузку массы, наземные рептилии обитают часто в засушливых местах. У них моча представляет собой полужидкую массу, содержащую кристаллы плохо растворимой в воде мочевой кислоты. Такие организмы называют урикотелическими. Кроме птиц и наземных рептилий к ним относятся насекомые.
Образование мочевой кислоты, происходящее в печени и отчасти в слизистой кишечника, представляет собой сложный процесс, поскольку ему предшествует образование пуриновых циклов. При этом два атома азота пурина дают амидные группы глутамина, один атом азота — аспартат и один — глицин.
На образование конечных продуктов азотного обмена у птиц и рептилий большое влияние оказывают условия их эмбрионального развития — замкнутое пространство яйца, окруженного оболочками, непроницаемыми для воды. Количество воды в яйце очень небольшое, образование токсичных аммонийных солей быстро привело бы к гибели эмбриона. Синтез мочевины имел бы последствием резкое повышение осмотической концентрации, что тоже отрицательно сказалось бы на развитии эмбриона. И только образование малорастворимой в воде мочевой кислоты не влияет на развитие эмбриона, она образует осадок, выключается из обмена. Интересно, что в самый первый период развития эмбрион птиц выделяет в среду аммонийные соли, затем мочевину и, наконец, далее — мочевую кислоту, что сохраняется в течение всего постэмбрионального пути. Таким образом, здесь наблюдается своеобразное биохимическое выражение известного биогенетического закона Мюллера — Геккеля повторения филогенеза в онтогенезе.
У человека и млекопитающих уреотелический тип азотного обмена устанавливается уже во время эмбриогенеза. Образующаяся у них мочевина поступает через плаценту в кровь матери и затем почками удаляется из организма.
У большинства млекопитающих мочевая кислота, образующаяся в небольших количествах как конечный продукт обмена пуриновых оснований, в дальнейшем окисляется с участием фермента печени уратоксидазы до аллонтоина.
У собак, например, почти весь пуриновый азот выделяется с мочой в форме аллантоина. У человека, приматов и птиц нет уратоксидазы, поэтому мочевая кислота у них сама является конечным продуктом пуринового обмена. Свиньи кроме аллантоина выделяют с мочой гуанин, так как у них мала активность гуаниндезамияазы. В связи с этим у свиней описаны случаи гуаниновой подагры, при которой кристаллы гуанина откладываются в суставах. Гуанин является конечным продуктом метаболизма у пауков. Креатин в моче взрослого человека обычно отсутствует или содержится в очень небольших количествах. Однако существует прямая зависимость между содержанием креатина (и креатинфосфата) в мышцах и креатинина в моче. Особенно устойчиво коррелирует содержание креатинина в моче с мышечной массой данного человека.
Выделение самого креатина с мочой достаточно часто наблюдается в детском возрасте. Появление его в моче взрослых (креатинурия) является следствием той или иной патологии: различные формы мышечной дистрофии, миозит (воспаление скелетных мышц), диабет, гипертиреоз, авитаминоз Е. У женщин креатинурия бывает при беременности и в раннем послеродовом периоде.
У беспозвоночных животных вместо креатинина в моче присутствует аргинин, креатинин же обнаруживается крайне редко.
В моче человека также всегда содержится некоторое количество (0,1—2 г в суточном объеме) гиппуровой кислоты. Очень много ее в моче травоядных животных, так как она образуется из бензойной кислоты, продукта расщепления ароматических соединений растительных тканей.

Гиппуровая кислота
Биохимические процессы сформировались на достаточно ранних этапах эволюции до разделения единого потока живой материи по отдельным руслам. В дальнейшем ходе эволюции разные таксономические группы, занимая определенные экологические ниши, формировали специфические особенности белкового метаболизма, которые способствовали их выживанию в конкретных сочетаниях условий жизнеобитания, помогали полнее использовать эти условия.
Высшие растения с их неподвижным образом жизни быстро используют соли азота в зоне корневой системы, поэтому эволюция их азотного обмена шла в направлении экономного использования азота в условиях строго ограниченного его поступления в организм. Поэтому растения не экскретируют продукты обезвреживания аммиака во внешнюю среду. Аспарагин и глутамин являются у них запасными формами азота. Кроме детоксикации аммиака и запасания азота аспарагин и глутамин важны так же, как резервные формы дикарбоновых аминокислот, необходимых для многих метаболических процессов. Содержание амидов в белках растений достигает очень больших величин: в белках семян кукурузы и пшеницы количество дикарбоновых кислот составляет 35—45%, причем большая часть — в форме амидов.
У растений, отличающихся высоким содержанием органических кислот в тканях (щавель, ревень), обезвреживание аммиака происходит путем образования аммиачных солей органических кислот. В тканях некоторых высших растений обнаружена и мочевина, синтезирующаяся в орнитиновом цикле. Большие количества мочевины накапливают некоторые грибы (шампиньоны — до 13%).
Алкалоиды
К алкалоидам принадлежат вещества растительного происхождения, содержащие азот в составе цикла и являющиеся органическими основаниями. В растениях они образуют соли с органическими кислотами, хорошо растворимые в воде.
Общим свойством для всех алкалоидов является способность оказывать сильное физиологическое действие на организм человека и животных. Большинство алкалоидов в малых дозах оказывают возбуждающее действие на нервную систему, а в больших — угнетающее. Многие из них являются сильными ядами (кураре).
В процессе жизнедеятельности растений алкалоиды подвергаются активным ферментативным превращениям и не инертны в обмене веществ, как предполагали ранее. Они являются, видимо, определенной промежуточной формой в ходе превращения азотистых соединений в растениях, в которой азотистые продукты обмена веществ обезвреживаются и сохраняются. Установлена роль некоторых алкалоидов табака (например, никотина) как исходного материала для синтеза пиридиновых дегидрогеназ. По своему строению алкалоиды весьма разнообразны, их делят на группы в зависимости от химической природы азотистого гетероцикла.
Важнейшим представителем группы производных хинолина является хинин. Он содержится в коре хинного дерева и применяется в медицине при лечении малярии.
Морфин и кодеин, представители группы изохинолиновых алкалоидов, содержатся в опии — млечном соке опийного мака. К группе алкалоидов — производных индола — относится стрихнин, содержащийся в семенах чилибухи. Большие дозы стрихнина вызывают появление сильных судорог и смерть от паралича дыхания.
Одним из представителей алкалоидов группы тропана является атропин, содержащийся в растениях семейства пасленовых: красавке, белене, различных видах дурмана. Широко применяется в медицине.
В молекуле никотина соединены между собой пиридин и пирролидин. Никотин — бесцветная, маслянистая жидкость, действует на центральную и периферическую нервную систему. При отравлении им наступает смерть от паралича дыхания.
6.УГЛЕВОДЫ
|
|
|


