 |
Меланоцитостимулирующий гормон
|
|
|
|
Подготовила:
Студентка гр.Д-109
Чигирёва Е.А.
Проверил:
Ст.преподаватель
Сергеенко С.М.
Гомель 2013
МЕЛАНОЦИТСТИМУЛИРУЮЩИЙ ГОРМОН
(МСГ, меланотропин), пептидный гормон гипофиза. Различают 3 типа М. г.-a, b и g. Для a- и b-М. г. характерно наличие в структуре общего гептапептида MetЧGluЧHisЧPheЧArgЧTrpЧGly (букв. обозначения см. в ст. Аминокислоты); у-М. г. содержит общий для всех типов М. г. тетра-пептид HisЧPheЧArgЧTrp.
Для первичной структуры а-М. г. характерна высокая консервативность. У большинства млекопитающих он представляет собой тридекапептид (мол. м. 1665) с ацетилиро-ванной N-концевой и амидированной С-концевой аминокислотами: CH3C(O)NHЧSerЧТуrЧSerЧMetЧGluЧHisЧPheЧArgЧTrpЧGlyЧLysЧProЧValЧC(O)NH2.
р-М. г. мн. млекопитающих состоит из 18 аминокислотных остатков, напр. у обезьян полипептидная цепь имеет след. аминокислотную последовательность: Удр. видов млекопитающих встречаются замены остатков аминокислот по сравнению с р-М. г. обезьяны в положениях 2, 6, 8 и 16. У человека b-М. г. состоит из 22 аминокислотных остатков (мол. м. 2661) и содержит, в отличие от других р-М. г. млекопитающих, на N-конце остаток тетрапептида H2NЧAlaЧGluЧLysЧLysЧ.
g-М. г. в настоящее время идентифицирован в гипофизе лишь незначит. числа млекопитающих и рыб. У крысы он является гликопептидом, построенным из 25 остатков аминокислот, у др. видов предполагается существование и более низкомол. у-М. г.
М. г. синтезируются и секретируются в кровь промежут. долей гипофиза, где они образуются из общего предшественника -проопиомеланокортина. Причем а-М. г. образуется в ходе процессинга (превращений) адренокортикотропина, а р-М. г.-b -липотропина, в состав к-рых входят аминокислотные последовательности М. г. Предшественник g-М. г.-N-концевой фрагмент (т. наз. 16К-фрагмент) проопиомеланокортина.
|
|
|
Осн. роль М. г. в организме заключается в стимуляции ф-ции и роста меланоцитов, вырабатывающих пигмент меланин, т. е. в регуляции пигментации, a- и b-М. г. обладают высокой липотропной активностью (стимулируют распад жира в жировых депо). a-М. г. участвует также в терморегуляции тела и обладает невысокой стероидогенной активностью. Предполагают, что у плодов он является осн. гормоном, регулирующим ф-цию надпочечников,. Помимо гипофиза М. г. обнаружен в разл. отделах головного мозга. Этот гормон имеет, по-видимому, внегипофизарное происхождение и играет важную роль в регуляции поведенческих р-ций и в механизмах памяти у человека и животных. Эта активность М. г. обусловлена наличием в их структуре гептапептида, общего для a- и b-М. г., адренокортикотропина и b-липотропина. Др. эффекты М. г. также в той или иной степени связаны с этим гептапептидом.
Функции
МСГ стимулируют синтез и секрецию меланинов (меланогенез) клетками-меланоцитами кожи и волос, а также пигментного слоя сетчатки глаза. Наиболее сильное влияние на пигментацию оказывает альфа-меланоцитстимулирующий гормон.
У многих амфибий и рептилий МСГ вызывает потемнение покровов в темноте или на темном субстрате, стимулируя дисперсию меланиновых гранул внутри клеток-меланофоров кожи.
У людей повышение уровня МСГ также вызывает потемнение кожи. Это происходит, например, при беременности, а также при болезни Аддисона, когда наряду с повышением уровня АКТГ повышается и уровень МСГ. Различия в уровне МСГ не являются главной причиной межрасовых различий в цвете кожи. У людей с рыжими волосами и светлой кожей, не способной к загару присутствует мутация в гене одного из рецепторов МСГ.
Рецепторы МСГ
Рецепторы МСГ относятся к семейству серпентиновых рецепторов, связанных с G-белками. У млекопитающих существует пять типов меланокортиновых рецепторов.
|
|
|
Мс1r (MC1, Mc1r или рецептор меланоцитстимулирующего гормона) является одним из главных белков, регулирующих цвет кожи и волос. Он функционирует на поверхности меланоцитов, регулирующие меланогенез у млекопитающих. Под действием одного их продуктов расщепления проопиомеланокортина (как правило, это альфа-меланоцитстимулирующий гормон), MC1R инициирует сложный сигнальный каскад, который приводит к выработке чёрного или коричневого эумеланина. У большинства млекопитающих данный сигнал может быть изменён связыванием другого белка с MC1R. Белок Агути (Agouti signal protein, Asip) ингибирует взаимодействие MC1R. с альфа-меланоцитстимулирующим гормоном, что в результате приводит к выработке красного или жёлтого феомеланина. Пульсирующий характер передачи сигнала с помощью Агути через MC1R. приводит к выработке характерного окраса агути (чередование желтых и чёрных полос на волосе) у большинства млекопитающих. У некоторых видов секреция Агути не пульсирующая, она меняется не во времени, а в зависимости от участка тела. Особенно это хорошо заметно у лошадей, у которых окраска ног, хвоста и гривы чёрная, а тела - красноватая. Исключение составляют человеческие волосы, на цвет которых белок Аугит не влияет.
Mc2r - рецептор адренокортикотропного гормона (рецептор АКТГ, MC2) является специализированным рецептором клеток коры надпочечников и реагирует на AКТГ. Он находится в корковом слое надпочечников и стимулирует выработку кортизола. Рецептор АКТГ использует цАМФ в качестве посредника.
Mc3r присутствует на клетках разных тканей, кроме коры надпочечников и меланоцитов. У нокаутных мышей повышена масса жира, несмотря на уменьшенное потребление пищи, что свдетельствует об участии этого рецептора в регуляции пищевого гомеостаза.
Mc4r также связывает α-меланоцитстимулирующий гормон. На мышах было показано, что MC4R участвует в регуляции пищевого поведения, обмена веществ и полового поведения.
В 1998 году было обнаружено, что мутации в гене MC4R связаны с наследственной тучностью у человека. Они проявляются в гетерозиготном состоянии, что свидетельствует об аутосомно-доминантном характере наследования. Другие исследования и наблюдения показали, что эти мутации имеют неполное доминирование и некоторую степень кодоминирования.
|
|
|
Меланоцитостимулирующий гормон, МСГ, меланотропин, интермедин, гормон животных и человека, выделяемый задней и промежуточноaй долями гипофиза, участвует в образовании пигментов покровов и сетчатки глаза. МСГ — полипептид; различают 2 разновидности гормона: a-МСГ, состоящий из 13 аминокислотных остатков, и b-МСГ — из 18; a-МСГ имеет одинаковое строение у разных видов животных; b-МСГ лошади и быка отличаются по двум, а свиньи — по одной аминокислоте от b-МСГ обезьяны. У человека (b-МСГ состоит из 22 остатков, причём участок из 18 аминокислот соответствует b-МСГ обезьяны. В структуре всех МСГ имеется участок из 7 остатков (гептапептид), ответственный за активность гормона. Этот участок входит также в полипептидную цепь адренокортикотропного гормона (АКТГ), чем объясняется меланоцитостимулирующая активность последнего. У низших позвоночных МСГ вызывает расширение меланофоров кожи. Введение синтетического МСГ рыбам и земноводным вызывает у них образование кожных пигментов. Функции МСГ у птиц и млекопитающих полностью не выяснены; по-видимому, этот гормон стимулирует синтез меланинов в коже млекопитающих, активируя фермент тирозиназу. Секреция МСГ регулируется гипоталамусом, который вырабатывает специальные пептидные вещества, стимулирующие или подавляющие выделение МСГ в кровь. Препараты МСГ назначают для повышения остроты зрения, улучшения адаптации к темноте, для лечения некоторых глазных болезней, например пигментной дегенерации сетчатки.
Регуляция биосинтеза гормонов
В поддержании упорядоченности, согласованности всех физиологических и метаболических процессов в организме участвует более 100 гормонов и нейромедиаторов. Их химическая природа различна (белки, полипептиды, пептиды, аминокислоты и их производные, стероиды, производные жирных кислот, некоторые нуклеотиды, эфиры и т. д.). У каждого класса этих веществ пути образования и распада разные.
|
|
|
Белково-пептидные гормоны. В эту группу входят все тропные гормоны, либерины и статины, инсулин, глюкагон, кальцитонин, гастрин, секретин, холецистокинин, ангиотензин II, антидиуретический гормон (вазопрессин), паратиреоидный гормон и др.
Эти гормоны образуются из белковых предшественников, называемых прогормонами. Как правило, сначала синтезируется препрогормон, из которого образуется прогормон, а затем гормон.
Синтез прогормонов осуществляется на мембранах гранулярной эндоплазматической сети (шероховатый ретикулум) эндокринной клетки (рис 5.4). Большое значение для этих процессов имеет способность препрогормонов проникать через мембрану эндоплазматической сети в ее внутренние полости за счет того, что первые 20—25 аминокислотных остатков с N-конца у многих белковых предшественников являются одинаковыми, а на наружной мембране эндоплазматической сети имеются структуры, «узнающие» эту последовательность. В результате становится возможным внедрение молекулы препрогормона в липидный бислой мембраны и постепенное проникновение белкового предшественника во внутреннее пространство эндоплазматической сети.
Везикулы с образующимся прогормоном переносятся затем в пластинчатый комплекс (комплекс Гольджи), где под действием мембранной протеиназы от молекулы прогормона отщепляется определенная часть аминокислотной цепи. В результате образуется гормон, который поступает в везикулы, содержащиеся в комплексе Гольджи. В дальнейшем эти везикулы сливаются с плазматической мембраной и высвобождаются во внеклеточное пространство.
Различные этапы синтеза гормонов имеют неодинаковую продолжительность. Например, синтез молекулы проинсулина происходит за 1—2 мин. Транспорт проинсулина от эндоплазматической сети до комплекса Гольджи занимает 10—20 мин. «Созревание» везикул, несущих инсулин от комплекса Гольджи до плазматической мембраны, длится 1—2 ч. При действии глюкозы на β-клетки панкреатических островков (см. рис. 5.1) стимулируется главным образом слияние инсулиновых везикул с плазматическими мембранами, что и приводит к усиленной секреции инсулина, а скорость предыдущих этапов образования гормонов изменяется в меньшей степени. Концентрация других пептидных гормонов в крови также регулируется не влиянием на скорость их синтеза или внутриклеточного транспорта, а изменением скорости секреции. Во многом это обусловлено тем, что в секреторных гранулах содержится такое количество гормона, что его концентрация в крови может многократно повышаться без дополнительного синтеза.
Поскольку многие полипептидные гормоны образуются из общего белкового предшественника, изменение синтеза одного из этих гормонов может приводить к параллельному изменению (ускорению или замедлению) синтеза ряда других гормонов. Так, из белка проопиокортина образуются кортикотропин и β-липотропин (схема 5.1), из β-липотропина может образоваться еще несколько гормонов: γ-липотропин, β-меланоцитостимулирующий гормон, β-эндорфин, γ-эндорфин, α-эндорфин, метионин-энкефалин.
|
|
|
При действии специфических протеиназ из кортикотропина могут образовываться α-меланоцитостимулирующий гормон и АКТГ-подобный пептид средней доли гипофиза. Благодаря сходству структур кортикотропина и α-меланоцитостимулирующего гормона последний имеет слабую кортикотропную активность. Кортикотропин обладает незначительной способностью усиливать пигментацию кожи.
Концентрация белково-пептидных гормонов в крови обычно составляет 10-9—10-10 М. При стимуляции эндокринной железы концентрация соответствующего гормона возрастает в 2—5 раз.
Период полураспада белково-пептидных гормонов в крови составляет 10—20 мин. Они разрушаются протеиназами клеток-мишеней, крови, печени и почек.
Регуляция
Меланоцитстимулирующий гормон (МСГ, меланотропин) существует в двух формах — α— и β—МСГ, которые являются полипептидами и весьма близки по структуре к АКТГ. α—форма МСГ человека содержит 13 аминокислотных остатков, β—форма — 22. Регуляция функции клеток промежуточной доли гипофиза, вырабатывающих МСГ, осуществляется гипоталамическими либеринами МСГ—РГ и статинами МСГ—ИГ.
Основная функция МСГ заключается в стимуляции биосинтеза кожного пигмента меланина, а также увеличении размеров и количества пигментных клеток. Действие МСГ у рыб, амфибий и пресмыкающихся состоит в увеличении пигментации кожи за счет дисперсии меланина в пигментных клетках (меланофорах или меланоцитах). Изменение окраски кожных покровов имеет существенное защитное значение, так как животное может иметь окраску, близкую к цвету окружающей среды. У млекопитающих МСГ участвует в сезонных изменениях пигментации кожи и меха; этот гормон может влиять и на возбудимость нервной системы, участвовать в генезе положительных эмоций. Поскольку меланин является антиоксидантом, подавляющим перекисное окисление липидов, МСГ можно считать гормоном—протектором, защищающим нейроны от перевозбуждения и повреждения активными метаболитами кислорода.
Все гормоны гипофиза оказывают позитивное воздействие на рост, дифференцировку, иммунную активность иммунокомпетентных клеток и органов.
СЕМЕЙСТВО ПЕПТИДОВ ПРООПИОМЕЛАНОКОРТИНА (ПОМК)
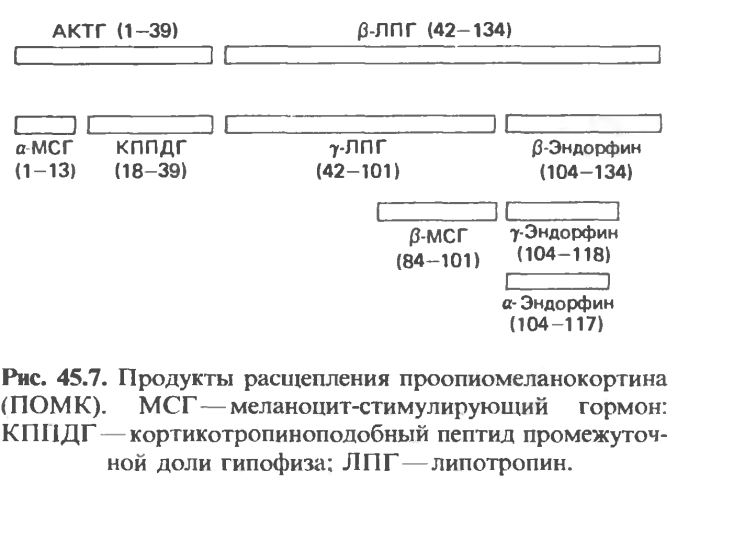
Это семейство состоит из пептидов, действующих либо как гормоны (адренокортикотропин, ли- потропин, меланоцит-стимулирующий гормон), либо как нейромедиаторы или нейромодуляторы. Про- опиомеланокортин (ПОМК) синтезируется в виде молекулы предшественника, состоящей примерно из 285 аминокислотных остатков, и подвергается различному процессингу в разных отделах гипофиза.
Распределение, процессинг и функции продуктов гена ПОМК
Ген ПОМК экспрессируется в передней и промежуточной долях гипофиза. Наиболее консервативные последовательности, сохраняющиеся у разных видов, локализуются в N-концевом фрагменте, кодирующем АКТГ и Р-эндорфин. ПОМК или родственные ему продукты присутствуют во многих других тканях позвоночных, включая мозг, плаценту, желудочно-кишечный тракт, половой тракт, легкие и лимфоциты. Это обусловливается главным образом экспрессией гена ПОМК в указанных тканях, а не поглощением продуктов гена из плазмы; однако такой механизм можно считать доказанным только для мозга, плаценты и семенников. Родственные пентиды найдены также у многих видов беспозвоночных.
Процессинг белка ПОМК в передней и промежуточной долях гипофиза протекает по-разному. У взрослых людей промежуточная доля рудиментарна, но она активна у плодов человека, женщин в поздние сроки беременности, а также у многих видов животных. Процессинг белка ПОМК в периферических тканях (кишечник, плацента, мужской половой тракт) сходен с таковым в промежуточной доле гипофиза. Существуют три основные группы пептидов семейства ПОМК: 1) АКТГ, из которого могут образовываться меланоцит-стимулирующий гормон (а-МСГ) и кортикотропиноподобный пептид промежуточной доли; 2) Р-липотропин (р-ЛПГ), служащий предшественником а-липотропина, Р-МСГ и Р-эндорфина и. следовательно, а- и у-эндорфинов; 3) большой IS-концевой пептид, из которого обра
зуется у-МСГ. Разнообразие этих продуктов обусловлено наличием множественных кластеров двухосновных аминокислот, которые представляют собой потенциальные участки расщепления для трип- синоподобных ферментов. Каждому из упомянутых пептидов предшествуют остатки Lys-Arg, Arg-Lys, Arg-Arg или Lys-Lys. Сегмент прогормона отщепляется и подвергается посттрансляционной модификации путем гликозилирования, ацетилирования и фо- сфорилирования. Следующее расщепление продуктов ПОМК в передней и промежуточной доле гипофиза происходит на участке между АКТГ и Р-ЛПГ, что приводит к отделению N-концевого пептида, включающего АКТГ, от Р-ЛПГ (рис. 45.7). АКТГ,_39 затем отделяется от N-концевого пептида, дальнейших расщеплений в передней доле гипофиза практически не происходит. В промежуточной доле АКТГ,_39 расщепляется на а-МСГ (остатки 1—13) и кортикотропиноподобный пептид (18—39); Р-липотропин (42—134) превращается в у-липотропин (42—101) и Р-эндорфин (104—134); Р-МСГ (84-101) образуется из у-липотропина.
Перечисленные пептиды претерпевают множество дополнительных модификаций. Большая часть N- концевого пептида и АКТГ,_39 находится в передней доле гипофиза в гликозилированном состоянии, а- МСГ обнаруживается преимущественно в N-аце- тилированной и амидированной с С-конца форме; деацетилированный а-МСГ намного менее активен. p-Эндорфин в промежуточной доле быстро ацетили- руется; ацетилированный Р-эндорфин в противоположность а-МСГ обладает в 1000 раз меньшей активностью, чем немодифицированная форма. Таким образом, Р-эндорфин может находиться в гипофизе в неактивном состоянии. В гипоталамусе молекулы этого пептида не ацетилированы и, по-видимому, присутствуют в активной форме. Р-Эндорфин подвергается также укорочению с С-конца с образованием Х- и у-эндорфинов (рис. 45.7). Таковы три главных эндорфина в промежуточной доле гипофиза грызунов. Большой N-концевой фрагмент, вероятно, тоже подвергается множественному расщеплению, но о его судьбе известно меньше, хотя в гипофизах крысы и крупного рогатого скота найден у-МСГ. Изложенные сведения о структуре пептидов получены главным образом при исследованиях гипофиза грызунов, но общая схема превращений, по-видимому, верна и для других видов.
Функции большинства пептидов семейства ПОМК точно не установлены. Постулированные для них эффекты перечислены в табл. 45.4.
Регуляция синтеза ПОМК
ПОМК синтезируются приблизительно 5% клеток передней доли гипофиза и всеми клетками промежуточной доли. Регуляция синтеза и секреции ПОМК в этих отделах гипофиза сильно различаются.
А. Передняя доля. Кортикотропин-рилизинг- гормон (КРГ, кортиколиберин) является основным фактором, регулирующим высвобождение ПОМК из передней доли гипофиза. Он действует через сАМР-опосредованную систему, требующую присутствия Са2+. Стимулирующий эффект кортиколи- берина на секрецию ПОМК непосредственно предотвращается глюкокортикоидными гормонами. Глюкокортикоиды могут также оказывать влияние на гипоталамус, ингибируя образование кортиколи- берина, его секрецию или оба этих процесса. Адре- налэктомия (которая уменьшает количество глюко- кортикоидов и повышает уровень КРГ) сопровождается 20-кратным увеличением транскрипции гена ПОМК. Одновременное введение глюкокортикои- дов может, однако, уменьшить этот прирост, причем тормозящее действие глюкокортикоидов, по- видимому, осуществляется через специфические рецепторы. Ингибирование секреции АКТГ глюкокор- тикоидами происходит быстрее, чем воздействие на транскрипцию гена ПОМК, поэтому можно предположить, что эти эффекты опосредуются независимыми механизмами. Минорные эффекты на секрецию ПОМК (АКТГ) передней долей включают прямую стимуляцию процесса вазопрессином и а- адренергическими агентами, непрямую стимуляцию (через центральную нервную систему) серотонином и ацетилхолином и торможение у_аминомасляной кислотой (ГАМК). Дофамин на секрецию ПОМК не влияет.
Б. Промежуточная доля. Эта доля гипофиза бедна кровеносными сосудами; гипоталамо-гипофизарная портальная система ее не достигает, и поэтому на нее не влияет кортиколиберин. В промежуточной доле нет рецепторов глюкокортикоидов, что исключает участие этих гормонов в регуляции продукции ПОМК. Промежуточная доля гипофиза обильно ин- нервирована дофаминергическими волокнами и, кроме того, содержит серотонинергические и катехо-ламинергические нервные окончания. Агонисты дофамина (эргокриптин) снижают, а антагонисты (га- лоперидол) повышают количество мРНК ПОМК и секрецию пептидов ПОМК. Время и степень этих изменений предполагают наличие сопряжения между образованием и секрецией пептидов. Указанные вещества не влияют на переднюю долю гипофиза. Высвобождение ПОМК в промежуточной доле стимулируется серотонином и Р-адренергическими агентами.
В. Другие ткани. О регуляции продукции ПОМК в других тканях известно мало. На нее не влияют ги- пофизэктомия, адреналэктомия, кортиколиберин и глюкокортикоиды. Хронический стресс (иммобилизация) повышает содержание АКТГ в плазме и снижает его в гипофизе, но в мозге количество ПОМК при этом не меняется. В то же время острый стресс приводит к уменьшению количества Р- эндорфина в гипоталамусе. Высвобождение р- эндорфина из гипоталамуса может стимулироваться эстрогенами.
Патология Меланоцитостимулирующий гормон (МСГ). Вырабатывается МСГ в средней доле гипофиза, которая имеется у низших животных и млекопитающих. У человека она практически отсутствует, а клетки, характерные для средней доли гипофиза, единично представлены в дистальной части гипофиза. При беременности наблюдается увеличение объема средней доли гипофиза с повышением ее функциональной активности.
α-МСГ представляет собой простую полштептидную цепь, включающую такую последовательность 13 аминокислотных остатков: Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Lys-Gly-Prc-Val. Молекулярная масса α-МСГ составляет 1800 Да. Он высвобождается из молекулы АКТГ путем протеолиза и ацетилирования N-концевого фрагмента. У человека α -МСГ обнаруживается лишь в опухолях и в гипофизах плода. α -МСГ выявляется в различных отделах ЦНС, но его N-концевой фрагмент не ацетилирован, так как N-ацетилирующая активность слабо представлена в клетках передней доли гипофиза и отсутствует в других областях ЦНС.
Р-МСГ изолирован из гипофиза млекопитающих. Его молекула включает 18 аминокислотных остатков. До недавнего времени считалось, что гипофиз человека продуцирует Р-МСГ, состоящий из 22 аминокислот. Однако дальнейшие исследования, направленные на уточнение механизма образования β-МСГ, показали, что получение Р-МСГ человека было артефактом: выделенный гормон оказался фрагментом b-липотропина человека и наличие β-МСГ человека было связано с посмертными процессами аутолиза и протеолиза. У человека β-МСГ как самостоятельный гормон отсутствует (хотя не все исследователи с этим согласны), а мела-ноцитосгимулирующим эффектом обладают два гормона: АКТГ и β-люютропин. При патологических состояниях проявляющихся избыточной пигментацией (болезни Иценко—Кушинга, болезни Аддисона) и повышенным отложением меланина, всегда обнаруживается повышенное содержание в сыворотке крови как АКТГ, так и β -липотрошша.
Меланоцитостимулирующие гормоны принимают участие в процессах образования и перераспределения пигмента в организме. Под влиянием МСГ изменяется активность ферментных систем в меланофорах, где из тирозина в присутствии тирозиназы образуется пигмент меланин. Дисперсные гранулы меланина агрегируются, давая темную окраску кожи.
Этот переход меланина из дисперсного состояния в агрегатное (из геля в золь) осуществляется под влиянием внешних факторов
(освещенности и др.).
|
|
|


