 |
Электролиз. Рис. 6. 8 Схема устройства электролизера с диафрагмой
|
|
|
|
Электролиз
Электролиз – это окислительно-восстановительный процесс, протекающий под действием постоянного электрического тока.
При электролизе энергия электрического тока превращается в химическую энергию, вследствие чего становится возможным осуществление несамопроизвольного процесса. Путем электролиза можно проводить реакции, которые химическим путем при обычной температуре не идут.
Электролиз используют в промышленности: для получения металлов из солевых расплавов (например, Al, Mg, Ti и др. ); для очистки металлов от примесей (электрорафинирование); для получения водорода и кислорода из воды; хлора и щелочей из раствора NaCl и получения многих других веществ.
В технике электролиз нашел применение для нанесения гальванопокрытий на металлические и пластмассовые изделия, а также в гальванопластике. Гальванопластика позволяет получить очень тонкостенные изделия с толщиной, исчисляемой микронами. Электролиз используют для изготовления печатных плат.
Процессы электролиза осуществляются в устройствах, называемых электролизерами, конструкция которых в каждом случае индивидуальна. Простейший электролизер (рис. 6. 8. ) представляет собой емкость, заполненную электролитом, в который опущены два электрода: анод подсоединен к положительному полюсу источника тока (+), а катод подсоединен к отрицательному полюсу (-). На аноде протекают реакции окисления, а на катоде – восстановления. Чтобы исключить взаимодействие анодных и катодных продуктов, электролизеры разделяются специальными диафрагмами, изготовленных из инертных материалов (керамики, пластмасс, асбеста и др. ).
|
|
|
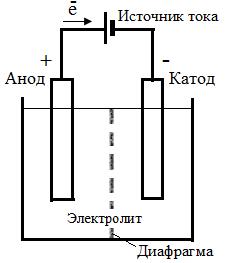
Рис. 6. 8 Схема устройства электролизера с диафрагмой
Классификация процессов электролиза довольно затруднена, однако наиболее общей может служить разделение его на электролиз растворов с растворимыми и нерастворимыми анодами. В первом случае материал анода является участником электродных процессов, а во втором – токоподводом и катализатором.
В качестве растворимых анодов при электролизе водных растворов могут выступать металлы, стоящие в ряду напряжений после алюминия до платины. В роли нерастворимых анодов используются благородные металлы (Pt, Au, Ir), графит, всевозможные оксидные композиты на основе марганца, свинца, титана и т. д.
В качестве катодов можно использовать любой из невосстанавливаемых материалов (графит, титан, сталь, медь, никель и др. ).
Схема электролизера может быть представлена в виде:
(-) Катод | Электролит | Анод (+),
где вертикальная черта означают границу электрод - электролит.
Электролитами могут служить растворы или расплавы.
Для определения продуктов электролиза и самой окислительно-восстановительной реакции необходимо составить «схему электролиза». Она включает в себя несколько последовательных действий:
1. Представить электролит в виде ионов. В растворе или расплаве электролита ионы находятся в хаотичном движении. Под действием электрического тока ионы приобретают направленное движение: катионы направляются к отрицательно заряженному электроду (катоду), анионы – к положительно заряженному электроду (аноду).
При электролизе водных растворов следует учитывать реакции разряда молекул воды на электродах:
(-) К: 2H2O + 2 ē = H2 + 2 OH- Е0Н2O/OH- =- 0, 82B (pH=14)
(+) А: 2H2O – 4 ē = O2 + 4 H+ Е0O2/H2O = +1, 23B (pH=0)
2. Написать реакции восстановления и окисления ионов (и воды, в случае электролиза водного раствора) на катоде и аноде с указанием их потенциалов.
|
|
|
3. Определить, к какому типу относится анод. В случае растворимого анода написать анодную реакцию его окисления с указанием потенциала. Материал катода непосредственного участия в реакции восстановления не принимает.
Возможные на электродах реакции называются конкурирующими.
Сравнив электродные потенциалы реакций, установить очередность протекания конкурирующих реакций на электродах. На катоде первой будет идти реакция с наибольшим потенциалом, а на аноде – с наименьшим.
4. В выбранных реакциях при помощи коэффициентов уравнять число электронов и сложить эти реакции. Полученная реакция и будет той несамопроизвольной ОВР, которая идет под действием электрического тока.
Использование стандартных электродных потенциалов для определения последовательности электродных реакций условно, так как прохождение тока через электролизер сопровождается поляризацией электродов. Результатом поляризации является смещение электродных потенциалов: у анода – в положительную сторону, а у катода – в отрицательную. Кроме того, степень смещения этих потенциалов зависит от материала электродов. Это объясняется тем, что электроды являются не только токоподводами, но и выполняют роль катализаторов электродных реакций. Очевидно, что каталитическая активность различных материалов по отношению к конкретной реакции является различной. Степень затрудненности электродных реакций на электродах из различных материалов оценивается параметром, называемым перенапряжение (h, В).
Перенапряжения катодного выделения металлов сравнительно невелики.
С высоким перенапряжением, как правило, протекает процесс образования газов, таких как водород и кислород. Минимальное перенапряжение водорода на катоде в кислых растворах наблюдается на платине (h=0, 1В), а максимальное − на свинце, цинке, кадмии и ртути. Перенапряжение изменяется при замене кислых растворов на щелочные. Например, на платине в щелочной среде перенапряжение водорода h=0, 31 В. Анодное выделение кислорода также связано с перенапряжением. Минимальное перенапряжение выделения кислорода наблюдается на Pt-электродах (h=0, 7 В), а максимальное − на цинке, ртути и свинце.
|
|
|


