 |
Общие закономерности химических реакций
|
|
|
|
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ОТКРЫТЫЙ
УНИВЕРСИТЕТ
Кафедра философии
Лабораторный журнал
По химии
Студента(ки).......................................................................факультета
Ф.И.О………………………………………………………………..
(шифр ……………………..)
Преподаватель
………………………………………………………………
Журнал начат ………………………………… 20.....г.
Журнал закончен. 20.....г.
Элементы теории, примеры зачетных задач
В общем виде для гомогенной реакции: mA+nB=pD+qE закон действия масс (ЗДМ) выражается как: v=k C(A)m C (B)n, где С(А), С(B) - молярные концентрации веществ А и В; m, n - стехиометрические коэффициенты; k - константа скорости реакции..
В гетерогенных процессах концентрация кристаллического вещества постоянна, поэтому она учитывается в константе скорости и не входит в выражение ЗДМ.
Пример 1. Как и во сколько раз изменится скорость гомогенной газовой реакций 2NO+Н2=N20+Н20 при увеличении концентрации NO в системе в три раза?
Решение
До увеличения концентрации: v1=kC(NO)2C(H2)
После увеличения концентрации:
v2=k{3C(NO)}2C(H2)=9kC(NO)2C(H2)=9v1
Скорость реакции увеличилась в 9 раз.
Пример 2. Как и во сколько раз изменятся скорости реакций при уменьшении давления в системах в три раза:
а) Для гомогенного газового процесса: 2NO+Cl2=2NOCl?
б) Для гетерогенного процесса: СаО(к) + SO3(г) = СаSO4(к)?
Решение
а) До уменьшения давления: v1=kC(NO)2C(Cl2).
Уменьшение давления при постоянной температуре приведет к пропорциональному увеличению объема системы и уменьшению концентраций газообразных веществ:
v2=k{1/3C(NO)}2•1/3C(Cl2)=1/27kC(NO)2C(Cl2)=1/27 v1. Скорость реакции уменьшилась в 27 раз.
б) v1=kC(SO3).
v2=k•1/3 C(SO3)=1/3 v1
Скорость реакции уменьшилась в 3 раза.
--------------------------------------------------------------------------------------------------------------
|
|
|
Катализаторы - это вещества, которые, как правило, селективно увеличивают скорость химических реакций, принимают участие в промежуточных процессах, регенерируются в ходе реакций и не входят в состав конечных продуктов.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 1
Общие закономерности химических реакций
опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ (закон действия масс)
Уравнение реакции взаимодействия тиосульфата натрия и серной кислоты: Na2S2O3+ Н2SO4=S↓+Н2O+SO2+Na2SO4. Скорость реакции выразим через изменение концентрации выпадающей в осадок серы ∆С(S): v=∆С(S)/t. Опалесценсия раствора становится заметной при определенном ∆С(S). Поэтому v∞1/t, а величину v'=1/t можно принять за относительную скорость.
Выражение ЗДМ для данной реакции:................................
Таблица измерений и расчетов:
| № измер. | Объем, см3 | Относ, конц. Na2S2O3 | Время появлен. опалесц., t, c | Условн. скорость v’=1/t, с -1 | Относит, скорость v=v’/vmin | |||
| Na2S2O3 | Н2O | Н2SO4 | Общий | |||||
| - | ||||||||

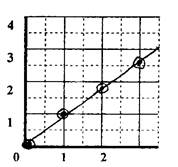 График теоретической и экспериментальной зависимости относительной скорости реакции у от относительной концентрации тиосульфата натрия С (Na2S2O3):
График теоретической и экспериментальной зависимости относительной скорости реакции у от относительной концентрации тиосульфата натрия С (Na2S2O3):
Вывод (о выполнении закона действия масс для данной конкретной реакции):
_________________________________________________
_________________________________________________
_________________________________________________
_________________________________________________
_________________________________________________
_____________________________________________________________________
опыт 2. Зависимость скорости от катализатора
а) Реакция разложения пероксида водорода без катализатора:
…………………………………………………………………………………………
б) Гомогенный катализ
{}
Элементы теории, примеры зачетных задач
При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газ или раствор).
|
|
|
При гетерогенном катализе катализатор находится в системе в виде самостоятельной фазы (обычно твердое вещество). Все реакции протекают на его поверхности.
--------------------------------------------------------------------------------------------------------
Реакции, которые с заметной скоростью протекают и в прямом, и обратном направлениях, называются обратимыми. Они идут не до конца, ни одно из реагирующих веществ не расходуется полностью.
Состояние, при котором скорость прямой реакции равна скорости обратной реакции называется химическим равновесием. Оно может продолжаться сколь угодно долго, если не изменять внешних условий. Концентрации участников реакции в состоянии равновесия называются равновесными. Их обозначают квадратными скобками. Равновесие характеризуется константой химического равновесия К Для обратимой гомогенной реакции mА+nВ <=> рD+qЕ:
K= 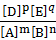
Величина константы равновесия от концентрации не зависит. В выражение константы равновесия гетерогенных реакций не входят концентрации кристаллических веществ.
Изменение параметров системы, приводящее ее к новому состоянию равновесия путем преимущественного протекания прямого или обратного процессов, называется смещением химического равновесия соответственно в прямом или обратном направлении.
Качественные задачи смещения химического равновесия могут быть решены с помощью принципа Ле Шателье: если на систему, находящуюся в состоянии равновесия, оказать какое-либо внешнее воздействие, то в результате протекания процессов в системе равновесие сместится в направлении, приводящем к уменьшению оказанного воздействия.
Пример 3. Напишите выражение для константы равновесия гетерогенного процесса: А2(Г)+2В(К)<=> 2АВ(Г); ∆Н>0. Как увеличение давления отразится на состоянии равновесия? В каком направлении сместится равновесие при уменьшении температуры?
в) Гетерогенный катализ (уравнение реакции (а) с указанием катализатора и фазовой принадлежности участников реакции):
__________________________________________________________________________________________________________________________________________________________________________________________________________________
опыт 3. Смещение химического равновесия при изменении концентрации реагирующих веществ
|
|
|
Уравнение обратимой реакции: FеС13+ЗКSСN<=> Fe(SCN)3+ЗКСl Интенсивную красную окраску имеет один из продуктов реакции, роданид железа Fе(SCN)з.
| Добавлено в раствор | Изменение интенсивности окраски (усиление или ослабление) | Направление смещения равновесия (вправо или влево) | Выражение для константы равновесия данной реакции: K = |
| FеСl3 | |||
| КSСN | |||
| КСl |
Как зависит к от концентраций FеСl3, КSСN, КС1?
__________________________________________________________________________________________________________________________________________________________________________________________________________________
Вывод (конкретно о выполнении принципа Ле Шателье для данного опыта):
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата: Подпись преподавателя
Элементы теории, примеры зачетных задач
Решение
К=[АВ]2/[А2].
По принципу Ле Шателье при увеличении давления равновесие сместится в сторону процесса, приводящего к уменьшению давления, т.е. в сторону меньшего количества моль газов. Поскольку из 1 моль газа образуется 2 моль газа, при увеличении давления равновесие сместится в обратном направлении, влево.
При уменьшении температуры равновесие сместится в сторону реакции, сопровождающейся увеличением температуры, т.е. в сторону экзотермической реакции. Если прямая реакция эндотермическая (∆Н>0), то обратная - экзотермическая. Следовательно, при уменьшении температуры равновесие сместится в сторону обратной реакции, влево.
________________________________________________________________________
Индикаторами называются слабые органические кислоты (HInd) или основания (Ind’OH), которые изменяют окраску в зависимости от рН раствора, поскольку их молекулярная и ионная форма в растворе имеют различную окраску.
________________________________________________________________________
Гидролизом называется взаимодействие ионов соли с молекулами воды, приводящее за счет образования слабого электролита к смещению ионного равновесия воды.
|
|
|
Пример 4. Гидролиз сульфата и хлорида хрома, Сr2(SO4)3 и СrС1з. Соли образованы слабым основанием Сr(ОН)3 и сильными кислотами Н2SО4 и НСl, соответственно. Гидролизу подвержен ион, образующий слабый электролит. Поэтому гидролиз обеих солей протекает по катиону:
Сr3++НОН <=>С rОН2++Н+. Среда кислая, рН<7.
Молекулярные уравнения:
Сr2(SO4)3+2Н2O <=> 2Сr(OН)SO4+Н2SO4.
СrСl3+Н2O <=>Сr(ОН)Сl2+НСl.
Пример 5. Гидролиз фосфата калия К3РО4. Соль образована слабой кислотой Н3РО4 и сильным основанием КОН. Гидролиз протекает по аниону:
РО43+HОН <=> НРО42-+ OH-. Среда щелочная, рН>7.
Молекулярное уравнение: К3 РO4+Н2O <=> К2Н РО4+КОН.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ №2
растворы электролитов
опыт 1. Ознакомление с окраской индикаторов в различных средах
Окраска индикаторов:
| Название индикатора | Цвет индикатора в растворе: | ||
| нейтральном | кислом | щелочном | |
| Лакмус Метилоранж Фенолфталеин | Фиолетовый Оранжевый Бесцветный! | Красный Красный Бесцветный! | Синий Желтый Красный |
Какую окраску приобретает индикатор тимолфталеин:
HInd  H+ + Ind-
H+ + Ind-
(бесцветный) (синий)
а) в кислом растворе?
____________________________________________________________________________________________________________________________________________
б) в щелочном растворе?
____________________________________________________________________________________________________________________________________________
ОПЫТ 2. Гидролиз солей
Таблица наблюдений:
| Соль | Окраска индикатора | Реакция среды | 7  рН рН  7? 7?
| Какими основанием и кислотой образована соль (слабым? сильным?) |
| 1. Nа2СO3 | Н2СО3-... ……..кислота NаОН-.... … основание | |||
| 2. Аl2(SO4)3 | Н2SO4-.................кислота Al(OH)3-...... …….основание | |||
| 3. ВаСl2 | НСl-....... …. кислота Ва(ОH)2-...... … основание |
1. Ионно-молекулярное уравнение:
__________________________________________________________________________________________________________________________________________
Молекулярное уравнение:
________________________________________________________________________________________________________________________________________
2. Ионно-молекулярное уравнение:
________________________________________________________________________________________________________________________________________
Молекулярное уравнение:
________________________________________________________________________________________________________________________________________
Элементы теории, примеры зачетных задач
Гидроксиды, вступающие в реакцию нейтрализации:
а) только с кислотами, называются основными, например, NаОН, Ва(OН)2, Ni(OН)2;
б) только со щелочами - кислотными, например, SO2(0Н)2 (или в общепринятой форме записи - Н2SО4), NO2ОН (или НNО3);
в) и с кислотами, и со щелочами - амфотерными, например, Сr(ОН)3, Zn(ОН)2.
Пример 6. Напишите молекулярные и ионно-молекулярные уравнения: а) получения гидроксида хрома Сr(ОН)3; б) растворения его в кислотах; в) взаимодействия его с растворами и расплавами щелочей.
|
|
|
Решение
а) Молекулярные уравнения: Сr2(SO4)3+6КOН=2Сr(OН)3↓+3К2SO4, Сr(NО3)3+3КОН=Сr(ОН)3↓+3КNО3 или СrСl3+3КОН=Сr(ОН)3↓+3КСl
Ионно-молекулярное уравнение: Сr3++3OH-= Сr(ОН)3↓
б) Сr(OН)з+3НСl=СrСl3+3Н2O или 2Сr(OН)3+3Н2SO4=Сr2(SO4)3 +6Н2O
Сr(OН)3+3Н+=Сr3++ЗН2O.
в) С растворами: Сr(ОН)3+ЗNаОН=Nа3[Сr(ОН)6],
Сr(ОН)3+3OH=[Сr(ОН)6]3-
С расплавами: Сr(OН)3+NаOН=NаСrO2+2Н2O,
Сr(OН)3+OН=СrO2-+2Н2O
---------------------------------------------------------------------------------------------------------
Окислительно-восстановительные реакции (ОВР) - это реакции, сопровождающиеся передачей или смещением электронов от одних атомов к другим, в результате чего изменяются их степени окисления.
Степень окисления (СО) - это условный заряд атома в молекуле, вычисленный из предположения, что молекула состоит только из ионов. Атом более электроотрицательного элемента в соединении имеет отрицательную СО, а менее электроотрицательного - положительную. Для простых веществ СО равна нулю (O2, Н2, Zn и др.). В соединениях постоянные степени окисления проявляют: F-1, O-2
+2 -1 -1 +1 -1 +2 -1
(кроме OF2; H2O2; Na2O2 и т.п.), H+1 (кроме гидридов K H; Ca H2 и т.п.), металлы IA – подгруппы – Me+1, металлы IIA- подгруппы – Me+2.
3. Ионно-молекулярное уравнение:
______________________________________________________________________
Молекулярное уравнение:
______________________________________________________________________
Опыт 3. Определение характера гидроксидов и металлов
Получение гидроксидов (молекулярные и ионно-молекулярные уравнения):
MgSO4 + ….NaOH = ……..…………………………………………………………….
…………………………………………………………………………………………..
Al2(SO4)3 + ….NaOH =……………………………………………………………….
…………………………………………………………………………………………..
Pb(NO3)2 + …..NaOH = ………………………………………………………………..
……………………………………………………………………………………………
Результаты опытов:
| Гидроксиды | Растворимость: | Характер гидроксида | |
| в кислотах | в щелочах | ||
| Мg(ОН)2 | |||
| Аl(ОН)3 | |||
| Рb(ОН)2 |
Растворение в кислотах (молекулярные ионно-молекулярные уравнения):
Мg(ОН)2↓+…HNO3 = ……………………………………………………………………
…………………………………………………………………………………………….
Аl(ОН)3↓+…HNO3 = ……………………………………………………………………
…………………………………………………………………………………………….
Рb(ОН)2↓+…HNO3 = ……………………………………………………………………
…………………………………………………………………………………………….
Растворение амфотерных гидроксидов в щелочах (молекулярные и ионно-молекулярные уравнения)
Мg(ОН)2↓+….NaOH = ……..…………………………………………………………….
…………………………………………………………………………………………..
Аl(ОН)3↓+….NaOH = ……..…………………………………………………………….
…………………………………………………………………………………………..
Рb(ОН)2↓+….NaOH = ……..…………………………………………………………….
…………………………………………………………………………………………..
Дата: Подпись преподавателя
Элементы теории, примеры зачетных задач
Неизвестные СО рассчитываются из условия, что сумма СО всех атомов в молекуле равна нулю, а в сложном ионе - заряду этого иона.
Пример 7. Рассчитать СО: а) хрома в дихромате калия; б) фосфора в гидрофосфат-ионе.
Решение
+1 Х1 -2 +1 Х2 -2
Обозначим СО атомов: а) К2Сr2О7; б) НРО4 2- Составим и решим уравнения баланса заряда: а) 2•1+2•Х1+7•(-2)=0; Х1=+6; б) 1+Х2+4•(-2)=-2; Х2=+5.
Окисление - это процесс повышения степени окисления. Окисляющиеся атомы, молекулы или ионы называются восстановителями. Они в процессе окисления отдают электроны.
Восстановление - это процесс понижения степени окисления. Восстанавливающиеся атомы, молекулы или ионы называются окислителями. Они в процессе окисления принимают электроны.
Атом элемента в высшей степени окисления может лишь принимать электроны, т.е. проявляет только окислительные свойства. Атом элемента в низшей степени окисления может их лишь отдавать и проявляет только восстановительные свойства. Атом элемента в промежуточной степень окисления может проявлять как восстановительные свойства (с сильными окислителями), так и окислительные свойства (с сильными восстановителями).
Пример 8. Напишите электронную формулу азота. Приведите примеры соединений в высшей, низшей и промежуточной СО.
Решение
7N 1s2 2s2 2р3
Азот может отдать не более 5 валентных электронов (подчеркнуты) и принять до устойчивой конфигурации 2s22р6 три электрона. Высшая СО = +5 (НNО3, N2О5 - только окислители). Низшая СО = -3 (NН3, NН4Сl - только восстановители). Промежуточная СО, например, +3 (КNO2 - и окислитель, и восстановитель).
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 3
|
|
|


