 |
Удельная электрическая проводимость
|
|
|
|
ХТ – 252
ХТ – 253
Федеральное агентство по образованию РФ
Тверской Государственный Технический Университет
Кафедра «Биотехнологии и Химии»
Методическое указание к практикуму по физической химии
Лабораторная работа № 29
«Определение константы диссоциации слабой кислоты»
Тверь 2013
Определение константы диссоциации слабой кислоты
Цель работы: определение электропроводности растворов уксусной кислоты различной концентрации и определение её константы электролитической диссоциации.
Теоретическая часть
Электропроводность
Величина, характеризующая способность веществ проводить электрический ток под действием внешнего электрического поля, называется электрической проводимостью или электропроводностью.
Электрическая проводимость (L) – величина, обратная электрическому сопротивлению проводника (R). Измеряется в сименсах (См): См = Ом–1.
Так как
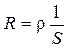 , ,
| (4) |
то
 , ,
| (5) |
где ρ – удельное сопротивление, א – удельная электрическая проводимость, S – площадь сечения проводника, l – длина проводника.
Электрическая проводимость в растворах электролита зависит от числа ионов в объеме раствора между электродами и скорости их движения.
Для оценки проводимости растворов и влияния на нее различных факторов применяют три величины: удельную (א), эквивалентную (Λ) и молярную (λ) электрическую проводимость.
Удельная электрическая проводимость
Удельной электрической проводимостью (א) называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см2, расположенными на расстоянии 1 см.
|
|
|
Удельная электрическая проводимость измеряется в См ∙ см–1 или
См ∙ м–1. Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Графическая зависимость удельной электрической проводимости водных растворов слабых и сильных электролитов от концентрации (рис. 1) проходит через точку максимума.

Рис. 1.Зависимость удельной электрической
проводимости от концентрации
В разбавленных растворах сильных электролитов (α = 1) удельная электрическая проводимость растет пропорционально числу ионов в 1 см3, увеличивающемуся с концентрацией; в концентрированных растворах
ионная атмосфера значительно уменьшает скорость движения ионов
и א падает.
В растворах слабых электролитов с увеличением концентрации раствора уменьшается степень диссоциации α и электропроводность падает из-за уменьшения числа ионов в 1 см3 раствора. Удельная электрическая проводимость растворов электролитов зависит от температуры; повышение температуры увеличивает электропроводность растворов электролитов, так как скорость ионов растет:
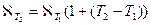 . .
| (6) |
Отношение расстояния между электродами ких площади называют постоянной электролитической (кондуктометрической) ячейки
 ; ;
 . .
| (7) |
| (8) |
Величину К определяют экспериментально с использованием стандартного раствора хлорида калия, для которого значение א известно Например, при 25 °С удельная электропроводность 0,01 М водного раствора КСl равна 0,1413 См/м.
Число носителей заряда в единице объема определяет величину א, поэтому удельная электрическая проводимость смеси соединений равна сумме проводимостей отдельных компонентов и растворителя:
 . .
| (9) |
Удельная электропроводность чистой воды, рассчитанная теоретически, равна 5,5 ∙ 10–6 Ом/м при 298 К. что соответствует удельному сопротивлению 0,18 Мом ∙ м или сопротивлению 18 МОм для ячейки кондуктометра с ребром
1 см. Для измерения электропроводности используют, как правило, воду, находящуюся в равновесии с СO2 воздуха, א = (1 – 4) ∙ 10–4 См/м.
|
|
|
Для сравнения приведем значения удельной электропроводности при
25 °С некоторых органических растворителей: диэтиламин (3 ∙ 10–10), ацетон
(5 ∙ 10–8), метанол (1,5 ∙ 10–7) ацетонитрил (1 ∙ 10–6 См/м).
Температурная зависимость א разбавленных растворов выражается формулой Кольрауша:
 , ,
| (10) |
где אt и א25 – удельные электропроводности соответственно при температу-
рах t и 25 °С; α и β – коэффициенты, зависящие от природы растворенного вещества и растворителя: для солей α = 2,2 ∙ 10–2; для сильных кислот
α = 1,64 ∙ 10–2; для сильных оснований α = 1,9 ∙ 10–2.
Поскольку при увеличении температуры на 1 °С удельная электро-проводность большинства водных растворов электролитов в результате уменьшения вязкости увеличивается на 2–2,5 %, для измерения сопротивления растворов с точностью до 0,01 % необходимо обеспечить термостатирование раствора с точностью ±0,005°.
Повышение давления в растворах слабых электролитов приводит в соответствии с принципом Ле Шателье – Брауна к уменьшению объема, что вызывает снижение степени диссоциации и соответственно א. Например, для уксусной кислоты увеличение давления до 2 ∙ 103 атм уменьшает удельную электропроводность на 40 %. В случае сильных электролитов увеличение давления сопровождается ростом вязкости, что приводит к уменьшению удельной электропроводности.
|
|
|


