 |
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
|
|
|
|
Цикл Карно
В 1824 году французский физик и военный инженер Никола Леонард Сади Карно (1796 - 1832) опубликовал свою работу "Размышления о движущей силе огня и о машинах, способных развивать эту силу", в которой им были сформулированы основные положения теории тепловых машин и впервые предложено второе начало термодинамики. Но только в 1834 году, после придания Клапейроном этой теории доступной математической формы, идеи Карно получили широкое распространение для обоснования второго начала термодинамики.
При работе тепловой машины рабочее тело совершает замкнутый термодинамический цикл. Для любой реальной тепловой машины весь цикл, включая его отдельные процессы, необратим, что вызывает необходимость затрачивать часть произведенной работы для перевода рабочего тела в первоначальное состояние, обеспечивая замыкание кругового процесса. Указанные потери приводят к тому, что не вся произведенная работа становится полезной, а часть её теряется в самой тепловой машине, переходя в теплоту.
Максимальным к.п.д. обладает тепловая машина, в которой цикл рабочего тела состоит только из равновесных тепловых процессов, и, следовательно, является обратимым. Однако для осуществления нагревания и охлаждения необходим теплообмен рабочего тела с нагревателем и холодильником тепловой машины, который тем более эффективен, чем заметнее разность температур. Возникающие при этом тепловые потоки нарушают состояние теплового равновесия и делают эти процессы необратимыми. Чтобы избежать этого, необходимо теплообмен осуществлять при очень малой разности температур, в пределе, для достижения равновесного процесса, при бесконечно малой разности. Поэтому реализовать равновесный процесс при теплообмене можно только в случае теплового равновесия рабочего тела и нагревателя (или холодильника).
|
|
|
Таким образом, теплообмен с нагревателем и холодильником в рассматриваемой тепловой машине должен происходить при изотермических процессах, что эквивалентно требованию бесконечной медленности протекания этих процессов. Очевидно, что такое условие может быть выполнено только приближенно.
Другой процесс, который может протекать без возникновения тепловых потоков - это адиабатический процесс. Если он протекает бесконечно медленно, то такой процесс является равновесным и обратимым.
Указанные два равновесных процесса (изотермический и адиабатический) могут быть использованы для составления обратимого цикла. Такой обратимый круговой процесс в принципе может состоять из большого, в пределе даже бесконечного, числа следующих друг за другом изотермических и адиабатических процессов. Однако, для организации простейшего кругового процесса достаточно использования двух изотерм и двух адиабат. Такой равновесный термодинамический цикл получил название цикла Карно. Возможность осуществления такого циклического процесса связана с тем, что с помощью адиабатического процесса всегда возможен переход между любыми изотермами, а с помощью изотермического - между любыми адиабатами.
Составленный таким образом цикл имеет для термодинамики такое же существенное значение, как и материальная точка в механике. Любой квазиравновесный процесс может быть аппроксимирован большим числом таких элементарных циклов. Подобно тому, как в механике вопрос о возможности считать тело материальной точкой решается в зависимости от условий конкретной задачи, так и в термодинамике вопрос о том, является ли циклический процесс квазиравновесным или нет, зависит от условий той задачи, которую необходимо решить.
|
|
|
Очевидно, что между телами, находящимися при одинаковых температурах и, следовательно, в состоянии теплового равновесия, не может происходить теплообмен. Из этого следует, что если считать процессы строго изотермическими, то при их протекании рабочее тело не должно нагреваться от нагревателя и охлаждаться холодильником. То есть в циклическом процессе, состоящем из двух изотерм и двух адиабат, не может происходить передача теплоты между нагревателем (или холодильником) и рабочим телом. Однако, на примере такого простейшего идеального цикла (аналогично тому, как это делается в механике на примере материальной точки) можно изучить основные законы термодинамики, произвести их анализ.
Обратимый цикл Карно состоит из двух изотерм, описывающих процесс теплопередачи от нагревателя к рабочему телу и от рабочего тела к холодильнику, и двух адиабат, описывающих расширение и сжатие рабочего тела в тепловой машине (см. рис. 3.7). Температура нагревателя считается равной  , а температура холодильника - соответственно
, а температура холодильника - соответственно  . При этом температуры нагревателя
. При этом температуры нагревателя  и холодильника
и холодильника  постоянны, что должно обеспечиваться бесконечно большой теплоемкостью используемых тепловых резервуаров.
постоянны, что должно обеспечиваться бесконечно большой теплоемкостью используемых тепловых резервуаров.

Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояниятермодинамической системы.
Понятие энтропии было впервые введено в1865 году Рудольфом Клаузиусом. Он определил изменение энтропиитермодинамической системы при обратимом процессе как отношение общего количества тепла Δ Q к величинеабсолютной температуры T (то есть тепло, переданное системе, при постоянной температуре):
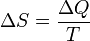 .
.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся изменением тепла, вследствие изменения структуры.
Рудольф Клаузиус дал величине S имя «энтропия», происходящее от греческого слова τρoπή, «изменение» (изменение, превращение, преобразование). Данное равенство относится к изменению энтропии, не определяя полностью саму энтропию.
|
|
|
Эта формула применима только для изотермического процесса (происходящего при постоянной температуре). Её обобщение на случай произвольногоквазистатического процесса выглядит так:
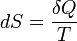 ,
,
где dS — приращение (дифференциал) энтропии некоторой системы, а δ Q — бесконечно малое количество теплоты, полученное этой системой.
Необходимо обратить внимание на то, что рассматриваемое термодинамическое определение применимо только к квазистатическим процессам (состоящим из непрерывно следующих друг за другом состояний равновесия).
Поскольку энтропия является функцией состояния, в левой части равенства стоит её полный дифференциал. Напротив, количество теплоты являетсяфункцией процесса, в котором эта теплота была передана, поэтому δ Q считать полным дифференциалом нельзя.
Энтропия, таким образом, согласно вышеописанному, определена вплоть до произвольной аддитивной постоянной. Третье начало термодинамикипозволяет определить её точнее: предел величины энтропии равновесной системы при стремлении температуры к абсолютному нулю полагают равным нулю.
Статистическое определение энтропии.
В 1877 годуЛюдвиг Больцман установил связь энтропии с вероятностью данного состояния. Позднее эту связь представил в виде формулы Макс Планк:
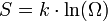
где константа k = 1,38×10−23 Дж/К названа Планкомпостоянной Больцмана, аΩ — статистический вес состояния, является числом возможных микросостояний (способов) с помощью которых можно перейти в данное макроскопическое состояние. Этот постулат, названный Альбертом Эйнштейном принципом Больцмана, положил начало статистической механики, которая описывает термодинамические системы, используя статистическое поведение составляющих их компонентов. Принцип Больцмана связывает микроскопические свойства системы (Ω) с одним из её термодинамических свойств (S).
Рассмотрим, например, идеальный газ в сосуде. Микросостояние определено как позиции и импульсы (моменты движения) каждого составляющего систему атома. Связность предъявляет к нам требования рассматривать только те микросостояния, для которых: (I) месторасположения всех частей расположены в рамках сосуда, (II) для получения общей энергии газа кинетические энергии атомов суммируются.
|
|
|
Согласно определению, энтропия является функцией состояния, то есть не зависит от способа достижения этого состояния, а определяется параметрами этого состояния. Так как Ω может быть только натуральным числом (1, 2, 3, …), то энтропия Больцмана должна быть неотрицательной — исходя из свойств логарифма.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Первое начало термодинамики было сформулировано в середине XIX века в результате работ немецкого учёного Ю. Р. Майера, английского физика Дж. П. Джоуля и немецкого физика Г. Гельмгольца [1] . Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным.[2] Это — формулировка Дж. П. Джоуля (1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики[2] (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.
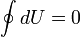
Изменение полной энергии системы в квазистатическом процессеравно количеству теплоты Q, сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества N прихимическом потенциале μ, и работы A '[3], совершённой над системой внешними силами и полями, за вычетом работы A, совершённой самой системой против внешних сил
Δ U = Q − A + μΔ N + A '.
Для элементарного количества теплоты δ Q, элементарной работы δ A и малого приращения dU внутренней энергии первый закон термодинамики имеет вид:
|
|
|
dU = δ Q − δ A + μ dN + δ A '.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что dU и dN являются полными дифференциалами, а δ A иδ Q — нет.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Существуют несколько эквивалентных формулировок второго начала термодинамики:
§ Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» [1] (такой процесс называется процессом Клаузиуса).
§ Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло Q 1у нагревателя, отдав Q 2 холодильнику и совершив при этом работу A = Q 1 − Q 2. После этого воспользуемся процессом Клаузиуса и вернем тепло Q 2 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятииэнтропии:
§ «Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как офункции состояния системы, что также должно быть постулировано.
Второе начало термодинамики в аксиоматической формулировке Рудольфа Юлиуса Клаузиуса (R. J. Clausius, 1865) имеет следующий вид[2]:
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния S = S (T, x, N), называемая энтропией, такая, что ее полный дифференциал dS = δ Q / T.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны.
С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы. Существование флуктуаций препятствует точному его выполнению, однако вероятность сколь-нибудь значительного нарушения крайне мала. Смотри также Демон Максвелла.
|
|
|


