 |
Необратимое ингибирование. Аллостерические ферменты. Ингибирование конечным продуктом (ингибирование по принципу отрицательной обратной связи — ретроингибирование)
|
|
|
|
Необратимое ингибирование
Некоторые Ф. полностью ингибируются очень малыми концентрациями ионов тяжелых металлов (ионов Hg+2, Ag+, As+) или иодуксусной кислотой. Эти вещества необратимо соединяются с сулфгидрильными группами (-SH) и вызывают осаждение ферментного белка.
Аллостерические ферменты
Эти вещества влияют на активность фермента, вызывая обратимое изменение в структуре его активного центра. Называют такие вещества аллостерическими эффекторами. В зависимости от характера влияния, которое они оказывают, увеличивая или уменьшая сродство Ф. к субстрату, эффекторы подразделяются на аллостерические активаторы (ускоряющие реакцию) и аллостерические ингибиторы (тормозящие реакцию).
Пример. Фосфофруктокиназа катализирует фосфорилирование фруктозо-6-фосфата с образованием фруктозо-1, 6-бифосфата. Эта реакция протекает во время гликолиза, составляющего одну из стадий дыхания. АТФ, если его концентрация высока, аллостерически ингибирует фосфофруктокиназу. Когда же клеточный метаболизм усиливается, а значит расходуется АТФ и его общая концентрация падает, данный метаболический путь снова всупает в действие.
Ингибирование конечным продуктом (ингибирование по принципу отрицательной обратной связи — ретроингибирование)
Когда конечный продукт какого-либо метаболического пути начинает накапливаться, он может действовать как аллостерический ингибитоор на Ф., контролирующий первый этап этого пути. При этом снижается сродство данного Ф. к его субстрату и соответственно уменьшается или вовсе приостанавливается дальнейшее образование самого конечного продукта.
Регуляция активности фермента
|
|
|
активация зимогена (профермента) ингибирование по типу обратной связи за счет кооперативных эффектов аллостерических эффектов ковалентная модификация
Зимоген
Неактивный предшественник фермента. Чтобы зимоген превратился в активный фермент, какая-то часть (или части) его полипептидной цепи должна быть отщеплена.
Пример. В семействе сериновых протеаз химотрипсиноген и трипсиноген являются зимогенами соответственно химотрипсина и трипсина.
Ковалентная модификация
Это ковалентное присоединение или отщепление от фермента небольшой химической группы, регулирующее его активность. С помощью таких модификаций обычно либо полностью неактивная форма фермента становится активной, либо, наоборот, полностью активный фермент инактивируется.
Пример. Гликоген-синтетаза из клеток млекопитающих, превращающая глюкозу в гликоген, инактивируется после ковалентного присоединения фосфатной группы к боковой цепи одного из сериновых остатков и снова активируется при отщеплении фосфата.
Ингибирование по типу отрицательной обратной связи
Характерно для ферментативных систем, в которых субстрат претерпевает несколько последовательных превращений, причем каждая реакция катализируется своим ферментом (см. ферменты E1-E2). Ингибирование имеет место, если конечный продукт T блокирует одну из более ранних стадий в цепи реакций, а для этого продукт T должен быть либо структурно похожим на P (т. е. действовать как конкурентный ингибитор), либо связываться с какой-либо другой частью фермента, регулируя таким образом его активность (т. е. выступать в роли неконкурентного ингибитора).

Кооперативные эффекты
Характерны для мультисубъединичных ферментов. Если имеет место кооперативный эффект, то кинетические свойства фермента уже не описываются уравнением Михаэлиса-Ментен: график зависимости V от [S] в этом случае представляет собой S-образную кривую, а не гиперболу, а график Лайнуивера-Бэрка перестает быть прямой. При этом небольшое увеличение концентрации субстрата будет приводить к значительному возрастанию скорости реакции. Для объяснения этого эффекта были предложены различные модели, из которых наиболее известны модели Моно, Уаймена и Шанжё (симметричная модель), а также Кошланда, Немети и Филмера (последовательная модель).
|
|
|
Симметричная модель
В этой модели предполагается, что каждый мультимерный ферментный комплекс может существовать по крайней мере в двух разных состояниях с неодинаковой четвертичной структурой, причем в каждом состоянии все субъединицы имеют одинаковую третичную.
В простейшей модели рассматриваются два состояния, находящиеся в равновесии друг с другом. В одном из них белок имеет высокое сродство с субстратом (R-состояние, от англ. relax — ослаблять), а в другом — низкое (T-состояние, от англ. tense — напрягать). Добавленный субстрат будет предпочтительно связываться с R-конформерами фермента, а связывание его с T-конформером приведет к возникновению напряжения в субъединицах фермента, что вызовет одновременный переход всех субъединиц в R-состояние (в котором напряжение отсутствует).
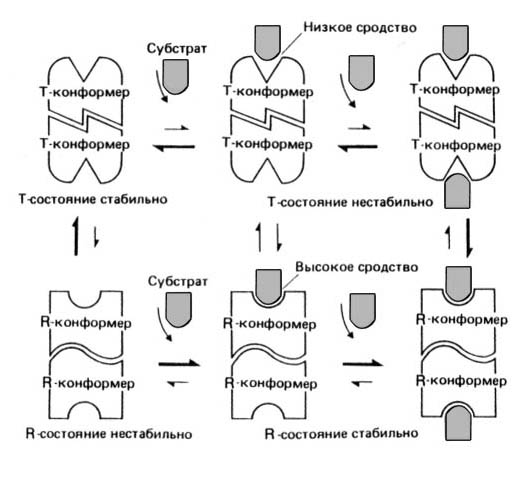
Рис. 17
При таком согласованном переходе сохраняется молекулярная симметрия каждой мультимерной молекулы. При дальнейшем добавлении субстрата все больше и больше молекул будет переходить из Т- в R-состояние. Такой сдвиг равновесия в присутствии субстрата представляет собой эффект положительной кооперативности. В результате этого эффекта график зависимости V от [S] будет иметь S-образную форму.
|
|
|


