 |
По заданной массе растворенного вещества или растворителя
|
|
|
|
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
Новгородский государственный университет им. Ярослава Мудрого
Факультет естественных наук и природных ресурсов
Кафедра химии и экологии
Концентрации растворов
Методические указания к самостоятельной работе студентов
Великий Новгород
2006 г
Концентрации роастворов: Методические указания к самостоятельной работе студентов / Сост. В.П. Кузьмичева, Г.Н.Олисова, Н.И.Ульянова. – Великий Новгород: НовГУ, 2006.
СОДЕРЖАНИЕ
Стр.
1. Расчёт массовой доли растворённого вещества……………………………………………….4
1. 1. Вычисление массы растворённого вещества или растворителя по массе раствора…...5
1. 2. Вычисление массы раствора определённой концентрации по заданной массе растворённого вещества или растворителя……………………………………………………6
1. 3. Разбавление и концентрирование растворов…………………………………………….7
1. 4. Расчёты, связанные со смешиванием растворов………………………………………...9
1. 5. Задания для самостоятельной работы……………………………………………………11
2. Молярная концентрация………………………………………………………………………..14
2. 1. Определение молярной концентрации вещества С(Х) по массе вещества и массы вещества по заданной молярной концентрации………………………………………………15
2. 2. Расчёты, связанные с разбавлением и концентрированием растворов………………..17
2. 3. Расчёты, связанные со смешиванием растворов различной концентрации…………...17
2. 4. Расчёты материального баланса химических процессов: избыток (недостаток)
реагентов………………………………………………………………………………………...19
|
|
|
2. 5. Задания для самостоятельной работы……………………………………………………21
Литература…………………………………………………………………………………………25
1. Расчет массовой доли растворенного вещества
Пример 1. Вычислить массовую долю хлорида натрия в растворе, если 40 г его растворено в 280 мл воды.
Решение:
ω(NaCl) = 
Масса раствора m(р-ра) = m(NaCl) + m(H2O)
m(H2O) = V(H2O)·ρ(H2O) = 280 мл ·1 г/мл = 280 г,
ω(NaCl) =  = 0,125 или 12,5%
= 0,125 или 12,5%
Ответ: ω(NaCl) = 0,125 или 12,5%.
Пример 2. В 258,3 г воды растворили 41,7 г кристаллогидрата FeSO4·7H2O. Определить массовую долю FeSO4 в полученном растворе.
Решение:
ω(FeSO4) = 
Сначала рассчитываем массу раствора:
m(р-ра) = m(FeSO4·7H2O) + m(H2O) = 41,7 + 258,3 = 300 г
Далее определяем массу FeSO4:
m(FeSO4) = n(FeSO4)·m(FeSO4) = n(FeSO4·7H2O)·m(FeSO4) =
=  ·m(FeSO4) =
·m(FeSO4) =  = 22,8 г,
= 22,8 г,
ω(FeSO4) =  = 0,076 или 7,6%
= 0,076 или 7,6%
Ответ: ω(FeSO4) = 0,076 или 7,6%.
Пример 3. Определить массовую долю хлороводородной кислоты, если в 1 л воды растворили 350 л HCl (н.у.).
Решение:
ω(HCl) = 
Массу HCl определяем по формуле:
m(HCl) = n(HCl)·m(HCl) =  ·m(HCl) =
·m(HCl) =  ·36,5 = 570,3 г.
·36,5 = 570,3 г.
Масса раствора m(р-ра) = m(HCl) + m(H2O) = m(HCl) + V(H2O)·ρ(H2O)
ω(HCl) =  = 0,363 или 36,3%
= 0,363 или 36,3%
Ответ: ω(HCl) = 0,363 или 36,3%.
Пример 4. Определите объем хлороводорода, измеренного при н.у., и объем воды, необходимые для приготовления 500 г раствора с массовой долей HCl 20%.
Решение:
Находим массу HCl:
m(HCl) = ω(HCl)·m(р-ра) = 0,2·500 = 100 г.
Рассчитываем объем HCl:
V(HCl) = n(HCl)·VM =  ·22,4 л/моль = 61,37 л.
·22,4 л/моль = 61,37 л.
Вычисляем m(H2O):
m(H2O) = m(р-ра) – m(HCl) = 500 – 100 = 400 г.
V(H2O) =  =
=  = 400 мл
= 400 мл
Ответ: V(HCl) = 61,37 л, V(H2O) = 400 мл.
Вычисление массы растворенного вещества
Или растворителя по массе раствора
Пример 5. Определите массу нитрата натрия и воды, необходимые для приготовления 800 г раствора с ω(NaNO3) = 12%.
Решение:
Масса растворенной соли:
m(NaNO3) = ω(NaNO3)·m(р-ра) = 0,12·800 = 96 г.
m(р-ра) = m(NaNO3) + m(H2O)
Отсюда
m(H2O) = m(р-ра) – m(NaNO3) = 800 – 96 = 704 г.
Ответ: m(NaNO3) = 96 г, m(H2O) = 704 г.
Пример 6. Определите массу кристаллогидрата CuSO4·5H2O и воды, необходимые для приготовления 0,4 кг раствора с ω(CuSO4) = 8%.
|
|
|
Решение (см. пример 2):
ω(CuSO4) =  =
= 
m(H2O) = m(р-ра) – m(CuSO4·5H2O)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·M(CuSO4·5H2O)
n(CuSO4·5H2O)·= n(CuSO4) = 
Находим
m(CuSO4) = ω(CuSO4)·m(р-ра) = 0,08·400 = 32 г.
n(CuSO4) =  = 0,2 моль.
= 0,2 моль.
Отсюда m(CuSO4·5H2O) = 0,2·250 = 50 г
Масса воды m(H2O) = 400 – 50 = 350 г
Ответ: m(CuSO4·5H2O) = 50 г, m(H2O) = 350 г.
Вычисление массы раствора определенной концентрации
по заданной массе растворенного вещества или растворителя
Пример 7. Определить массу раствора с массовой долей K2SO4 10%, который можно приготовить из 200 г воды и сульфата калия.
Решение:
m(р-ра) = 
Из условия задачи m(K2SO4) неизвестна, но известна масса воды, а поскольку вода – один из компонентов раствора, то:
ω(Н2О) = 100% – ω(K2SO4) = 100 – 10 = 90%
m(р-ра) =  =
=  = 222,2 г.
= 222,2 г.
Ответ: можно приготовить 222,2 г раствора.
Пример 8. При растворении в 400 г воды некоторого количества CuSO4·5H2O получен раствор с массовой долей CuSO4 5%. Рассчитать массу использованного кристаллогидрата и массу полученного раствора.
Решение (см. примеры 2, 6):
m(р-ра) =  =
= 
В этом уравнении неизвестны m(р-ра) и m(CuSO4), но
m(р-ра) = m(CuSO4·5H2O) + m(H2O) = m(CuSO4·5H2O) + 400
Таким образом, неизвестны две величины: m(р-ра) и m(CuSO4·5H2O).
m(CuSO4) = n(CuSO4)·m(CuSO4)
m(CuSO4·5H2O) = n(CuSO4·5H2O)·m(CuSO4·5H2O)
m(CuSO4) = 160 г/моль, m(CuSO4·5H2O) = 250 г/моль.
Подставим эти величины в исходную формулу:
400 + n(CuSO4)·250 = 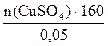
Решаем уравнение относительно n(CuSO4):
20 + 0,05·250· n(CuSO4) = n(CuSO4)·160,
n(CuSO4) =  = 0,136 моль.
= 0,136 моль.
Отсюда
m(CuSO4·5H2O) = 0,136·250 = 34 г,
m(р-ра) = 400 + 34 = 434 г.
Возможны и другие варианты решения этой задачи:
ω(CuSO4) =  =
= 
В этом уравнении тоже два неизвестных – m(CuSO4) и m(CuSO4·5H2O), но величину m(CuSO4) можно представить в виде m(CuSO4·5H2O)· х.
Здесь х – массовая доля CuSO4 в кристаллогидрате, она равна:
х =  =
=  = 0,64
= 0,64
С учетом исходных данных, теперь можно записать:
0,05 = 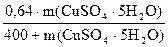
Решаем уравнение относительно m(CuSO4·5H2O):
20 + 0,05 m(CuSO4·5H2O) = 0,66·m(CuSO4·5H2O)
m(CuSO4·5H2O) = 34 г.
Находим m(р-ра) = 400 + 34 = 434 г.
Ответ: для приготовления раствора используют 34 г CuSO4·5H2O, масса полученного раствора 434 г.
|
|
|


