 |
Двухатомный газ с молекулами из
|
|
|
|
Идеальный газ
Распределение Больцмана.
Под идеальным газом будем понимать газ, между частицами которого взаимодействие настолько мало, что им можно пренебречь. Это предположение может быть обеспечено малостью взаимодействия частиц при любых расстояниях между ними, либо при достаточной разрежённости газа. Отсутствие взаимодействия между молекулами позволяет свести задачу об определении уровней энергии E nвсего газа в целом к определению уровней энергии отдельной молекулы (будем их обозначать e k, где индекс k представляет собой совокупность квантовых чисел, определяющих состояние молекулы, энергии E n выразятся, как суммы энергий по молекулам).

 Обозначим через nk число частиц, находящихся в k-том квантовом состоянии (это так называемые числа заполнения различных квантовых состояний) и поставим задачу вычислить средние значения nk этих чисел, причём будем рассматривать случай, когда nk << 1.
Обозначим через nk число частиц, находящихся в k-том квантовом состоянии (это так называемые числа заполнения различных квантовых состояний) и поставим задачу вычислить средние значения nk этих чисел, причём будем рассматривать случай, когда nk << 1.
То есть мы рассматриваем достаточно разрежённый газ. (фактически это выполняется для всех обычных молекулярных или атомных газов).
 Условие nk << 1 означает, что в каждый момент времени в каждом квантовом состоянии реально находится не более одной частицы, в связи с этим можно пренебрегать не только непосредственным силовым взаимодействием частиц, но и их косвенным квантомеханическим взаимным влиянием. А это обстоятельство, в свою очередь, позволяет нам применить к отдельным молекулам формулу распределения Гиббса.
Условие nk << 1 означает, что в каждый момент времени в каждом квантовом состоянии реально находится не более одной частицы, в связи с этим можно пренебрегать не только непосредственным силовым взаимодействием частиц, но и их косвенным квантомеханическим взаимным влиянием. А это обстоятельство, в свою очередь, позволяет нам применить к отдельным молекулам формулу распределения Гиббса.
Итак, применив к молекулам формулу Гиббса, мы утверждаем, что:
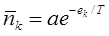 , где a – константа, определяемая из условия нормировки:
, где a – константа, определяемая из условия нормировки: 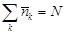
(N – полное число частиц в газе). Это и есть распределение Больцмана (L.Boltzmann, 1877).
|
|
|
Константа a может также быть выражена через термодинамические величины газа.
Применим распределение Гиббса к совокупности всех частиц, находящихся в данном квантовом состоянии. Мы можем это сделать (даже если nk не малы), поскольку непосредственного силового взаимодействия между этими и остальными частицами нет, а квантомеханические эффекты имеют место лишь для частиц, находящихся в одном и том же состоянии. Положим в общей форме распределения Гиббса с переменным числом частиц E = nk e k, N = nk и, приписывая индекс k величине W, получим распределение вероятностей различных значений nk в виде: 
 В частности,
В частности, 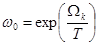 есть вероятность полного отсутствия частицы в данном состоянии. В интересующем нас случае, когда nk << 1, вероятность w0 близка к единице; поэтому в выражении w1 для вероятности наличия одной частицы в k-том состоянии можно положить, опуская члены высшего порядка малости, exp (Wk / T) = 1. Тогда
есть вероятность полного отсутствия частицы в данном состоянии. В интересующем нас случае, когда nk << 1, вероятность w0 близка к единице; поэтому в выражении w1 для вероятности наличия одной частицы в k-том состоянии можно положить, опуская члены высшего порядка малости, exp (Wk / T) = 1. Тогда 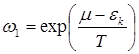
Что же касается вероятностей значений nk > 1, то они в этом приближении должны быть положены равными нулю. Поэтому 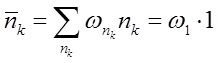
И мы получаем распределение Больцмана в виде: 
Таким образом, коэффициент a в законе распределения Больцмана оказывается выраженным через химический потенциал газа.
Свободная энергия больцмановского идеального газа
Применим общую формулу:
для вычисления свободной энергии газа, описываемого статистикой Больцмана:

Написав энергию En в виде суммы энергий  мы можем свести суммирование по
мы можем свести суммирование по
всем состояниям газа к суммированию по всем состояниям отдельной молекулы. Каждое состояние газа будет определяться набором N (число молекул в газе) значений ek, которые в больцмановском случае можно считать различными между собой (в каждом молекулярном состоянии – не более одной молекулы). Напишем exp (- En/T) в виде произведения множителей exp (-ek/T) для каждой из молекул и суммируя независимо по всем состояниям каждой молекулы, мы получим 

|
|
|
Набор возможных значений ek для всех молекул газа одинаков, а потому одинаковы и суммы
S exp (-ek/T).
Учтём, однако, что все наборы N различных значений ek, отличающиеся лишь распределением одинаковых молекул газа по уровням ek соответствуют одному и тому же квантовому состоянию газа. В статсумме же каждое из состояний должно учитываться один раз. Поэтому мы должны ещё разделить выражение (*) на число возможных перестановок N молекул друг с другом, т.е. на N!.
Таким образом: 
Подставляя в общую формулу, получаем:
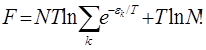
Поскольку N – очень большое число, то для ln(N!) можно воспользоваться приближением ln(N!)» N×ln(N/e). В результате
получим следующее: 
Эта формула позволяет нам вычислить свободную энергию любого газа, состоящего из одинаковых частиц и подчиняющегося статистике Больцмана.
В классической статистике это может быть переписано как:

Двух- и трёхатомный газ. Вращение молекул.
Двухатомные молекулы из одинаковых атомов обладают специфическими особенностями, которые мы рассмотрим на примере пара- и ортоводорода.






 Параводород
Параводород 




Как уже было рассмотрено, общая статсумма выражается как 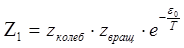
“Вращательная” и “колебательная” суммы здесь определяются как


Множитель (2К+1) во вращательной сумме учитывает вырождение вращательных уровней по направлениям момента К. Свободная энергия, в конечном итоге выражается из трёх частей: 
Первый член связан со степенями свободы поступательного движения молекул, назовём его поступательной частью  .
.
Вращательная и колебательные части: 
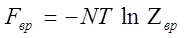
Поступательная часть всегда выражается формулой типа
 , с постоянной теплоёмкостью
, с постоянной теплоёмкостью 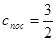 и химической постоянной
и химической постоянной  .
.
Полная теплоёмкость будет выражаться в виде суммы  ,
, 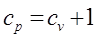 .
.
 Займёмся вращательной свободной энергией. Если температура настолько велика, что
Займёмся вращательной свободной энергией. Если температура настолько велика, что 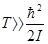 , то вращательная статсумма может быть заменена интегралом
, то вращательная статсумма может быть заменена интегралом 
Здесь e(M) – выражение кинетической энергии вращения как функции момента вращения М.
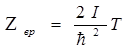
Отсюда свободная энергия 
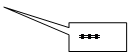 Таким образом, при рассматриваемых не слишком низких температурах вращательная часть теплоёмкости оказывается постоянной и равной
Таким образом, при рассматриваемых не слишком низких температурах вращательная часть теплоёмкости оказывается постоянной и равной 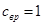 в соответствии с общими результатами классического рассмотрения. Вращательная часть химической постоянной равна
в соответствии с общими результатами классического рассмотрения. Вращательная часть химической постоянной равна 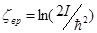 . Существует значительная область температур, в которой выполняется
. Существует значительная область температур, в которой выполняется 
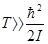 и в то же время колебательная часть свободной энергии, а вместе с нею и колебательная часть теплоёмкости отсутствуют. В этой области теплоёмкость двухатомного газа равна
и в то же время колебательная часть свободной энергии, а вместе с нею и колебательная часть теплоёмкости отсутствуют. В этой области теплоёмкость двухатомного газа равна  , т.е.
, т.е. 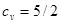 ,
, 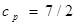 , а химическая постоянная
, а химическая постоянная  .
.
|
|
|
В предельном случае низких температур 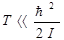 достаточно сохранить два
достаточно сохранить два
первых члена суммы: 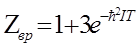
В том же приближении для свободной энергии: 
Энтропия: 
И, наконец, теплоёмкость: 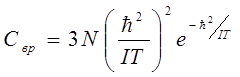
Двухатомный газ с молекулами из
|
|
|


