 |
Особенности меди цинка железа????
|
|
|
|
От Eu до Na реагируют с водой
От Ac до H2 реагируют с кислотами
От Eu до Al выделяется водород
От Ti до H2 конкурирующие реакции: и выделение водорода,и выделение металла в чистом виде
От W до Au выделение металла в чистом виде
С солью если свободный металл левее металла в соли
Билет 10.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс.
Электроли́ты — вещества, расплавы или растворы которых проводят электрический ток вследствие диссоциации на ионы, однако сами вещества не проводят электрический ток. Примерами электролитов могут служить растворы кислот, солей и оснований. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов, и обладающие вследствие этого ионной проводимостью.
Неэлектролиты -это вещества, растворы или расплавы которых не проводят электрический ток. К ним относятся: кислород, водород, многие органические вещества (сахара, эфиры, бензол и др.). В молекулах этих веществ существуют ковалентные не полярные или малополярные связи.
|
|
|
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4 и РО3-4.
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Основания, растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов, а также NН4ОН. Большинство оснований в воде малорастворимо.
Двух- и многокислотные основания диссоциируют ступенчато
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН- (в незначительных количествах):
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода Н+, и щелочные свойства, обусловленные наличием ионов ОН-.
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением
2ОН- + Zn2+ + 2Н2О= Zn(ОН)2 + 2Н2О = [Zn(ОН)4]2-+ 2Н+
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
|
|
|
KHSO4 = K+ + HSO-4
HSO-4= H++SO2-4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg(OH)Cl = Mg(OH)++Cl-
и далее
Mg(OH)+ = Mg2++OH-
Аквакомплексы — в которых лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.
Кристаллогидраты — кристаллы, содержащие молекулы воды и образующиеся, если в кристаллической решётке катионы образуют более прочную связь с молекулами воды, чем связь между катионами и анионами в кристалле безводной соли. При низких температурах вода в кристаллогидратах может быть связана как с катионами, так и с анионами солей. Многие соли, а также кислоты и основания выпадают из водных растворов в виде кристаллогидратов.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы.
Степень диссоциации таких электролитов близка к 1.
К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Слабыми электролитами являются:
1)почти все органические кислоты и вода;
2)некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H3PO4,H2CO3, H2SiO3, H2SO3 и др.;
3)некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.; а также гидроксид аммония NH4OH.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается  и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
|
|
|
В общей реакции

где комплекс разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
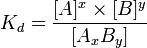
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации  равна отношению числа диссоциированных молекул
равна отношению числа диссоциированных молекул  к сумме
к сумме  , где
, где  — число недиссоциированных молекул. Часто
— число недиссоциированных молекул. Часто  выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
выражают в процентах. Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:

Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства

где α — степень диссоциации.
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
В нейтральной среде [H+] = [OH−] =  моль/л. При концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] < 10−7 моль/л) среда будет кислой; При концентрации [OH−] > 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л) — щелочной.
моль/л. При концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] < 10−7 моль/л) среда будет кислой; При концентрации [OH−] > 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л) — щелочной.
Водоро́дный показа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: 
Билет 11.
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
|
|
|
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Катионы активных металлов:Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ =Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода
Катионы менее активных металлов:Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+=В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород).
Катионы неактивных металлов: Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+=Легко разряжаются и восстанавливается только металл.
Анионы кислородсодержащих кислот и фторид-ион:PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F-=Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода.
Гидроксид-ионы; анионы бескислородных кислот (кроме F−):OH−, Cl−, Br−, I−, S2−=Легко разряжаются.
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими
реакциями на электродах являются следующие:
на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
на катоде — восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении
анода.
Примеры:
Активные металлы
Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): 2H2O + 2e = H2 + 2OH−
Анод(+) Сl− — 1e = Cl0; Сl0+Сl0=Сl2
Вывод: 2NaCl + 2H2O(электролиз) → H2 + Сl2 +2NaOH
Менее активные металлы
Соль менее активного металла и кислородсодержащей кислоты
ZnSO4 ↔ Zn2++SO42−
K(-): Zn2+ + 2e = Zn0
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2ZnSO4 + 2H2O(электролиз) → 2Zn + 2H2SO4 + O2
Объединенный закон Фарадея

 Постоянная Фарадея
Постоянная Фарадея  Кл/моль
Кл/моль
 Масса (выделившегося вещества), размерность в СИ - кг
Масса (выделившегося вещества), размерность в СИ - кг
 Электрический заряд, размерность в СИ - Кл
Электрический заряд, размерность в СИ - Кл
 Валентность
Валентность
 Молярная масса, размерность в СИ –кг/моль
Молярная масса, размерность в СИ –кг/моль
Для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
|
|
|
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах.
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой:
2NaCl + 2H2О ±2е- → H2↑ + Cl2↑ + 2NaOH
Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). Качество хлора, получаемого электрохимическим методами, отличается мало.
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
2NaCl + 2H2О ±2е- → H2↑ + Cl2↑ + 2NaOH
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
Современный метод получения алюминия был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых электродов. Такой метод получения требует больших затрат электроэнергии, и поэтому оказался востребован только в XX веке.
Билет 12.
Со́ли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония NH4; известны соли фосфония PH4 или гидроксония H3O) и анионов кислотного остатка.Ионная решётка.
Соли - это кристаллические вещества разных цветов и разной растворимости в воде.(электролиты)
Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла. Пример:  ,
,  .
.
Кислые соли — атомы водорода в кислоте замещены атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Пример:  .
.
Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Пример:  .
.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами. Пример:  .
.
Смешанные соли — в их составе присутствует два различных аниона. Пример:  .
.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример:  .
.
Комплексные соли — в их состав входит комплексный катион или комплексный анион. Пример:  ,
,  .
.
Названия солей образуются из двух слов: название аниона в именительном падеже и название катиона в родительном падеже. Для металлов с переменной степенью окисления её указывают в скобках и без пробела.
Названия кислых солей начинаются с приставки «гидро-» (если в соли присутствует один атом водорода) или «дигидро-» (если их два). Например  - гидрокарбонат натрия,
- гидрокарбонат натрия,  -дигидрофосфат натрия.
-дигидрофосфат натрия.
Названия основных солей начинаются с приставки «гидроксо-» или «дигидроксо-». Например,  — гидроксохлорид магния,
— гидроксохлорид магния,  — дигидроксохлорид алюминия.
— дигидроксохлорид алюминия.
В гидратных солях на наличие кристаллической воды указывает приставка «гидрат-». Степень гидратации отражают численной приставкой. Например,  — дигидрат хлорида кальция.
— дигидрат хлорида кальция.
На низшую степень окисления кислотообразующего элемента (если их больше двух) указывает приставка «гипо-». Приставка «пер-» указывает на высшую степень окисления (для солей кислот с окончаниями «-овая», «-евая», «-ная»). Например:  — гипохлорит натрия,
— гипохлорит натрия,  — хлорит натрия,
— хлорит натрия,  — хлорат натрия,
— хлорат натрия,  — перхлорат натрия.
— перхлорат натрия.
Химические свойства определяются свойствами катионов и анионов, входящих в их состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода):



Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:

Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:



Некоторые соли разлагаются при нагревании:



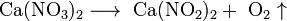
Существуют различные методы получения солей:
Взаимодействие кислот с металлами, основными и амфотерными оксидами / гидроксидами:



Взаимодействие кислотных оксидов c щелочами, основными и амфотерными оксидами / гидроксидами:


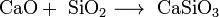


Взаимодействие солей c кислотами, другими солями (если образуется выходящий из сферы реакции продукт):


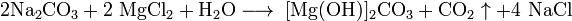
Взаимодействие простых веществ:

Взаимодействие оснований с неметаллами, например с галогенами:

Кислые соли образуются при воздействии избытка кислоты на щелочь. В зависимости от количества молей кислоты (в данном случае — ортофосфорной) могут образовываться дигидроортофосфаты (1) и гидроортофосфаты (2):
Ba(OH)2 + 2H3PO4 → Ba(H2PO4)2 + 2H2O
Ba(OH)2 + H3PO4 → BaHPO4 + 2H2O
NaHSO4 + NaOH = Na2SO4 + H2O Кислые соли переходят в средние под действием соответствующей щелочи.
Получение основных солей
1. Гидролиз солей, образованных слабым основанием и сильной кислотой ZnCl2 + H2O = [Zn(OH)]Cl + HCl
2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl
3. Гидролиз солей слабых оснований с солями слабых кислот: 2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Для заметки: Химическая сущность перевода основной соли в нормальную заключается в нейтрализации гидроксид ионов ОН−, ионами Н+ и образованием Н2О. Основные соли обычно имеют очень сложный состав и часто растворимы в воде.
Билет 13.
Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (то есть проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют валентность II, III, IV. Их 11: Оксид цинка ZnO,Cr2O3,Al2O3, SnO,SnO2, PbO,PbO2,TiO2,MnO2,Fe2O3,BeO.
Характерные реакции
Амфотерные оксиды реагируют с сильными кислотами, образуя соли этих кислот. Такие реакции являются проявлением основных свойств амфотерных оксидов, например:
ZnO + H2SO4 → ZnSO4 + H2O
Они также реагируют с сильными щелочами, проявляя этим свои кислотные свойства, например:
ZnO + 2NaOH → Na2ZnO2 + H2O Амфотерные оксиды могут реагировать с щелочами двояко: в растворе и в расплаве.
При реакции с щёлочью в расплаве образуется обычная средняя соль(как показано на примере выше).
При реакции с щёлочью в растворе образуется комплексная соль.
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (В данном случае образуется тетрагидроксоаллюминат натрия)
Для каждого амфотерного металла есть свое координационное число. Для Be и Zn — это 4; Для Al — это 4 или 6; Для Cr — это 6 или (очень редко) 4;
Амфотерные оксиды обычно не растворяются в воде и не реагируют с ней.
Общие свойства амф.гидроксидов:
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:

В ряде случаев промежуточным продуктом при разложении является метагидроксид, например:


При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:

При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:


При рассмотрении способов разрушения гидроксокомплексов можно выделить несколько случаев.
1) При действии избытка сильной кислоты получаются две средних соли и вода:
Na[Al(OH)4] + 4HCl (изб.) = NaCl + AlCl3 + 4H2O,
K3[Cr(OH)6] + 6HNO3 (изб.) = 3KNO3 + Cr(NO3)3 + 6H2O.
2) При действии сильной кислоты (в недостатке) получаются средняя соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
K3[Cr(OH)6] + 3HNO3 = 3KNO3 + Cr(OH)3 + 3H2O.
3) При действии слабой кислоты получаются кислая соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
K3[Cr(OH)6] + 3H2CO3 = 3KHCO3 + Cr(OH)3 + 3H2O.
4) При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3,
K3[Cr(OH)6]+ 3SO2 = 3KHSO3 + Cr(OH)3.
5) При действии солей, образованных сильными кислотами и катионами Fe3+, Al3+ и Cr3+, происходит взаимное усиление гидролиза, получаются два амфотерных гидроксида и соль активного металла:
3Na[Al(OH)4] + FeCl3 = 3Al(OH)3 + Fe(OH)3 + 3NaCl,
K3[Cr(OH)6] + Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3.
6) При нагревании гидроксокомплексов щелочных металлов выделяется вода:
Na[Al(OH)4] = NaAlO2 + 2H2O,
K3[Cr(OH)6] = KCrO2 + 2H2O + 2KOH.
Со щелочами реагируют соли, катионам которых соответствуют нерастворимые основания.!
В растворах щелочей растворяются только те металлы, которые имеют
отрицательный стандартный электродный потенциал, т.е. находятся левее во-
дорода в ряду активности и при этом образуют амфотерные гидроксиды (Be, Al,
Zn, Sn, Pb). Процесс растворения такого металла в щелочи состоит из двух ста-
дий:
1) лишенный оксидной пленки металл взаимодействует с водой:
Be + 2H2O → Be(OH)2 + H2
2) образующийся амфотерный гидроксид взаимодействует со щелочью:
Be(OH)2 +2NaOH → Na2[Be(OH)4].
Суммарный процесс выглядит следующим образом:
Be + 2H2O + 2NaOH → Na2[Be(OH)4] + H2.
Билет 14.
Основные понятия и законы термохимии
Термохимические уравнения
Термохимические уравнения реакций - это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов.
Важнейшей величиной в термохимии является стандартная теплота образования (стандартная энтальпия образования). Стандартной теплотой (энтальпией) образования сложного вещества называется тепловой эффект (изменение стандартной энтальпии) реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю.
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН) записывать отдельно, через запятую. Например, термохимическое уравнение
4NH3(г) + 3O2(г) → 2N2(г) + 6H2O(ж), ΔН=-1531 кДж
показывает, что данная химическая реакция сопровождается выделением 1531 кДж теплоты, при давлении 101 кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции.
В термохимии также используют уравнения, в которых тепловой эффект относят к одному молю образовавшегося вещества, применяя в случае необходимости дробные коэффициенты.
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической реакции.
Примеры:
Горение топлива в кислороде воздуха.
Горение пороха.
Добавление концентрированной серной кислоты в воду.
Эндотерми́ческие реа́кции — химические реакции, сопровождающиеся поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения ( ,
,  ), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.
), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.
К эндотермическим реакциям относятся:
реакции восстановления металлов из оксидов,
электролиза (поглощается электрическая энергия),
электролитической диссоциации (например, растворение солей в воде),
фотосинтеза.
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях. Стандартная энтальпия образования обозначается ΔHf0. Здесь индекс f означает formation (образование), а перечеркнутый кружок— то, что величина относится к стандартному состоянию вещества. В литературе часто встречается другое обозначение стандартной энтальпии — ΔH298,15 0, где 0 указывает на равенство давления одной атмосфере(или, несколько более точно, на стандартные условия), а 298,15 — температура. Иногда индекс 0 используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество. Стандартным также может быть принято, например, состояние вещества в предельно разбавленном растворе. Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв)0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж)0 = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками.
|
|
|


