 |
Примеры решения задач. Решение. Состояние электрона характеризуется орбитальным квантовым числом l=3, а момент импульса (механический орбитальный момент) электрона равен:
|
|
|
|
Примеры решения задач
Задача 1. Электрон в атоме находится в f-состоянии. Определите: 1) момент импульса электрона; 2) максимальное значение проекции момента импульса на направление внешнего магнитного поля.
| Дано: f-состояние |
| 1) Ll -? 2) (Llz)max -? |
Решение.
Состояние электрона характеризуется орбитальным квантовым числом l=3, а момент импульса (механический орбитальный момент) электрона равен:
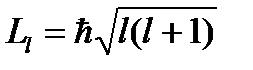 (1)
(1)
где 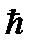 — постоянная Планка.
— постоянная Планка.
Проекция момента импульса на направление внешнего магнитного поля
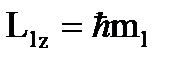 , (2)
, (2)
где ml = 0, ±1, ±2, ±3, ….. ±l - магнитное квантовое число. Выражение (2) максимально при ml = (ml)max:
(Llz)max = 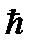 (ml)max (3)
(ml)max (3)
где, по условию задачи, (ml)max = 3.
Подставив числовые значения, получаем:
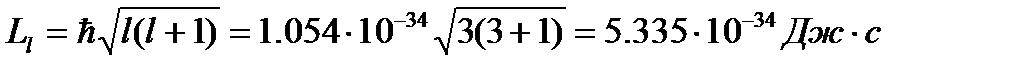
(Llz)max = 1. 054× 10-34× 3 = 3. 162× 10-34 Дж× с
Ответ: Ll = 5. 335× 10-34 Дж× с; (Llz)max = 3. 162× 10-34 Дж× с.
Задача 2. Сколько различных состояний может иметь электрон с главным квантовым числом n = 4?
| Дано: n = 4 |
| N -? |
Решение.
При n=4 орбитальное квантовое число l может принимать значения 0, 1, 2, 3.
При l = 0 магнитное квантовое число ml может принимать только одно значение: ml = 0. Спиновое квантовое число ms может иметь два значения: ms = ½, -½. Cледовательно, в этом случае электрон может находиться в двух состояниях.
При l = 1 магнитное квантовое число ml может принимать значения: ml = 0, 1, -1, а магнитное квантовое число: ms = ½, -½. Поэтому общее число состояний электрона равно 6.
При l = 2 магнитное квантовое число ml может принимать значения: ml = 0, 1, -1, 2, -2, магнитное квантовое число: ms = ½, -½. Поэтому общее число состояний электрона на этом подуровне равно 10.
|
|
|
При l = 3 магнитное квантовое число ml может принимать значения: ml = 0, 1, -1, 2, -2, 3, -3, магнитное квантовое число: ms = ½, -½. Поэтому общее число состояний электрона на этом подуровне равно 14.
Общее число состояний, которые может иметь электрон с главным квантовым числом n = 4 равно: N = 2+6+10+14 = 32
Ответ: N = 32
Задача 3. Электрон в возбужденном атоме водорода находится в 3-d состоянии. Определите изменение орбитального магнитного момента электрона при переходе атома в основное состояние.
| Дано: l1 = 2 l2 = 0 |
| Dpm -? |
Решение.
Изменение орбитального магнитного момента равно:
Dpm = pm2 –pm1,
где pm1 и pm2 – орбитальные магнитные моменты электрона в начальном (возбужденном) и конечном (основном) состояниях.
Модуль магнитного момента, обусловленного орбитальным движением электрона, равен:
 ,
,
где 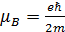 –магнетон Бора, l – орбитальное квантовое число.
–магнетон Бора, l – орбитальное квантовое число.
Учитывая значения l1 и l2 в возбужденном и основном состояниях, получаем:
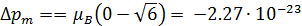 Дж/Тл.
Дж/Тл.
Знак «минус» показывает, что орбитальный магнитный момент уменьшается.
Ответ: Dpm = -2. 27× 10-23 Дж/Тл.
Задача 4. Пользуясь Периодической системой элементов, запишите электронную конфигурацию (распределение электронов по состояниям) атома брома, находящегося в основном состоянии.
Решение.
Согласно Периодической системе элементов, бром имеет порядковый номер 35, следовательно, электронная оболочка атома брома содержит 35 электронов.
Распределение электронов в атоме подчиняется принципу запрета Паули, в соответствии с которым два электрона, находящиеся в одном и том же атоме, не могут иметь одинаковый набор квантовых чисел.
Электронная конфигурация для атома брома запишется следующим образом:
1s22s22p63s23p63d104s24p5.
В данной записи цифры 1, 2, 3, 4 - главные квантовые числа, определяющие символ оболочки (соответственно K, L, M, N). Максимально возможное число электронов в K-оболочке 2, в L-оболочке – 8, в M-оболочке – 18, в N-оболочке – 32.
|
|
|
Обозначения 1s, 2s, 2p, 3s, 3p, 3d,... определяют символ подоболочки, при этом в s-состоянии может находиться 2 электрона, в р-состоянии – 6 электронов, в d-состоянии – 10 электронов.
К-оболочка (n=1, l = 0, ml = 0, ms = ±1/2 )заполнена полностью и записывается, как 1s2 (то есть, на этой оболочке находятся два s - электрона).
Также полностью заполнены L- оболочка (2s22p6 – два 2s- электрона и шесть 2p-электронов) и M-оболочка (3s23p63d10 - два 3s-электрона, шесть 3p-электронов и десять 3d-электронов).
Оставшиеся семь электронов образуют незаполненную N – оболочку (4s24p5 – два 4s-электрона и пять 4р-электронов).
Ответ: 1s22s22p63s23p63d104s24p5.
|
|
|


