 |
Молярную концентрацию (или молярность растворов) принято обозначать буквой М. Например, раствор концентрации 1 м содержит 1 моль вещества на литр раствора. Такой раствор называют молярным.
|
|
|
|
Молярную концентрацию (или МОЛЯРНОСТЬ растворов) принято обозначать буквой М. Например, раствор концентрации 1 М содержит 1 моль вещества на литр раствора. Такой раствор называют МОЛЯРНЫМ.
Электролиты и неэлектролиты. Классификация электролитов. Тория электролитической диссоциации. Диссоциация электролитов. Количественные характеристики электролитической диссоциации: степень диссоциации и константа диссоциации. Закон разбавления Оствальда. Ионное произведение воды. Водородный и гидроксильный показатели. Индикаторы. Вода: особенности строения и свойств. Активированная вода.
Электролитами называются вещества (исключая металлы), растворы или расплавы которых проводят электрический ток. К электролитам относятся соединения, образованные ионными или ковалентными полярными связями. Это сложные вещества: соли, основания, кислоты, оксиды металлов (проводят электрический ток только в расплавах).
Неэлектролитами называются вещества, растворы или расплавы которых электрический ток не проводят. К ним относятся простые и сложные вещества, образованные малополярными или неполярными ковалентными связями.
Свойства растворов и расплавов электролитов впервые объяснил в конце XIXвека шведский учёный Сванте Аррениус. Им была создана специальная теория электролитической диссоциации, основные положения которой, доработанные и развитые другими учёными, в настоящее время формулируются следующим образом.
1. Молекулы (или формульные единицы) электролитов в растворах или расплавах распадаются на положительно и отрицательно заряженные ионы. Этот процесс называется электролитической диссоциацией. Общая сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов, поэтому растворы или расплавы электролитов в целом остаются электронейтральными. Ионы могут быть какпростые, состоящие только из одного атома (Na+, Cu2+, Cl–, S2-), так исложные, состоящие из атомов нескольких элементов (SO42–, PO43–, NH4+, [Al(OH)4]–).
|
|
|
Распад электролитов на ионы в расплавах осуществляется за счёт действия высоких температур, а в растворах за счёт действия молекул растворителя.
Особенностью ионных соединений является то, что в узлах их кристаллической решётки имеются уже готовые ионы и в процессе таких веществ растворения диполям растворителя (воды) остаётся только разрушить эту ионную решётку
Процесс электролитической диссоциации протекает одновременно с процессом растворения веществ, и поэтому в растворах все ионы находятся в гидратированном состоянии (окружены оболочками из молекул Н2О).
2. Ионы электролитов в растворе или расплаве за счёт теплового движения хаотически перемещаются по всем направлениям. Но если в раствор или расплав опустить электроды и пропустить электрический ток, то положительно заряженные ионы электролита начинают двигаться к отрицательно заряженному электроду – катоду (поэтому они иначе называются катионами), а отрицательно заряженные ионы – к положительно заряженному электроду – аноду (поэтому они иначе называются анионами).
Таким образом, электролиты являются проводниками второго рода. Они переносят электрический заряд за счёт направленного движения ионов. Металлы же являются проводниками первого рода, т. к. проводят электрический ток за счёт направленного движения электронов.
3. Процесс электролитической диссоциации обратим. Наряду с распадом молекул на ионы всегда протекает обратный процесс – соединение ионов в молекулы или ассоциация. Поэтому в уравнениях реакций электролитической диссоциации веществ вместо знака равенства «=» ставят знак обратимости
|
|
|
Степенью диссоциации называется отношение количества электролита, распавшегося на ионы (n), к общему количеству электролита (n0)
В зависимости от величины степени диссоциации различают слабые и сильные электролиты. К слабым электролитам относят вещества, у которых степень диссоциации в 0, 1 М растворах меньше 3%; если степень диссоциации в 0, 1 М растворе превышает 30%, то такой электролит называют сильным. Электролиты, степень диссоциации которых лежит в пределах от 3% до 30%, называются электролитами средней силы.
диссоциации.
Степенью диссоциации α называют –отношение числа молекул, распавшихся на ионы (n) к общему числу растворенных молекул (n0). α = (n/n0)∙ 100
Процесс электролитической диссоциации характеризуют константой диссоциации(К). Так, для реакции КА  К+ + А– константа диссоциации:
К = [К+]∙ [ А–]/[КА]
Между константой и степенью электролитической диссоциации существует количественная связь. В приведенном примере общую концентрацию растворенного вещества обозначим с, а степень диссоциации α. Тогда [К+] = [А–] = α ∙ с и соответственно концентрация недиссоциированных частиц [КА] = (1 – α )с.
57. Закон разбавления Освальда.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: {\displaystyle \mathrm {K={\frac {c\lambda ^{2}}{\lambda _{\mathcal {1}}(\lambda _{\mathcal {1}}-\lambda )}}} }
Здесь {\displaystyle \mathrm {K} }— константа диссоциации электролита, {\displaystyle c}— концентрация, {\displaystyle \lambda } и {\displaystyle \lambda _{1}} — значения эквивалентной электропроводности при концентрации {\displaystyle c} и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства{\displaystyle \mathrm {{\frac {\lambda }{\lambda _{\mathcal {1}}}}=\alpha, } }
где {\displaystyle \alpha } — степень диссоциации.
Закон разбавления Оствальда выведен В. Оствальдом в 1888 году и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Очень важно понимать, что закон разбавления Оствальда применим только для растворов слабых электролитов, не содержащих посторонних веществ, усиливающих или подавляющих диссоциацию слабого электролита.
|
|
|
Ионное произведение воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды. 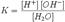
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH− ]) найти соответственно концентрации [OH− ] или [H+].
Водородный показатель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: 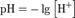 Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может следить критерием силы кислоты или основания.
Водородный показатель имеет важное значение для понимания большинства процессов, протекающих в жидкой фазе. Кроме того, эти ионы являются гомогенными катализаторами многих реакций. Величина рН может следить критерием силы кислоты или основания.
Водородный показатель имеет важное значение для жизнедеятельности организма, и отклонение его от нормы приводит к расстройству его деятельности. Также рН влияет на урожайность почвы и экологию водоемов.
По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10. По аналогии с рН был введен и гидроксильный показатель рОН, определяемый через значение рН. например, если рН = 4, то рОН = 14 — 4= 10.
|
|
|


