 |
Электролиз.. Экспериментальная часть.
|
|
|
|
Электролиз.
Одним из широко применяемых на практике электрохимических процессов является электролиз. Электролизом называется химическое разложение веществ под влиянием электрического тока, сопровождающееся выделением на электродах продуктов разложения и побочными явлениями.
Электролиз осуществляют в специальных сосудах — электролизерах, которые заполняют раствором или расплавом электролита. В электролит помещают два электрода, соединенные с положительным (анод) и отрицательным (катод) полюсами источника постоянного тока.
Электролиз возможен при наложении на электроды внешнего напряжения достаточной величины. Это напряжение вызывает в электролите и во внешней цепи прохождение тока, а на поверхности электродов — электрохимические реакции (катодные и анодные). Электрический ток в электролите представляет собой процесс движения ионов к электродам. Катионы — положительно заряженные ионы металлов и водорода — передвигаются к катоду; анионы —отрицательно заряженные ионы кислотных остатков и ОН- — к аноду. При достижении электродов ионы нейтрализуются и, превращаясь в атомы или молекулы, выделяются на них. Во внешней цепи при этом непрерывно перемещаются электроны от анода к катоду.
Напряжение U, подаваемое на электроды, распределяется между потенциалом анода φ а и потенциалом катода φ к, поэтому
U = φ a – φ k
Наименьшее напряжение, при котором начинает протекать электрический ток через раствор и становится возможным электролиз, называют напряжением разложения.
При электролизе на отрицательно заряженном электроде (катоде) протекают процессы восстановления, например М+Z + ze- → M; O2 + 4H+ + 4e- → 2H2O. На положительно заряженном электроде (аноде) проходят реакции окисления, характер которых зависит от того, способен ли растворяться металлический анод в конкретных условиях электролиза или он находится в инертном состоянии. Для растворимого анода типична реакция М → МZ+ + е-, для инертного — разряд анионов и другие окислительно-восстановительные процессы, например 4ОН-→ O2 + 2H2O + 4e- . К инертным анодам относятся железные и никелевые в щелочной среде и платиновые в большинстве сред.
|
|
|
Если в растворе имеется несколько веществ, способных окисляться или восстанавливаться, то в первую очередь будет окисляться на аноде вещество с наименьшим окислительно-восстановительным потенциалом, а на катоде будет восстанавливаться вещество с наибольшим потенциалом. Определение очередности реакций производят с помощью шкалы стандартных потенциалов.
Широкое применение электролиз получил в технике, особенно в химической и металлургической промышленности. Его используют для выделения многих металлов из соединений, для отделения металлов от примесей (электрорафинирование), для нанесения металлических покрытий с целью защиты металлических изделий от коррозии (гальванотехника), при электролитическом получении щелочей, хлора, окислителей, восстановителей, тяжелой воды, некоторых органических веществ и для других целей.
Экспериментальная часть.
1. Приготовление хлорсеребряного электрода и измерение его потенциала.
Хлорсеребряный электрод широко используется в качестве электрода сравнения. Он состоит из серебряной проволоки, покрытой слоем АgСl, помещенной в раствор КС1 определенной концентрации. На электроде устанавливается равновесие:
AgCl + e- ↔ Ag + Cl-
Потенциал электрода Аg|AgCl|Cl- определяется уравнением:

Для разбавленных растворов при 180 С:
|
|
|
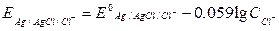
Целью данной работы является приготовление хлорсеребряного электрода и измерение его потенциала в растворах KCl различной концентрации (0, 0001н – 0, 1н).
Берут серебряную проводку и покрывают ее на поверхности слоем хлористого серебра. Для этого серебряную проволоку подвергают анодной поляризации в 0, 1н КС1 от 2-х вольтного аккумулятора в течении 15 минут. В результате анодного растворения серебра на поверхности электрода образуется осадок АgCl одновременно происходит выделение газообразного хлора, который частично остается в адсорбированном состоянии на поверхности электрода. Для удаления следов хлора электрод со свежеобразованным осадком АgCl, одновременно происходит выделение газообразного хлора, который частично остается в адсорбированном состоянии на поверхности электрода. Для удаления следов хлора электрод со свежеобразуемым осадком АgС1 необходимо подвергнуть катодной поляризации в том же самом сосуде, но с новой порцией раствора KС1, соединив его с отрицательным полюсом аккумулятора. Электролиз идет так же в течении 15 минут. После этого хлорсеребряный электрод промывается дистиллированной водой и помещается в электродный сосуд, рис. 3.
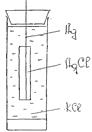 Рис. 3 Хлорсеребряный электрод.
Рис. 3 Хлорсеребряный электрод.
Для измерения электродного потенциала хлорсеребряного электрода составляют гальваническую цепь:
Ag| AgCl + KCl | KCl | HCl+KCl, хингидрон | Pt
насыщ. стандартный раствор.
Хлорсеребряный электрод помещают в стаканчик с насыщенным раствором хлористого калия вместе с хингидронным электродом. Измерение э. д. с. проводится компенсационным методом.
Измеренная э. д. с. Е Х = ЕИЗМ равна
Е изм = Екатода - Еанода
Еизм = Ехин – ЕAg/AgCl/Cl-
Отсюда
ЕAg/AgCl/Cl- = Ехин - Еизм
где Ехин = Е0хин – 0, 058рН (при t = 180C)
Если для хингидронного электрода был взят раствор Вейбеля с рН = 2, 04, то его потенциал при 18°С:
Ехин = 0, 6994 - 0. 058 * 2. 4 =0. 58В
Поэтому потенциал хлорсеребряного электрода будет равен:
ЕAg/AgCl/Cl- = 0. 58 – Еизм
Измерять ЕAg/AgCl/Cl следует в растворах пяти концентраций (от 0. 0001н до 0. 1н), причем следует идти от разбавленных растворов к концентрированным. Результаты измерения записать в таблицу:
| Концентрация НСl, н | Еизм, В | ЕAg/AgCl/Cl  ,
В ,
В
| ||
| 0, 00001 |
|
| ||
| 0, 0001 | ||||
| 0, 001 | ||||
| 0, 01 |
На основании полученных данных строится график зависимости ЕAg/AgCl/Cl от логарифма концентрации хлористого калия и определяется значение коэффициента наклона прямой 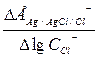 и сравнивается с теоретическим значением
и сравнивается с теоретическим значением 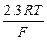 .
.
Необходимые приборы и реактивы: потенциометр для измерения э. д. с., серебряная проволока, Рt - электрод, аккумулятор на 2 В, 0. 1 н раствор КСl, насыщенный раствор КС1.
|
|
|


