 |
Типы химической связи. Основные характеристики ковалентной связи. Металлическая связь. Водородная связь
|
|
|
|
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ
Ионная связь.
Основные положения современной теории ионной связи.
1. Ионная связь образуется при взаимодействии элементов, резко отличающихся друг от друга по свойствам, т. е. между металлами и неметаллами.
2. Образование химической связи объясняется стремлением атомов к достижению устойчивой восьмиэлектронной внешней оболочки (s2p6).
3. Образовавшиеся разноименно заряженные ионы удерживаются друг около друга за счёт электростатического притяжения.
4. Ионная связь не направленная.
5. Чисто ионной связи не существует. Так как энергия ионизации больше энергии сродства к электрону, то полного перехода электронов не происходит даже в случае пары атомов с большой разницей электроотрицательностей. Поэтому можно говорить о доле ионности связи. Наибольшая ионность связи имеет место во фторидах и хлоридах s-элементов. Так, в кристаллахRbCl, KCl, NaClиNaFона равна 99, 98, 90 и 97% соответственно.
Ковалентная связь.
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ.
В основе метода ВС лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Для наглядного изображения валентных схем обычно пользуются следующим способом: электроны, находящиеся во внешнем электронном слое обозначают точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек:
|
|
|
По способу перекрывания электронных облаков, связи бывают двух видов: s - связь и p - связь.
s - связь возникает при перекрывании двух электронных облаков по оси, соединяющей ядра атомов.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ.
1. Длина связи, ℓ. Это минимальное расстояние между ядрами взаимодействующих атомов, которое соответствует наиболее устойчивому состоянию системы.
2. Энергия связи, Emin– это то количество энергии, которое необходимо затратить для разрыва химической связи и для удаления атомов за пределы взаимодействия.
3. Дипольный момент связи, 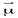 , m=qℓ. Дипольный момент служит количественной мерой полярности молекулы. Для неполярных молекул дипольный момент равен 0, для неполярных не равен 0. Дипольный момент многоатомной молекулы равен векторной сумме диполей отдельных связей:
, m=qℓ. Дипольный момент служит количественной мерой полярности молекулы. Для неполярных молекул дипольный момент равен 0, для неполярных не равен 0. Дипольный момент многоатомной молекулы равен векторной сумме диполей отдельных связей:
Ковалентная связь характеризуется направленностью. Направленность ковалентной связи определяется необходимостью максимального перекрывания в пространстве электронных облаков взаимодействующих атомов, которые приводят к образованию наиболее прочных связей.
Так как эти s-связи строго ориентированы в пространстве, в зависимости от состава молекулы они могут находиться под определенным углом друг к другу – такой угол называется валентным.
Металлическая связь
В атомах металлов внешние валентные электроны удерживаются значительно слабее, чем в атомах неметаллов. Это обуславливает потерю связи электронов с отдельными атомами на достаточно большой промежуток времени и их обобществление. Образуется обобществленный ансамбль из внешних электронов. Существование подобной электронной системы приводит к возникновению сил, которые удерживают положительные ионы металла в сближенном состоянии, несмотря на их одноименную заряженность. Такая связь называется металлической. Подобная связь характерна только для металла и существует в твердом и жидком состоянии вещества.
|
|
|
Водородная связь
Между молекулами, валентно-насыщенными, на расстояниях, превышающих размеры частиц, могут проявляться электростатические силы межмолекулярного притяжения. Их называют силы Ван-дер-Ваальса. Вандерваальсово взаимодействие всегда существует между близко расположенными атомами, но играет важную роль лишь в отсутствие более сильных механизмов связи. Это слабое взаимодействие с характерной энергией 0, 2 эВ/атом имеет место между нейтральными атомами и между молекулами. Название взаимодействия связывается с именем Ван-дер-Ваальса, поскольку именно он впервые предположил, что уравнение состояния с учетом слабого взаимодействия между молекулами газа описывает свойства реальных газов много лучше, чем уравнение состояния идеального газа. Однако природа этой силы притяжения была объяснена лишь в 1930 году Лондоном. В настоящее время к Ван-дер-Ваальсову притяжению относят следующие три типа взаимодействий: ориентационное, индукционное, дисперсион-ное(эффект Лондона). Энергия Ван-дер-Ваальсова притяжения определяется суммой ориентационного, индукционного и дисперсионного взаимодействий.
|
|
|


