 |
62. Смещение равновесия гидролиза солей. Количественные характеристики гидролиза: степень и константа гидролиза. Процессы, сопутствующие гидролизу.
|
|
|
|
гидролиз солей – это процесс обменного разложения воды и растворенной в ней соли – электролита, приводящий к образованию малодиссоциирующего вещества.
Гидролиз является частным случаем сольволиза – обменного разложения растворенного вещества и растворителя.
Степень гидролиза — это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ. Обычно, ее обозначают через hгидр (или α ): hгидр = (nидр/nобщ)·100 %
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
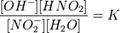
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр); α = (cгидр/cобщ)·100 % где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Факторы, влияющие на степень протекания гидролиза. Необратимый гидролиз.
Степень гидролиза – отношение части соли, подвергающейся гидролизу к общей концентрации её ионов в растворе.
Температура, то есть повышение температуры смещает равновесие в системе вправо. Степень гидролиза возрастает ( так как реакция гидролиза эндотермическая)
Концентрация п родуктов гидролиза в соответствии с принципом Ле Шателье рост концентрации продуктов гидролиза вызывает смещение равновесия влево. Степень гидролиза будет уменьшаться. Для гидролиза по катиону (слаб. Осн., сильн. кис-та) добавление катионов H (подкисление растовра) гидролиз подавляет.
|
|
|
Для гидролиза по аниону (сильн. осн., слаб. кис-та) добавление гидроксид-ионов (подщелачивание растворов) так же вызывает подавление гидролиза).
Концентрация соли. Увеличение подавляет гидролиз, степень уменьшается.
Разбавление. При разбавлении растворов слей равновесие смещается вправо, следовательно степень гидролиза возрастает.
Добавка посторонних веществ. Посторонние вещества влияют на положение равновесия только в том случае, если взаимодействуют с одним из участников реакции.
Гидролиз считается необратимым тогда, когда гидролизу подвергаются соли, образованные слабой кислотой и слабым основанием, ионы этой соли одновременно связывают ионы Н+ и ОН–, смещая равновесие диссоциации воды.
Так как гидролиз большинства солей является обратимым процессом, то степень гидролиза можно изменять, смещая равновесие реакций гидролиза и нейтрализации. Важнейшими факторами, влияющими на степень гидролиза, являются следующие: 1) константа диссоциации кислоты или основания, образующих соль, 2) общая концентрация соли, 3) температура, 4) рН раствора.
Влияние первого фактора видно из формулы Кг= К  /Кдисс (табл. 2).
Константа гидролиза тем больше, чем меньше Кдисс. электролита, то есть чем слабее образующийся электролит, тем сильнее гидролизуется соль.
Из уравнения h =  следует, что разбавление раствора усиливает гидролиз, а повышение концентрации соли подавляет его.
Влияние температуры на степень, гидролиза можно вывести из принципа Ле -Шателье. Реакция нейтрализации экзотермична, следовательно, гидролиз, (обратный ей процесс) эндотермичен, как и диссоциация воды. Поэтому при повышении температуры раствора гидролиз усиливается, охлаждение раствора подавляет гидролиз.
|
|
|
К числу таких реакций относятся взаимодействия солей двухвалентных катионов (кроме Ca2+, Sr2+, Ba2+) с водными растворами карбонатов натрия или калия, сопровождающиеся образованием осадков менее растворимых основных кар-бонатов
2Cu(NO3)2 + 2Na2CO3 + H2O => Cu2(OH)2CO3¯ + 4NaNO3 + CO2↑
А также реакции взаимодействия солей Al3+, Cr3+ и Fe3+ (*При взаимодействии водных растворов солей трёхвалентного железа с сульфидами щелочных металлов протекает окислительно-восстановительная реакция: 2Fe3+ + S2- => 2Fe2+ + S0) с водными растворами карбонатов и сульфидов щелочных металлов:
2AlCl + 3Na2CO3 + 3H2O => 2Al(OH)3¯ + 3CO2↑ + 6NaCl
|
|
|


