 |
Высшие жирные кислоты: стеариновая, пальмитиновая
|
|
|
|
Наибольшее значение имеют кислоты:
пальмитиновая С15Н31СООН
стеариновая С17Н35СООН
Они содержатся в виде сложных эфиров во всех растительных и животных жирах.
Контрольные вопросы:
1. Какие вещества называют карбоновыми кислотами? Приведите примеры. Какую функциональную группу называют карбоксильной?
2. Охарактеризуйте физические свойства карбоновых кислот
3. Укажите основные промышленные способы получения карбоновых кислот
4. Охарактеризуйте химические свойства карбоновых кислот
5. Применение карбоновых кислот
5.Сложные эфиры и жиры. Получение сложных эфиров реакцией этерификации. Сложные эфиры в природе, их значение. Применение сложных эфиров на основе свойств. Жиры как сложные эфиры. Классификация жиров. Химические свойства жиров: гидролиз и гидрирование жидких жиров. Применение жиров на основе свойств. Мыла .
Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации).
Общая формула сложных эфиров одноатомных спиртов и одноосновных карбоновых кислот:
R-COO-R, где R и R1 углеводородные радикалы, исключение – эфиры муравьиной кислоты
H–COO–R1.
Сложные эфиры – жидкости, обладающие приятными фруктовыми запахами. В воде они растворяются очень мало, но хорошо растворимы в спиртах. Сложные эфиры очень распространены в природе. Их наличием обусловлены приятные запахи цветов и фруктов. Они даже могут находиться в коре некоторых деревьев.
Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Воски не растворяются в воде. Их можно формовать в нагретом состоянии. Примерами животных восков могут служить пчелиный воск, а также ворвань (спермацет), содержащийся в черепной коробке кашалота (кашалотовый воск). Пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат): CH3(CH2)14–CO–O–(CH2)29CH3.
|
|
|
Как могут быть получены сложные эфиры?
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.

Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.

Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат - анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
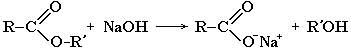
Эта реакция называется омылением сложного эфира.
Изомерия и номенклатура сложных эфиров
| Структурная изомерия | Межклассовая изомерия | |
| Цепи | Положения группы | |
| CH3 – COO – CH2 – CH2 – CH3 Пропилацетат Пропилэтаноат Пропиловый эфир уксусной кислоты CH3 – COO – CH – (CH3)2 Изопропилацетат Изопропилэтаноат Изопропиловый эфир уксусной кислоты | C2H5 – COO – C2H5 Этилпропионат Этилпропаноат Этиловый эфир пропионовой кислоты CH3 – CH2 – CH2 – COO – CH3 Метилбутират Метилбутаноат Метиловый эфир масляной кислоты | CH3 – CH2 – CH2 – CH2 – COOH н-Пентановая кислота и ее изомеры (Сложные эфиры изомерны карбоновым кислотам) |
Применение сложных эфиров очень разнообразно (презентация).
Их применяют в промышленности в качестве растворителей и промежуточных продуктов при синтезе различных органических соединений. Сложные эфиры с приятным запахом используют в парфюмерии и пищевой промышленности. Сложные эфиры часто служат исходными веществами в производстве многих фармацевтических препаратов.
ЖИРЫ
Важнейшими представителями сложных эфиров являются жиры.
|
|
|
В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами, и таким образом впервые синтезировал жир.
Впервые химический состав жиров определил в начале прошлого века французский химик Мишель Эжен Шеврёль, основоположник химии жиров. Действуя водными растворами кислот и щелочей на различные жиры, он получил в результате реакции гидролиза (омыления) открытый еще Шееле глицерин
и неизвестные ранее химические соединения – различные жирные кислоты, многим из которых он и дал названия. А «сладкое масло» Шееле Шеврёль назвал глицерином.
На основании этих экспериментов сделали вывод, что жиры (триглицериды) – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.
Общая формула: , где R1, R2, R3 – УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
Жиры, как это не удивительно, тоже относятся к сложным эфирам. В их образовании участвуют стеариновая кислота С17Н35СООН (или близкие к ней по составу и строению другие жирные кислоты) и трехатомный спирт глицерин С3Н5(ОН)3. Вот как выглядит схема молекулы такого эфира:
Н2С- О –С(О)С17Н35
|
НС- О –С(О)С17Н35
|
Н2С- О –С(О)С17Н35 тристеарин, эфир глицерина и стеариновой кислоты, тристеарат глицерина.
Жиры имеют сложное строение – это подтверждает модель молекулы тристеарата.
Физические свойства
Для изучения физических свойств жиров проведем лабораторный опыт №1.
Рассмотрим растворимость жиров.
Налейте в пробирки различные растворители (воду, этанол, бензол, бензин) и добавьте в каждую пробирку растительное масло, и встряхните. Запишите наблюдения.
Жиры в воде не растворяются, но растворяются в органических растворителях (бензине, бензоле, гексане...). Поэтому их можно извлечь экстракцией из измельченных семян растений или из животных продуктов этими растворителями при нагревании. Рассмотрим классификацию жиров:
Классификация жиров

Наиболее важные ВКК, входящие в состав жиров:
| Насыщенные кислоты | Ненасыщенные кислоты | ||
| Эмпирическая формула ВКК | Название кислоты (кислотного остатка) | Эмпирическая формула ВКК | Название кислоты (кислотного остатка) |
| С15Н31СООН | Пальмитиновая (пальмитат) | С17Н33СООН | Олеиновая (олеат) |
| С17Н35СООН | Стеариновая (стеарат) | С17Н31СООН | Линолевая (линолеат) |
| С17Н29СООН | Линоленовая |
Получение жиров
|
|
|

Химические свойства жиров
I. Реакции присоединения
1. Присоединение галогенов (взаимодействие с бромной водой):

Бромная вода в результате этой реакции обесцвечивается.
2. Гидрирование:
Для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция – гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина – твердого жира из растительных масел.

I. Гидролиз
В зависимости от условий гидролиз бывает:
1. Водный (без катализатора, при высоких температуре и давлении),
2. Кислотный (в присутствии кислоты в качестве катализатора),
3. Ферментативный (происходит в живых организмах):
4. Щелочной (под действием щелочей):
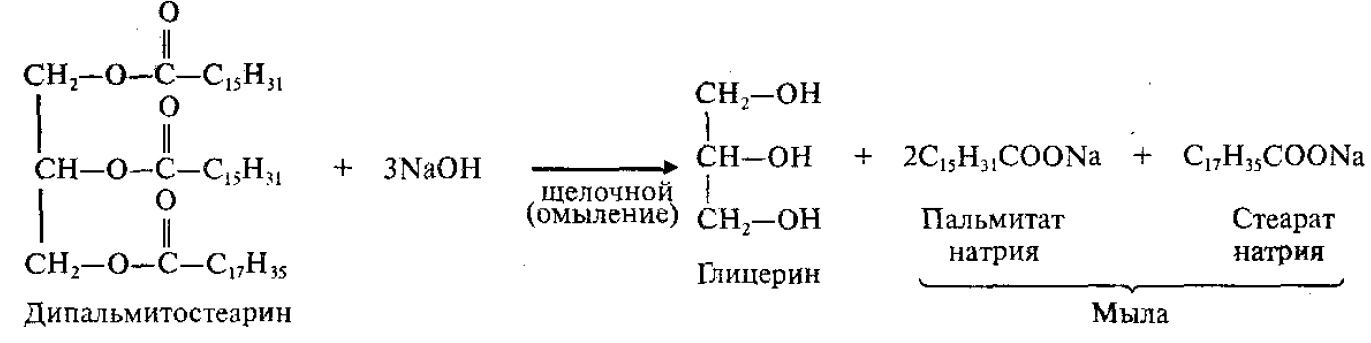
Мыла – натриевые или калиевые соли ВКК.
Натриевые соли являются основным компонентом твердого мыла, калиевые соли – жидкого мыла.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большей молекулярной массой.
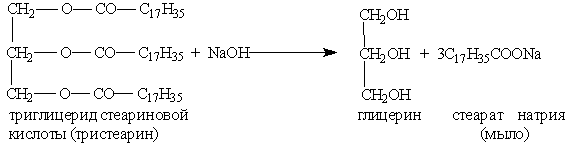
Почему мыло теряет свою моющую способность в жесткой воде? (видеоролик)
Биологическая роль жиров
Жиры нам необходимы, точно так же, как белки и углеводы: они источник энергии и носители незаменимых веществ. И первые среди незаменимых - жирные кислоты с несколькими двойными связями в молекуле. Если организм лишить их, замедлится развитие организма в целом, будет угнетена репродуктивная функция, начнутся проблемы со здоровьем. У детей жиры и вовсе служат главным строительным материалом для развивающегося мозга. Наконец, целый ряд необходимых витаминов растворяется только в жирах и без них не усваивается организмом. Жиры выполняют различные функции:
|
|
|
• строительная (входят в состав клеточных мембран);
• энергетическая (1 г жира при окислении дает 9 ккал энергии);
• защитная (теплорегуляционная, механическая защита органов);
• запасная (запас энергии и воды);
• регулирующая (обмен веществ в организме).
Применение жиров.
Многие жиры при стоянии на воздухе прогоркают – приобретают неприятные запах и вкус, так как при этом образуются кетоны и альдегиды. Такой процесс стимулируется железом, поэтому нельзя оставлять масло в сковороде до следующего дня. Для предотвращения его применяют антиоксиданты.Прокисание жира связано с гидролизом его. Кислый вкус обусловлен появлением карбоновых кислот.
Весьма важными являются реакции полимеризации масел. По этому признаку растительные масла делят на высыхающие, полувысыхающие и невысыхающие. Высыхающие в тонком слое образуют блестящие тонкие пленки. На этом основано использование этих масел для приготовления лаков и красок (льняное). К полувысыхающим относятся, например, подсолнечное, а к невысыхающим относится оливковое, содержащее мало непредельных кислот.
Теперь перейдем к практическим советам. Вам надо удалить пятно от подсолнечного масла. Можно ли их физическим способом удалить, не прибегая к помощи химии? Да, растительное масло хорошо растворяется в бензине или керосине.
Если вы за праздничным столом посадили на одежду жирное пятно и не можете заняться его выведением, рекомендуется немедленно засыпать пятно солью. Соль адсорбирует жиры. Можно также воспользоваться с этой целью зубным порошком.
При старении пятна растительного масла, особенно на свету и при повышенных температурах, образуются прочные полимерные соединения, также за счет двойных связей происходит взаимодействие молекул жира с молекулами ткани. Вывести такое пятно очень трудно, поэтому жирное пятно выводите сразу сами или в химчистке.
6.Углеводы. Углеводы, их классификация: моносахариды (глюкоза, фруктоза), дисахариды (сахароза) и полисахариды (крахмал и целлюлоза). Глюкоза – вещество с двойственной функцией – альдегидоспирт. Химические свойства глюкозы: окисление в глюконовую кислоту, восстановление в сорбит, спиртовое брожение. Применение глюкозы на основе свойств. Значение углеводов в живой природе и жизни человека. Понятие о реакциях поликонденсации и гидролиза на примере взаимопревращений: глюкоза ¾® полисахарид.
|
|
|
|
|
|


