 |
Экспериментальное заражение животных
|
|
|
|
Иммобилизация животных. Перед опытом животное нужно вынуть из клетки. Чтобы животное не укусило и не поцарапало экспериментатора, существуют различные приемы: мышей и крыс берут за конец хвоста, кроликов и морских свинок - за кожу спины.
Затем животное фиксируют, т. е. ограничивают его подвижность, и создают наиболее удобное положение для проведения манипуляции.
Для фиксирования животных существуют разные приспособления: доски различного типа, ящики-боксы, пластинки, станки и т. д.
Вид фиксации зависит от характера манипуляции. Например, при введении материала в вену уха кролика можно использовать деревянный ящик-бокс, передняя стенка которого имеет отверстие для головы и состоит из двух половинок, одна из которых выдвигается. Животное помещают в ящик, голову просовывают в отверстие и фиксируют выдвижной половиной стенки (рис. 28). Чтобы фиксировать животное в лежачем положении, используют доску, которая должна соответствовать размеру тела животного. Сбоку доски на уровне лапок укрепляют четыре кольца или крючка. Животное кладут животом вверх или вниз в зависимости от характера манипуляции, на лапки надевают петли, сделанные из марлевого бинта или веревки, другой конец которой закрепляют на крючке или в кольце.

Рис. 28. Бокс для фиксации головы кролика
Применяют и более простые формы иммобилизации: животное можно плотно запеленать в полотенце или халат либо держать в положении, ограничивающем движения. Например, помощник берет морскую свинку правой рукой за задние лапки, левой - за грудь. Белую мышь можно взять за кончик хвоста, поместить на стол и, когда хвост при движении животного натягивается, левой рукой захватить кожу головы или затылка между ушами. Крыс фиксируют так же, но при этом обычно применяя корнцанги.
|
|
|
Работать с мелкими животными, например с мышами, можно и одному, без помощника: для этого надо захватить указательным и большим пальцами левой руки кожу затылка мыши между ушами и, повернув руку ладонью вверх, зажать левую лапку и хвост между мизинцем и мягкой частью ладони. Свободной рукой производят нужные манипуляции (рис. 29).
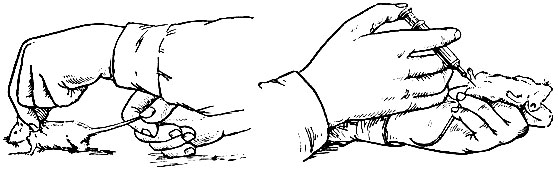
Рис. 29. Фиксация мыши без помощника
Подготовка инструментов для проведения эксперимента. Шприцы, иглы, пинцеты, скальпели, предназначенные для заражения животных, стерилизуют кипячением. Шприцы предварительно разбирают, закладывают в сетку стерилизатора, кипятят 30 мин, затем стерильно собирают при помощи пинцета.
Животное можно заражать нативным материалом: гноем, мокротой, кровью, эмульсией из органов и т. д. и взвесью микробов, густоту которой определяют с помощью оптического стандарта.
Материал, предназначенный для инъекции, помещают в стерильную посуду. Чтобы избежать разбрызгивания исследуемого материала, наполнение шприца производят крайне осторожно. Для этого отверстие иглы опускают ниже поверхности материала и осторожно, медленно набирают в цилиндр шприца количество материала несколько больше, чем требуется. Затем поворачивают шприц вертикально (иглой вверх) и, покрывая кончик иглы стерильной ватой, выталкивают из шприца пузырьки воздуха и избыток материала. Грязную вату сбрасывают пинцетом в дезинфицирующий раствор.
Контрольные вопросы
1. Что означает понятие "биологический метод"?
2. Что необходимо учитывать при выборе лабораторного животного?
3. Каких животных обычно используют для эксперимента?
4. Каким требованиям должно отвечать помещение вивария? Из каких отделений состоит виварий?
5. Как маркируют лабораторных животных?
6. Для чего фиксируют животных? Какие приспособления для этого существуют?
|
|
|
7. Как следует наполнять шприц, чтобы избежать разбрызгивания материала?
Задание
Простерилизуйте шприц. Соберите его. Наполните изотоническим раствором натрия хлорида, накройте кончик иглы ватой и вытолкните из шприца пузырьки воздуха и избыток материала (изотонический раствор натрия хлорида).
Способы заражения
Существуют следующие способы введения материала: подкожный, внутрикожный, накожный, внутримышечный, внутрибрюшинный, внутривенный, пероральный (через рот), интраназальный (через нос в дыхательный тракт); введение в глаз, введение в центральную нервную систему и т. д.
Участок, где должна быть сделана инъекция, разрез или пункция, называют операционным полем. Чаще применяют подкожное введение материала. Для введения животным материала внутрикожно, подкожно или накожно необходимо освободить операционное поле от шерсти. Шерсть можно выстричь (для этого применяют ножницы с загруженными краями, чтобы избежать порезов), выщипать или удалить при помощи бритвы, растягивая для этого кожу большим и указательным пальцами левой руки (чтобы не поранить кожу).
В некоторых случаях для полного удаления шерсти применяют депиляторий*, однако им можно пользоваться только за 2-3 дня до опыта, так как он иногда вызывает раздражение кожи. После применения депилятория кожу очищают от шерсти, промывают теплой водой и смазывают вазелином.
* (Состав депилятория: 7 частей талька, 7 частей белой муки, 1 часть мыльного порошка и 3 части сернистонатриевого сплава.)
При любом способе удаления шерсти перед инъекцией операционное поле дезинфицируют спиртом или спиртовым раствором йода.
Подкожное введение. Место введения выбирают в зависимости от вида животного. Кроликам материал обычно вводят под кожу спины, морским свинкам - под кожу живота или бока, мышам и крысам - под кожу спины или затылка.
Для подкожного введения кожу животного захватывают в складку, иглу вкалывают у основания образовавшейся складки, медленно вводят ее до половины, чуть отклоняя в сторону, чтобы не вылился вводимый материал, затем опускают складку, накладывают на иглу вату, смоченную спиртом или спиртовым раствором йода, и быстро извлекают иглу.
|
|
|
Внутрикожное введение. Этот способ наиболее часто применяют при алергических пробах и введении токсина (например, дифтерийного). Необходимо иметь тонкие, острые иглы (№ 18-20) с короткой бородкой. Удобно использовать туберкулиновый шприц. Кожу, освобожденную от шерсти, растягивают большим и указательным пальцами; иглу вводят под острым углом срезом вверх. Правильно введенная игла просвечивает сквозь эпидермис. Исследуемый материал вводят медленно; на месте введения образуется пузырек, который быстро рассасывается.
Накожный способ. Поверхность кожи после удаления шерсти скарифицируют*. Исследуемый материал наносят а скарифицированный участок и втирают шпателем или стерильной палочкой. Животное должно быть зафиксировано до тех пор, пока нанесенный материал не просохнет.
* (Скарификацией называют повреждение поверхности кожи, которое производят любым остроконечным инструментом: скальпелем, иглой или специальным скарификатором.)
Внутримышечное введение. Материал вводят в толщу мышцы, чаще в мышцу бедр. Для этого удобно захватить мышцу указательным и большим пальцами левой руки; правой рукой под прямым углом вводят иглу.
Внутрибрюшинное введение. При этом способе введения животное следует держать вертикально головой вниз (для перемещения внутренних органов к диафрагме). Иглу вводят в нижнюю часть живота, чуть отступя от средней линии - такое положение уменьшает возможность ранения кишечника. Кроликам и морским свинкам предварительно делают небольшую надсечку верхнего слоя кожи. Применяют иглы с короткой бородкой, которые вводят под острым углом. После прокола кожи шприц переводят в горизонтальное положение и уже под прямым углом к брюшной стенке проталкивают иглу до ощущения "провала", затем ее вновь переводят в вертикальное положение и вводят исследуемый материал.
Внутривенное введение. При этом методе выбор вены зависит от вида животного: кроликам материал вводят в краевую вену уха, мышам и крысам - в вену хвоста, морским свинкам - непосредственно в сердце, так как их вены малодоступны для инъекций.
|
|
|
Для внутривенных инъекций используют иглы с длинной бородкой. Животные должны быть иммобилизованы. После фиксации животного для лучшего выявления вены кожу протирают ватой, смоченной ксилолом или теплой водой. Можно также пощелкать участок кожи, где расположена вена, кончиками пальцев и прижать вену у корня хвоста или уха - эти манипуляции способствуют набуханию вены. Затем экспериментатор левой рукой фиксирует место введения, шприцем, находящимся в правой руке, прокалывает кожу и под очень острым углом, почти параллельно вене, вводит иглу срезом вверх. Если игла не попала в вену, то при надавливании поршня ощущается затруднение и в месте введения появляется белый пузырек, образованный жидкостью, попавшей в ткань. В этом случае иглу извлекают и производят новый укол ближе к корню хвоста (если вводят в вену хвоста) или к основанию уха (если вводят в вену уха). При попадании иглы в вену жидкость свободно проходит в нее. После того как материал введен, иглу прижимают немного ниже места укола, накладывают на это место кусок стерильной ваты, после чего иглу извлекают. Место инъекции протирают спиртом или спиртовым раствором йода.
Морским свинкам исследуемый материал вводят в сердце. Для этого двумя пальцами левой руки прощупывают сердечный толчок и через межреберный промежуток вкалывают иглу в место толчка. При попадании иглы в сердце в шприце показывается кровь, и тогда вводят весь материал.
При инъекциях, особенно в ток крови (в вену, в сердце), вводимая жидкость должна быть свободна от пузырьков воздуха, которые могут вызвать газовую эмболию.
Введение через пищеварительный тракт. Существует несколько способов перорального (через рот) заряжения. Самый простой из них - это примешивание исследуемого материала к пище животного. Этот способ хорош тем, что близок к естественному, однако в этом случае трудно учесть количество вводимого материала. Второй способ - введение материала в желудок с помощью зонда, диаметр и длина которого зависят от вида животного. Вводить зонд следует после того, как в рот животного вставлен роторасширитель. Предварительно зонд смазывают вазелином. Когда введенный зонд достигает носоглотки, в рот вливают несколько капель воды и в момент глотания продвигают зонд. Правильно вставленный зонд должен продвигаться легко и свободно. После того как трубка достигнет желудка, через наружный ее конец шприцем без иглы вводят нужное количество исследуемого материала. Третий способ - закапывание шприцем с иглой. Для этого животное фиксируют в вертикальном положении, открывают рот пинцетом или надавливая двумя пальцами на щеки, и вводят исследуемый материал по каплям, причем каждую каплю вводят только после того, как животное проглотило предыдущую. Такое медленное введение необходимо для устранения возможности попадания жидкости в дыхательные пути. Наконец, исследуемый материал можно вводить в пищевод при помощи шприца с иглой, имеющей на конце оливу. Диаметр иглы должен быть 1 мм, длина зависит от вида животного: 30-40 мм для мышей, 70-80 мм для крыс и т. д.
|
|
|
При таком способе введения животное фиксируют также в вертикальном положении, открывают ему рот пинцетом и вводят иглу, ведя ее по задней стенке зева, затем переводят иглу в вертикальное положение и очень медленно вливают жидкость.
Введение через дыхательные пути. Интраназально (через нос) заражение проводят двумя различными способами. Наиболее простым способом является закапывание исследуемого материала через нос шприцем (чтобы не поранить слизистую оболочку, пользуются тупой иглой). Заражение осуществляют под легким эфирным наркозом; к носу прикладывают вату, смоченную эфиром, под действием которого животное начинает глубоко дышать, втягивая при этом вводимый материал.
Второй способ - закапывание исследуемого материала в ноздри пипеткой (по каплям); при этом способе животное фиксируют брюшком вверх.
Введение в глаз. Вводить материал можно несколькими способами. Производят заражение через конъюнктиву. Для этого, придерживая веко, пипеткой закапывают в глаз исследуемый материал (1-2 капли). Второй способ - субконъюнктивальный. Материал вводят тонкой иглой под конъюнктиву. Этим путем можно ввести 0,1-0,2 мл. Третий способ - введение материала в скарифицированную роговую оболочку; при этом способе животное необходимо фиксировать. Глаз прижимают пинцетом, роговую оболочку скарифицируют концом скальпеля или обычной иглой; в скарифицированную роговую оболочку тонким стеклянным шпателем или ватным тампоном втирают исследуемый материал. Этот способ применяют большей частью при опытах на кроликах и собаках, реже на морских свинках и других животных.
Контрольные вопросы
1. Что такое операционное поле и как его обрабатывают?
2. Какие способы заражения животных Вы знаете?
3. От чего зависит количество вводимого животному материала?
Задание
Нарисуйте схему маркировок белой мыши. Нанесите краску на схему так, чтобы номер животного соответствовал 3.
В табл. 12 приведены величины максимального количества вводимой жидкости в зависимости от вида животных и способа введения.

Таблица 12. Схема введения инфицированного материала животным
|
|
|


