 |
Распределение электронов по энергетическим уровням
|
|
|
|
Электроны распределяются по подуровням, образуя вокруг ядра облака определенной формы, это распределение зависит от количества их энергий, то есть чем ближе электрон к ядру атома, тем меньше его количество энергии.
Электроны стремятся занять положение, соответствующее минимальному значению энергии, и располагаются вокруг ядра согласно принципу Паули. Как известно из предыдущих тем, наибольшее число электронов, которые могут расположиться в каждом электронном слое, определяется по формуле N = 2n2. Первый электронный слой или слой К находится на самом близком расстоянии от ядра атома и имеет n=1. В соответствии с этим на этом слое совершают движение N=2-12=2 электрона. На втором электронном слое могут разместиться 8, на третьем — 18, а на четвертом — 32 электрона.
Во внешних электронных слоях всех элементов (кроме элементов 1 периода) находится не более восьми электронов. Внешние электронные слои инертных газов (за исключением гелия) заполнены восемью электронами, поэтому эти газы химически устойчивы.
На внешнем энергетическом уровне элементов основной подгруппы периодической таблицы число электронов равно номеру группы. Число электронов во внешнем слое элементов побочной подгруппы не превышает двух, при переходе от одного элемента ко второму притягиваемые электроны переходят из внешнего слоя во внутренний, так как внешний пополняется ns2·nр6 электронами, а присоединяющиеся электроны занимают подуровень nd.
Так, атом марганца имеет следующее строение: Мn(+25) 2, 8, 13, 2, а его электронная формула: 1s2 · 2s2 · 2p6 · 3s2 · 3p6 · 3d5 · 4s2.
Согласно принципу Паули, в любом атоме не может быть двух электронов с одинаковыми квантовыми числами.
|
|
|
Следовательно, на каждой орбитали атома значение трех квантовых чисел — n, l, m (главного, орбитального и магнитного) может быть одинаковым, однако спиновые квантовые числа (s) различаются, то есть имеются электроны с противоположными спинами 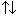 .
.
Пополнение подуровней электронами было выяснено с помощью правила В.М. Клечковского (1900-1972 гг.) согласно которому, электроны заполняют энергетические подуровни в следующем порядке:

Порядок заполнения ячеек (клеточек) энергических уровней электронами подчиняется правилу Хунда. Сначала происходит заполнение ячеек 2р заняты шестью электронами. Следующий электрон, согласно правилу Клечковского, переходит в энергетический подуровень 3s:

19. Правило Клечковского гласит:
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел  . При одинаковой сумме раньше заполняется орбиталь с меньшим значением . При одинаковой сумме раньше заполняется орбиталь с меньшим значением 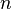 . .
|
Правило n + l предложено в 1936 г. немецким физиком Э. Маделунгом; в 1951 г. было вновь сформулировано В. М. Клечковским.
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числаl) определяется Правилом Хунда.
20.А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что более чем в 10 тысяч раз меньше размеров самого атома.
|
|
|
Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия
Количество протонов в ядре называется его зарядовым числом 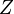 — это число равно порядковому номеру элемента, к которому относится атом, в таблице (Периодической системе элементов) Менделеева. Количество протонов в ядре определяет структуруэлектронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом
— это число равно порядковому номеру элемента, к которому относится атом, в таблице (Периодической системе элементов) Менделеева. Количество протонов в ядре определяет структуруэлектронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом 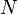 . Ядра с одинаковым числом протонов и разным числом нейтронов называютсяизотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом
. Ядра с одинаковым числом протонов и разным числом нейтронов называютсяизотопами. Ядра с одинаковым числом нейтронов, но разным числом протонов — называются изотонами. Термины изотоп и изотон используются также применительно к атомам, содержащим указанные ядра, а также для характеристики нехимических разновидностей одного химического элемента. Полное количество нуклонов в ядре называется его массовым числом 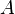 (
(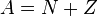 ) и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами.
) и приблизительно равно средней массе атома, указанной в таблице Менделеева. Нуклиды с одинаковым массовым числом, но разным протон-нейтронным составом принято называть изобарами.
Ядерная реакция — процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма-квантами и друг с другом. Ядерная реакция – это процесс взаимодействия атомного ядра с другим ядром или элементарной частицей, сопровождающийся изменением состава и структуры ядра и выделением вторичных частиц или γ-квантов. Впервые ядерную реакцию наблюдал Резерфорд в 1919 году, бомбардируя α-частицами ядра атомов азота, она была зафиксирована по появлению вторичных ионизирующих частиц, имеющих пробег в газе больше пробега α-частиц и идентифицированных как протоны. Впоследствии с помощью камеры Вильсона были получены фотографии этого процесса.
По механизму взаимодействия ядерные реакции делятся на два вида:
· реакции с образованием составного ядра, это двухстадийный процесс, протекающий при не очень большой кинетической энергиисталкивающихся частиц (примерно до 10 МэВ).
|
|
|
· прямые ядерные реакции, проходящие за ядерное время, необходимое для того, чтобы частица пересекла ядро. Главным образом такой механизм проявляется при больших энергиях бомбардирующих частиц.
Лишь небольшая часть нуклидов являются стабильными. В большинстве случаев ядерные силы оказываются неспособны обеспечить их постоянную целостность, и ядра рано или поздно распадаются. Это явление получило название радиоактивности.
Радиоактивность
Радиоактивностью называется способность атомного ядра самопроизвольно распадаться с испусканием частиц. Радиоактивный распад характеризуется временем жизни радиоактивного изотопа, типом испускаемых частиц, их энергиями.
Основными видами радиоактивного распада являются:
- α-распад – испускание атомным ядром α-частицы;
- β-распад – испускание атомным ядром электрона и антинейтрино, позитрона и нейтрино, поглощение ядром атомного электрона с испусканием нейтрино;
- γ-распад – испускание атомным ядром γ-квантов;
· спонтанное деление – распад атомного ядра на два осколка сравнимой массы.
21. периодическая система и периодический закон К началу XIX в. было известно около 30 элементов, к середине XIX в.— около 60. По море накопления числа элементов возникла задача их систематизации. Таких попыток до Д.И. Менделеева было не меньше пятидесяти; за основу систематизации принимались: и атомный вес (ныне называемый атомной массой), и химический эквивалент, и валентность. Подходя к классификации химических элементов метафизически, пытаясь систематизировать только известные в то время элементы, ни один из предшественников Д. И. Менделеева не мог открыть всеобщую взаимосвязь элементов, создать единую стройную систему, отражающую закон развития материи. Эта важная, для науки задача была блестяще разрешена в 1869 г. великим русским ученым Д. И. Менделеевым, открывшим периодический закон.
За основу систематизации Менделеевым были взяты: а) атомный вес и б) химическое сходство между элементами. Наиболее ярким, выразителем сходства свойств элементов является их одинаковая высшая валентность. Как атомный вес (атомная масса), так и высшая валентность элемента представляют собой количественные, числовые константы, удобные для систематизации.
Расположив все известный в то время 63 элемента в ряд по возрастанию атомных масс, Менделеев заметил периодическую повторяемость свойств элементов через неодинаковые промежутки. В результате Менделеевым был создан первый вариант периодической системы.
Закономерный характер изменения атомных масс элементов по вертикалям и горизонталям таблицы, а также образовавшиеся в ней пустые мecта позволили Менделееву смело предсказать наличие n природе ряда элементов, еще не известных в то время науке и даже наметить их атомные массы и основные свойства, исходя из предполагаемого положения элементов в таблице. Это можно било сделать лишь на основе системы, объективно отражающей закон развития материи. Сущность периодического закона Д. И. Менделеев сформулировал в 1869 г.: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов (масс) элементов".
|
|
|
Конструкция современной периодической системы в принципе мало отличается от варианта 1871 г. Символы элементов в периодической системе расположены по вертикальным и горизонтальным графам. Это приводит к объединению элементов в группы, подгруппы, периоды. Каждый элемент занимает в таблице определенную клетку. Вертикальные графы – это группы (и подгруппы), горизонтальные – периоды (и ряды).
Ковалентная связь
Связь, возникающая при взаимодействии электронов с образованием обобщенных электронных пар, называется ковалентной.
В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной. Она имеет место в простых веществах-неметаллах: H22, О22, N22, Cl22, P44, O33.
При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора.
Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример полярной ковалентной связи.
Свойства ковалентной связи
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства органических соединений.
|
|
|
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
23. Ионная связь — химическая связь, образующаяся между атомами с большой разностьюэлектроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
Так как ион может притягивать к себе ионы противоположного знака в любом направлении, ионная связь от ковалентной отличается ненаправленностью.
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому они могут притягивать и другие ионы противоположного знака, то есть ионная связь отличается ненасыщенностью.
24. Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов.
Металлическая связь — связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Водородная связь
Атом водорода, соединенный с атомом фтора, кислорода или азота (реже - хлора, серы или других неметаллов), может образовывать еще одну дополнительную связь. Это открытие, сделанное в восьмидесятых годах девятнадцатого столетия, связывают с именами русских химиков М.А. Ильинского и Н.Н. Бекетова. Было установлено, что некоторые водородсодержащие группы атомов часто образуют устойчивую химическую связь с электроотрицательными атомами, входящими в состав другой или той же самой молекулы. Такая химическая связь получила название водородной связи.
Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ... В (чертой обозначена ковалентная связь, тремя точками - водородная связь).
Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи. Она может быть описана с помощью метода молекулярных орбиталей как трехцентроваядвухэлектронная связь.
Одним из признаков водородной связи может служить расстояние между атомом водорода и другим атомом, ее образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, в которых расстояние Н ... В больше, чем А−В. Однако в редких случаях (фтороводород, некоторые карбоновые кислоты) водородная связь является симметричной. Угол между атомами во фрагменте А−Н ... В обычно близок к 180o. Наиболее сильные водородные связи образуются с участием атомов фтора. В симметричном ионе [F−H−F]− энергия водородная связи равна 155 кДж/моль и сопоставима с энергией ковалентной связи. Энергия водородная связи между молекулами воды уже заметно меньше (25 кДж/моль).
26. Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
· Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
· В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
Закон Гесса (1841г.)
Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое.
28. Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
В 1865 году Н. Н. Бекетовым и в 1867 году Гульдбергом и Вааге был сформулирован закон действующих масс: скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
· природа реагирующих веществ,
· наличие катализатора,
· температура (правило Вант-Гоффа, Уравнение Аррениуса),
· давление,
· площадь поверхности реагирующих веществ.
Если мы рассмотрим самую простую химическую реакцию A + B → C, то мы заметим, что мгновенная скорость химической реакции величина непостоянная
29.Закон действия масс. В 1865 г. профессор Н.Н. Бекетов впервые высказал гипотезу о количественной взаимосвязи между массами реагентов и временем течения реакции.Эта гипотеза нашла подтверждение в законе действующих масс, который был установлен в 1867 г. двумя норвежскими химиками К. Гульдбергом и П. Вааге. Современная формулировка закона действующих масс такова:
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
|
|
|


