 |
Техника проведения лечебно-медикаментозных блокад с глюкокортикостероидами
|
|
|
|
УНИВЕРСИТЕТ»
КУРУШИНА О.В., ГОРДЕЕВА И.Е.
ИНВАЗИВНЫЕ МЕТОДЫ ЛЕЧЕНИЯ В НЕВРОЛОГИИ С ИСПОЛЬЗОВАНИЕМ
ГЛЮКОКОРТИКОСТЕРОИДОВ
Методическое пособие
Издание рекомендовано к печати центральной методической комиссией ГОУ ВПО «ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ
МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
ВОЛГОГРАД-2010
УДК 617.546:615.211
ББК 56.12
Рецензенты:
Оруджев Назим Яшарович – доктор медицинских наук, профессор, зав. кафедрой психиатрии ВолГМУ
Шахова Евгения Георгиевна – доктор медицинских наук, профессор, зав. кафедрой ЛОР болезней ВолГМУ
Курушина О.В.
Р 93 Инвазивные методы лечения в неврологии / О.В. Курушина, И.Е. Гордеева – Волгоград: ООО «Принт», 2013. – с.: ил.
ISBN 5-94424-064-4
О.В.Курушина – доктор медицинских наук, заведующая кафедрой неврологии, нейрохирургии с курсом медицинской генетики Волгоградского государственного медицинского университета
И.Е. Гордеева - кандидат медицинских наук, ассистент кафедры неврологии, нейрохирургии с курсом медицинской генетики Волгоградского государственного медицинского университета
Утверждено ЦМК терапевтических дисциплин, протокол № от
Разработанная нами медицинская технология впервые предлагает методику комплексного курсового лечения болевых синдромов в области спины. Метод основан на определении места – источника болевой импульсации (зоны диско-радикулярного конфликта, фасеточного, синувертебрального или миотонического синдрома) с помощью неврологического обследования и анализа данных параклинических методов исследования (рентгенографии, УЗИ мягких тканей спины, МРТ или КТ позвоночника) и воздействия на него. В основе метода лежат курсовые постадийные паравертебральные лечебно-медикаментозные блокады, выполняемые малотравматичными инсулиновыми шприцами подкожно с целью одномоментной инфильтрации нескольких актуальных паравертебральных точек смесями фармакологических препаратов, обладающих противовоспалительным, анальгетическим, хондропротекторным, трофическим, регенерирующим действием. Разработанный метод, в отличие от ранее применяемых методов, обеспечивает стойкую ремиссию, безопасен, прост в исполнении и не приводит к осложнениям. Предложенный способ лечения актуален, соответствует современному состоянию науки и может быть рекомендован для применения в широкой клинической практике.
|
|
|
Методическое пособие предназначено для интернов, ординаторов и врачей-неврологов, нейрохирургов, ревматологов, ортопедов и может быть использовано в лечебно-профилактических учреждениях общего профиля.
ББК 56.12
ISBN 5-94424-064-4
Рыбак В.А., 2010
ООО «Принт», 2010
ВВЕДЕНИЕ
Инвазивные методы лечения в неврологии представляют собой один из важных и действенных методов воздействия на болевой синдром при дегенеративно-дистрофических поражениях позвоночника, радикулопатиях, туннельных синдромах и других заболеваниях нервной системы. Основной целью таких методов лечения является борьба с острой болью. Данная проблема приобретает в неврологии все большее значение в связи с ростом заболеваемости, сопровождающейся острыми и хроническими болевыми синдромами. Именно своевремнное, быстрое купирование острой боли позволяет в большинстве случаев предотвратить ее переход в хроническую, терапевтически резистентную форму, инвалидизирующую больных (Арзуманов А.В., 1999; Беленький А.Г., 2002; Подчуфарова Е.В, 2003, 2005).
Инвазивные методы лечения направлены на устранение, «блокирование» боли различного генеза и часто дают быстрый эффект, не имея значительного системного влияния, в большинстве случаев быстро и легко выполнимы. Для хорошего лечебного эффекта при их проведении необходим системный подход, учитывающий нозологический и топический диагноз, характер и степень выраженности неврологического синдрома, знание анатомических особенностей места инъекции лечебной смеси и некоторых других важных параметров (Рыбак В.А. с соавт., 2009).
|
|
|
Болевые синдромы в области спины – наиболее частая причина обращения людей к врачам-неврологам (Дамулин И.В., 2007). Из-за высокой распространенности вызывают серьезные социально-экономические последствия, приводя к длительной потери трудоспособности (у 4% заболевших) и к инвалидности (у 1% заболевших) (Borenstein D., 2000). Боли в спине различной интенсивности в разные периоды жизни человека встречаются у 80-100% лиц в популяции (Алексеев В.В., 2004, Вейн А.М., 1999). В США боли в спине – вторая по частоте причина обращения к врачам общей практики, пятая – по частоте госпитализации (Дамулин И.В., 2007).
Среди причин дорсалгий выделяют: дисфункцию мышечно-связочных структур спины (миофасциальный, миотонический синдромы), спондилоартроз (фасеточный синдром), дискогенную радикулопатию, синувертебральный синдром, стеноз позвоночного канала. В каждом из этих случаев болевой синдром имеет клиническое своеобразие, различную временную динамику и прогноз. Однако, несмотря на обилие консервативных методов лечения, болевые синдромы в области спины часто плохо поддаются лечению, рецидивируют, сопровождаясь мучительным болевым синдромом и у примерно 18-20% пациентов хронизируются (Вейн А.М., 1999; Katz W.A., 2002).
Недостаточную эффективность общепринятых методов консервативного лечения можно объяснить их симптоматической направленностью – устранить боль. Массированное, зачастую неконтролируемое использование неспецифических противовоспалительных препаратов (НПВС) приводит к их негативным побочным эффектам: ульцерогенному, кардиотоксическому, нефротоксическому, может вызывать изменения периферической крови, усугублять дистрофические процессы в суставной ткани и др. Множество побочных эффектов зачастую вызывают крайне негативное отношение больных к данной группе лекарственных средств, отказ от их приема и даже поиск методов лечения вне стен учреждений здравоохранения (у сомнителных костоправов, целителей и пр.) (Hemy D., et al., 1996).
|
|
|
Поэтому инвазивные методы лечения приобретают все большую популярность, как среди неврологов, так и среди их пациентов. Местное применение обезболивающих средств известно с давних пор. Об этом имеются данные в египетских манускриптах и в работах Гиппократа. Первоначально препараты предназначались для наружного применения при болях и воспалении. В более поздние времена препараты стали вводить в мягкие ткани, где локализовалась максимальная боль (Лобзин Б.С., 1973).
Все локальные инвазивные методы лечения, основной целью которых, прежде всего, является аналгезия, т.е. «блокирование боли», а также устранение ее этиопатогенетических основ, называются лечебно-медикаментозными блокадами (ЛМБ) (Рыбак В.А. с соавт., 2009)(рис.1).
Однако их лечебный эффект не ограничивается только анальгезией. Он
включает в себя еще несколько важных воздействий как в зоне патологического очага, так и на отдалении (Коган О.Г., 1985).
Лечебный эффект блокад обусловлен несколькими механизмами:
1) Фармакологическим действием анестетика, как основного компонента ЛМБ, связанным с блокадой ноцицепторов и нервных проводников, снижением биоэлектрической активности из зон мышечных гипертонусов, уменьшением «бомбардировки функционально измененных сегментарных аппаратов» и соответственно рефлекторных синдромов.
2)Фармакологическим действием сопутствующих лекарственных препаратов, особенно эффектом глюкокортикоидов – в который входит мощное противоотечное и противовоспалительное действие.
3) Эффектом «снайперского укола» - точно в зону диско-радикулярного конфликта, место туннельной компрессии, триггерный пункт и т.п.
4) Механическим действием иглы. В случае блокады триггерного пункта механическое воздействие иглы способно уничтожить активный триггерный пункт (метод сухой иглы).

Рисунок 1. Лечебно-медикаментозные блокады
|
|
|
5)Эффектом максимальной концентрации препаратов в патологическом очаге.
6) Вегетотропным действием – нормализация сосудистой иннервации, нарушения трофики, отека и воспаления (вегетотропным действием обладают анестетики, а также сами вегетотропные препараты, которые могут включаться в ЛМБ) (Соков Е.Л., 1988; 1995).
8) Сосудистым эффектом – восстановления МКЦ (примером могут служить ЛМБ с актовегином).
9) Минимальными побочными воздействиями вводимых препаратов из-за того, что для блокады необходимо гораздо меньшее количество препарата в сравнении, например, с обычной инъекциейи др. (Третьяков В.П., 1975, Ибатулин Н.А. с соавт., 1998, Попелянский Я.Ю., 2003).
При выполнении лечебно-медикаментозной блокады отмечается обычно фазное изменение болевого синдрома:
Первая фаза - обострение боли из-за механического раздражения рецепторов болезненной зоны при введении первых порций раствора; длительность фазы соответствует латентному периоду анестетика (минуты).
Вторая фаза – анестезия (боль уменьшается до минимального уровня - в среднем до 25% менее от исходного уровня болевого синдрома). Длительность этой фазы определяется длительностью действия анестетика в болезненной зоне (часы).
Третья фаза – подлинная анальгезия (после окончания действия анестетика и выведения его из организма боль возобновляется, но в среднем до 50% от исходного уровня болевого синдрома). Длительность этой фазы может быть от нескольких часов до суток (Соков Е.Л., 1988; 1995).
Если же вместо однокомпонентной блокады анестетиком использовать лекарственный коктейль с ГКС, то значительно возрастает анальгетический эффект и наступает:
Четвертая фаза – лечебный эффекта глюкокортикоида продолжительностью от суток до нескольких суток, при этом происходит нормализация большинства звеньев этиопатогенеза дорсопатиии (отек, воспаление и пр.). Чаще это паравертебральные блокады. Иногда, по нашим данным, существенной ремиссии можно добиться с помощью монотерапии такими блокадами (например, в случае негативного отношения больного к НПВС).
Глюкокортикостероиды
В настоящее время, наряду с анестетиками, при выполнении лечебно-медикаментозных блокад получили распространение глюкокортикостероиды - гормональные лекарственные препараты, являющиеся производными кортизола, естественного гормона человека, вырабатываемого надпочечниками, позволяющие значительно усилить эффект блокады и получить не только благоприятный ближайший, но и отдаленный результат (Гехт Б.М., 1985). Однако множество препаратов, выпускаемых фармацевтической промышленностью и применяемых в различных сочетаниях, к сожалению, не всегда эффективны. Это вызвано недостаточным пониманием неврологами патогенеза заболевания, трудностями в дифференциальной диагностике и неправильным выбором соответствующей методики для производства блокады. Выбор препарата зависит от личных предпочтений того или иного врача, его клинического опыта. Часто субъективные причины довлеют над объективными, ярко заметен консерватизм при появлении новых медикаментозных средств (Радченко В.А., 2000).
|
|
|
Глюкокортикостероиды (ГКС) играют очень важную роль в обмене веществ организма, они влияют на углеводный и белковый обмен, менее активны в отношении водного и солевого, в отличие от минералокортикостероидов. Глюкокортикоиды оказывают мощное противовоспалительное, десенсибилизирующее, антиаллергическое, иммунодепрессивное, противошоковое и антитоксическое действие. Противовоспалительное действие ГКС обусловлено многими факторами, ведущим из которых является подавление активности фосфолипазы А 2. Они увеличивают экспрессию генов, кодирующих синтез липокортинов, которые ингибируют активность фосфолипазы А 2. Угнетение этого фермента приводит к подавлению освобождения арахидоновой кислоты и торможению образования ряда медиаторов воспаления — простагландинов, лейкотриенов, тромбоксана, и др. Кроме того, глюкокортикоиды уменьшают экспрессию гена, кодирующего синтез ЦОГ-2, дополнительно блокируя образование провоспалительных простагландинов. ГКС улучшают микроциркуляцию в очаге воспаления, уменьшают экссудацию жидкости, стабилизируют клеточные мембраны, в т.ч. мембраны лизосом, предотвращая выход лизосомальных ферментов и снижая тем самым их концентрацию в месте воспаления. Таким образом, глюкокортикоиды влияют на альтеративную и экссудативную фазы воспаления, препятствуют распространению воспалительного процесса. Ограничение миграции моноцитов в очаг воспаления и торможение пролиферации фибробластов обусловливают антипролиферативное действие. Глюкокортикоиды подавляют образование мукополисахаридов, ограничивая тем самым связывание воды и белков плазмы в очаге воспаления, угнетают активность коллагеназы, препятствуя деструкции хрящей и костей при ревматоидном артрите. Местное применение ГКС при остеохондрозе (корешковом синдроме) показало их высокую эффективность (Green L., 1975; Horn H., 1985; Гехт Б.М., 1985).
Практическое применение из естественных глюкокортикоидов нашли кортизон и гидрокортизон, однако, они чаще, чем другие глюкокортикоиды, вызывают побочные явления и, в связи с появлением более эффективных и безопасных препаратов в настоящее время имеют ограниченное применение. Синтезирован целый ряд синтетических глюкокортикоидов, среди которых выделяют нефторированные (преднизон, преднизолон, метилпреднизолон) и фторированные (дексаметазон, бетаметазон, триамцинолон и др.). Эти соединения, как правило, более активны, чем природные глюкокортикоиды, применяются в меньших дозах. Более благоприятным соотношением между глюкокортикоидной/противовоспалительной и минералокортикоидной активностью отличаются фторированные производные. Так, противовоспалительная активность дексаметазона (по сравнению с таковой гидрокортизона) выше в 30 раз, бетаметазона — в 25–40 раз, триамцинолона — в 5 раз, при этом влияние на водно-солевой обмен минимально. Фторированные производные отличаются не только высокой эффективностью, но и низкой абсорбцией при местном применении, т.е. меньшей вероятностью развития системных побочных эффектов.
По длительности действия ГКС можно разделить на три группы (в скобках дан биологический период полувыведения (T 1/2)):
1) глюкокортикоиды короткого действия (T 1/2 — 8–12 ч): гидрокортизон, кортизон;
2) глюкокортикоиды средней продолжительности действия (T 1/2 — 18–36 ч): преднизолон, преднизон, метилпреднизолон;
3) глюкокортикоиды длительного действия (T 1/2 — 36–54 ч): триамцинолон, дексаметазон, бетаметазон.
Именно последняя группа показала максимальную эффективность при местном применении в виде монокомпонентных или поликомпонентных (коктейль с анестетиком) блокад.
Дексаметазон (дексаметазона натрия фосфат) - метилированное производное фторпреднизолона. Оказывает противовоспалительное, противоаллергическое, десенсибилизирующее, иммунодепрессивное, противошоковое и антитоксическое действие, повышает чувствительность бета-адренорецепторов к эндогенным катехоламинам. Взаимодействует со специфическими цитоплазматическими рецепторами и образует комплекс, проникающий в ядро клетки и стимулирует синтез мРНК; последняя индуцирует образование белков, в т.ч. липокортина, опосредующих клеточные эффекты. Липокортин угнетает фосфолипазу А2, подавляет высвобождение арахидоновой кислоты и подавляет синтез эндоперекисей, Pg, лейкотриенов, способствующих процессам воспаления, аллергии и др. Обычно дексаметазон хорошо переносится. Он обладает низкой минералокортикоидной активностью, то есть его влияние на водно-электролитный обмен невелико. Как правило, низкие и средние дозы Дексаметазона не вызывают задержки натрия и воды в организме, повышенной экскреции калия.
Кеналог (триамцинолона ацетонид) - благодаря медленному всасыванию, длительно действует в местных тканях. Лечебные блокады с кеналогом проводятся внутрисуставно в основном при хронических артрозо-артритах для создания длительно действующего депо глюкокортикоида. Повторно вводить кеналог можно только через неделю. Поэтому для его введения необходимо иметь точное представление о локализации патологического процесса. При проведении первых блокад, которые несут большую диагностическую нагрузку, применение кеналога нецелесообразно. Кроме того, препарат может вызывать дермолиподистрофию, особенно при попадании под кожу.
Дипроспан - благодаря мощному противовоспалительному действию и сочетанию быстрого и пролонгированного прогнозируемого эффекта, препарат обладает высокой безопасностью и самым малым риском возможности «развития» осложнений. В основе этих качеств лежит уникальная микрокристаллическая структура, выгодно отличающая дипроспан от других подобных препаратов. Малые размеры кристаллов дипроспана (5,3мкм – дипроспан, 14,0мкм – триамцинолон) обеспечивают возможность использования его интра- и периартикулярно, не вызывая местнодистрофического эффекта и микрокристаллической реакции.

Рисунок 2. Дипроспан. Новая форма выпуска - шприцевая.
Препарат представляет собой водную пролонгированную форму бетаметазола, содержащая два действующих компонента: 1) хорошо растворимый, быстродействующий эфир бетаметазола динатрия фосфата-2 мг; 2) слаборастворимая, медленно всасывающаяся и медленно действующая фракция бетаметазола дипропионат - 5 мг. Уникальность дипроспана заключается в наличии в нем двух фракций: бетаметазона натрия фосфат - легко растворяется, гидролизуется и всасывается после введения, обеспечивая быстрый лечебный эффект. Выводится в течение суток. Другой - бетаметазона дипропионат - после введения создает депо, откуда высвобождается постепенно. В результате обеспечивается длительное действие препарата. Время полного выведения составляет 10 суток и более. Активность 1 мг дипроспана в 25 раз эффективнее гидрокортизона. В этой связи дипроспан является и более безопасным из-за меньшей кратности его введения, и экономически более выгодным. Кроме того, кристаллы дипроспана маленькие и имеют закругленную форму, это снижает риск возникновения реактивного воспаления в ответ на повреждение ткани острыми краями кристаллов и позволяет безболезненно применять его при блокадах. Препарат выпускается в ампулах по 1мл и специальных шприцах с ввинчивающимся поршнем и дополнительной иглой (рис. 2).
В неврологической практике применение ГКС основано на их мощном противовоспалительном и противоотечном эффекте. Но, учитывая их многочисленные побочные эффекты чаще всего их применяют в виде локальных блокад, например, в точке диско-радикулярного конфликта (паравертебральные блокады) при радикулопатиях, при туннельных синдромах, периартропатиях, фасеточном синдроме и др. Являясь природными или синтетическими аналогами собственных гормонов человека, ГКС способны эффективно устранять многие факторы этиопатогенеза острых вертеброгенных синдромов: отек, компрессию корешка, воспаление, боль.
Для достижения противоболевого и противовоспалительного эффекта при блокадах необходимо небольшое количество глюкокортикоида, который практически полностью реализуется в тканях заитересованного очага, а резорбтивный эффект минимален, но достаточен для устранения относительной надпочечниковой глюкокортикоидной недостаточности, которая часто наблюдается при хронических болевых синдромах (Билялов М.Ш., 1971).
Глюкокортикоиды при системном применении вызывают разнообразные поражения кожи, включая стероидные угри, атрофию, стрии и другие симптомы синдрома Кушинга. Необходимо помнить, что к побочным эффектам стероидной терапии относятся гипергликемия, задержка натрия, остеопороз, надпочечниковая недостаточность, ослабление иммунитета. Применение стероидных гормонов в минимальных дозах, особенно местно, не опасно. Однако у пациентов с гипертонической болезнью, язвой желудка и двенадцатиперстной кишки, сахарным диабетом, гнойными и септическими процессами, а также у престарелых пациентов глюкокортикоиды должны применяться с особой осторожностью.
В 2006г на нашей кафедре проведено исследование с целью определения эффективности применения глюкокортикостероидов (ГКС) в сравнении с другими группами препаратов с подобным спектром клинического действия. В условиях неврологического отделения Областной клинической больницы №1 г. Волгограда были обследованы и пролечены 70 больных с остеохондрозом позвоночника, с различными клиническими проявлениями в стадии обострения. Больные были разделены на ряд групп. Больным 1-й группы (35 человек) были назначены паравертебральные блокады с ГКС и анестетиком (2% раствором лидокаина). Были использованы следующие ГКС: суспензия гидрокортизона 25% (0,5-1,5мл на блокаду), дексаметазон (2-4мг на блокаду), дипроспан (0,5-1мл), «Кеналог-40» (20-40мг на блокаду) курсом 3-7 блокад. Десяти больным 2-й группы был назначен препарат «Амбене» (в его составе 3,32 мг дексаметазона, 4 мг лидокаина, вит В12 и НПВС) в виде внутримышечных инъекций. Больные 3-й группы (25 человек) получали НПВС в средних терапевтических дозах как энтерально, так и парентерально (Рыбак В.А., Гордеева И.Е., 2006).
Эффективность оценивалась по следующим клиническим критериям: субъективное уменьшение болевого синдрома (в баллах), период иммобилизации больного (в днях), регресс неврологической симптоматики, длительность заболевания (в днях). Исследование показало наибольшую эффективность применения медикаментозных блокад в лечении острой стадии вертеброгенных синдромов. Так у 26 больных (74,2%) 1-й группы уже после 3-х блокад отмечалось значительное улучшение по всем перечисленным выше клиническим критериям. Из побочных эффектов необходимо отметить повышение АД (у 6 человек) и дерматолиподистрофии (у 3 больных) в месте блокады после использования препарата «Кеналог-40», которые возникли у больных через 2-3 недели. Препарат «Амбене» оказался на 2-м месте по эффективности. У одного больного отмечалось ухудшение симптоматики, у двух больных нежелательные побочные явления в виде гипертонического криза. НПВС оказались на 3-м месте по эффективности в купировании острых вертеброгенных синдромов.
Поскольку врачи-неврологи часто используют в своей практике дипроспан и кеналог-40, мы приводим данные по сравнению их эффективности у больных с остеоартрозом (А.М. Лила, 2002). Хотя неврологи не используют внутрисутавные блокады, но данные по сравнению эффективности дипроспана и кеналога-40 будут весьма интересными и полезными.
Все больные были разделены на две группы: пациентам 1-й группы назначались НПВП и дипроспан внутрисуставно, пациентам 2-й группы - НПВП и внутрисуставно кеналог-40. Доза дипроспана (кеналога-40) при внутрисуставном введении зависела от величины сустава: в плечевые и коленные суставы вводили по 1 мл; локтевые, лучезапястные и голеностопные — по 0,5 мл.
Положительный клинический эффект на фоне проводимой терапии отмечался у всех больных. Следует отметить, что первые признаки клинического улучшения (уменьшение суставных болей) после внутрисуставного введения глюкокортикоидов наблюдались уже через 3-4 часа после введения, достигая максимального эффекта на 2-е сутки. При этом, выраженный клинический эффект у больных 1-й группы (дипроспан) сохранялся на протяжении 2-3 недель, в то время как у подавляющего большинства пациентов 2-й группы через 8-10 дней требовалось повторное введение кеналога-40. При использовании дипроспана у больных ОА наблюдалось также более быстрое купирование явлений синовиита.
Как известно, водно-кристаллическая суспензия дипроспана содержит два активных вещества: 2 мг бетаметазона динатрия фосфата, который легко растворим в воде, быстро всасывается и оказывает немедленный терапевтический эффект (пиковая концентрация достигается через несколько минут после введения препарата), а также 5 мг бетаметазона дипропионата, обеспечивающего длительное лечебное воздействие благодаря очень медленному всасыванию, постепенной метаболизации и длительному периоду выведения.
Важно, что быстрота наступления и продолжительность действия дипроспана позволила практически у всех пациентов в первые же дни терапии существенно (на 50%) снизить дозу принимаемых НПВП, что отразилось и на стоимости курса лечения.
При внутрисуставном введении дипроспана 91,7% больных отмечали существенное уменьшение выраженности болевого синдрома, 83,3% — уменьшение припухлости пораженного сустава, улучшение функционального состояния поврежденного сустава и увеличение в связи с этим физической активности отметили все 100% пациентов. Для кеналога-40 эти показатели составили соответственно 86,4%, 77,3% и 100%.
Следует подчеркнуть, что при введении дипроспана не наблюдалось развитие микрокристаллического артрита, который нередко возникает после введения кеналога-40 и требует дополнительного назначения анальгетиков. Это связано со структурными особенностями изучаемых препаратов: концентрация кристаллов в 1 мл дипроспана равна 6,4 мг/мл, в то время как в 1 мл кеналога — 40 мг/мл. Кроме того, средний размер кристаллов дипроспана составляет от 2 до 6 мкм, тогда как величина кристаллов кеналога-40 — около 12 мкм.
Переносимость глюкокортикоидов была хорошей у всех обследованных пациентов, при этом побочные эффекты у больных 1-й группы встречались в 11,1% случаев, у больных 2-й группы — у 18,2%. В основном они проявлялись в сосудистых реакциях: чувство жара, головокружение, покраснение лица, некоторые больные жаловались на подташнивание. Таким образом, сравнительный анализ применения дипроспана и кеналога-40 у больных ОА показал более высокую эффективность дипроспана. К преимуществам дипроспана также можно отнести безболезненность введения и возможность его применения без анестетика, что уменьшает риск развития аллергических реакций, а также высокую клиническую эффективность при минимальной введенной дозе, что позволяет удлинять интервал между инъекциями и снижает опасность развития побочных эффектов (А.М. Лила, 2002).
Основные показания для проведения ЛМБ с глюкокортикоидами:
1.Туннельные синдромы.
2.Радикулопатии.
3.Невралгии.
4.Плексопатии.
5.Цервикалгии.
6.Цервикокраниалгии.
7.Фасеточный синдром.
8.Периартропатии.
9. Плечелопаточный периартроз.
Алгоритм действий врача при выполнении инвазивных методик:
1. Получить письменное согласие больного на проведение данной процедуры.
2. Собрать анамнез, включая аллергический, провести аллергические пробы.
3. Обеспечить строгое соблюдение правил асептики и антисептики.
4. Контролировать состояние больного в период проведения процедуры для своевременного распознавания осложнений (АД, ЧСС, ЧД и др.). Если появились признаки осложнений, не вводить следующую инъекцию (если их запланировано несколько).
5. При появлении осложнений принять меры по их ликвидация (путем введения антигистаминных препаратов, гормональных препаратов и др).
6. Наблюдать за больным после проведения ЛМБ в течение 1 часа для выявления признаков отдалённых осложнений.
ТЕХНИКА ПРОВЕДЕНИЯ ЛЕЧЕБНО-МЕДИКАМЕНТОЗНЫХ БЛОКАД С ГЛЮКОКОРТИКОСТЕРОИДАМИ
Паравертебральные блокады
При планировании лечебных мероприятий с использованием лечебных блокад изучают возможные источники возникновения болевого синдрома. В его основе лежат нарушения в различных анатомических структурах позвоночного двигательного сегмента: межпозвонкового диска, задней продольной связки, эпидуральных сосудов, спинномозговых нервов, оболочек спинного мозга, дугоотростчатых суставов, мышц, костей и связок. Иннервация перечисленных структур осуществляется за счет возвратной (нерв Люшка) и задней ветви спинномозгового нерва. И возвратная, и задняя ветви несут информацию, которая в дальнейшем распространяется по чувствительной порции нервного корешка в центростремительном направлении. Соответственно иннервации позвоночного сегмента возможно определение уровня прерывания патологических импульсов за счет блокады нервных ветвей.
Паравертебральные блокады являются одной из наиболее частых манипуляций в деятельности практического врача и среди других видов блокад занимают по частоте первое место. В паравертебральных пространствах проходят спинномозговые нервы, первичные ветви от нисходящей аорты и венозные сосуды. От спинномозговых нервов непосредственно у межпозвонковых отверстий отходят ветви, которые направляются к симпатическим узлам, заключающим в себе пути проведения болевой чувствительности от органов грудной и брюшной полостей. Таким образом, лекарственная смесь – ГКС и анестетики, введенная вблизи межпозвонкового отверстия в острую стадию заболевания, даже при отсутствии НПВС (при противопоказаниях к ним) обеспечивает широкий блокирующий эффект, вызывая соматическое и висцеральное обезболивание, миорелаксирующий эффект, уменьшает воспалительные явления в суставах позвоночника, значительно снижает отек и компрессию корешка (Смирнов Ю.Д., 1973; Ибатулин Н.А, 1995, 1998; Buttermann G.R., 2004).
Чаще всего по статистике остеохондроз позвоночника сопровождается раздражением или компрессией корешков L4/L5 и L5/S1. Это связано с повышенной травматизацией пояснично-крестцового диска, а также с тем, что межпозвоночное отверстие на этом уровне особенно узко (1—3 мм против 5 мм для вышележащих позвонков) и канатик здесь полностью закрывает отверстие. Устанавливая топический диагноз поражения, опытный невролог пользуется многими диагностическими критериями, чтобы блокировать область именно пострадавшего канатика (Лифенцов И.Г., 2003).
Сдавление корешка и корешкового нерва может происходить в эпидуральном пространстве (задняя протрузия диска) и межпозвонковом отверстии (фораминальная грыжа диска, уменьшение диаметра отверстия за счет сближения костных стенок). В межпозвонковом отверстии корешок занимает лишь 1/6–1/4 объема, остальное пространство заполнено кровеносными и лимфатическими сосудами, симпатическими волокнами и рыхлой соединительной тканью. Поэтому компрессия корешка в межпозвонковом отверстии возможна лишь при значительном уменьшении его размеров (абсолютное уменьшение диаметра канала при спондилолистезе или фораминальной грыже) и/или развитии воспалительного отека окружающей его клетчатки. В межпозвонковом отверстии различают медиальный отдел (так называемый боковой карман позвоночного канала), собственно канал и его латеральный отдел (Попелянский Я.Ю., 2003).
Наиболее часто выпавший диск сдавливает корешок в позвоночном канале у самого дурального мешка. Кроме грыжи диска возможны и негрыжевые факторы компрессии корешка – «негрыжевой радикулит». Такие компрессии отмечаются у 8% оперируемых, это упомянутое сдавление корешка в «боковом кармане» с частым образованием спаек, варианты с участием дегенеративных изменений суставного отростка, компрессия корешка корнем дужки, утолщенной желтой связкой, аномальными и приобретенными костными выступами позвонков. Однако при всех вариантах вертеброгенной патологии корешка клиническая картина определяется состоянием корешкового нерва, зависящего в свою очередь от степени воспалительного отека, дополнительно сдавливающего корешковый нерв (Попелянский Я.Ю., 2003).
Лечение радикулопатий включает комплексное воздействие на патологический процесс, как правило, с использованием противовоспалительных препаратов. В большинстве случаев эффективными являются покой, прием нестероидных противовоспалительных препаратов (НПВП), периферических миорелаксантов. Однако в упорных случаях или противопоказаниях к применению НПВП (сопутствующая язвенная болезнь желудка или двенадцатиперстной кишки) методом выбора является локальное введение препаратов ГКС (дипроспана) в комбинации с местными анестетиками непосредственно в зону компрессии корешка. Патогенетическим обоснованием такого подхода является воздействие на рефлекторный и воспалительный компоненты патологического процесса. Непосредственный эффект процедуры, обеспечиваемый анестетиком, свидетельствует о правильности постановки диагноза и выполнения самой инъекции, но максимальный эффект дает основного компонента смеси – ГКС (дипроспан 1мл + 2% раствор лидокаина 2-5 мл).
При правильно выбранном месте проведения паравертебральной блокады основной эффект наступает через несколько часов, и связан он с противовоспалительным действием ГКС в непосредственной близости к зоне диско-радикулярного конфликта. Выполняя подобные блокады ежедневно в первые дни острой стадии радикулопатии, невролог может добиться быстрого и стойкого эффекта, который закрепляет назначением НПВС, противоотечных, сосудистых средств, ИРТ и некоторых видов ФТЛ.
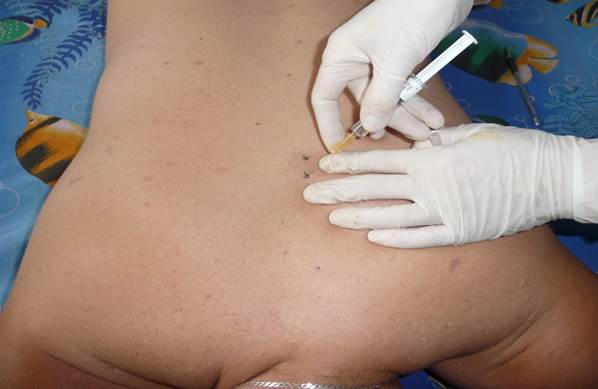
Рисунок 3. Паравертебральные блокады
Существует классический метод и его модификации, которые различаются тем, что при первом способе анестетик вводят непосредственно в паравертебральную клетчатку, а при втором — во влагалища мышц околопозвоночной области с таким расчетом, что он будет продвигаться периневрально и достигнет, в конце концов, начальных отделы передних ветвей нервов, спиномозговых корешков, соединительных ветвей и симпатических ганглиев.
Техника выполнения. Больного укладывают на живот и путем пальпации определяют место максимальной болезненности, что обычно соответствует проекции наиболее пострадавшего канатика. Используют также неврологические тесты для выбора места блокады пораженного корешка. После обработки кожи антисептиками по общепринятой методике тонкой иглой производят анестезию кожи в четырех точках, справа и слева от остистых отростков, отступая на 1,5-2 см от средней линии. Затем иглой длиной со шприцем прокалывают кожу в одной из анестезированных точек и, медленно продвигая иглу перпендикулярно к фронтальной плоскости тела и предпосылая струю, доходят до дужки позвонка. Анестетик с добавлением ГКС вводят веерообразно в краниальном, латеральном и каудальном направлениях (рис.3).
Паравертебральные блокады применяют в комплексе с другими методами лечения дистрофически-деструктивных заболеваний поясничного отдела позвоночника (мануальная терапия, медикаментозная терапия и т.д.). (Соков Е. Л., 1995; Зыкова О.В., Петрухин А.С., 2005).
|
|
|


