 |
Свойства паров. Насыщенный пар
|
|
|
|
Молекулярно-кинетическая теория позволяет не только понять, почему вещество может находиться в газообразном, жидком и твердом состояниях, но и объяснить процесс перехода вещества из одного состояния в другое.
Испарение и конденсация. Количество воды или любой другой жидкости в открытом сосуде постепенно уменьшается. Происходит испарение жидкости, механизм которого был описан в курсе физики VII класса. При хаотическом движении некоторые молекулы приобретают столь большую кинетическую энергию, что покидают жидкость, преодолевая силы притяжения со стороны остальных молекул.
Одновременно с испарением происходит обратный процесс переход части хаотически движущихся молекул пара в жидкость. Этот процесс называют конденсацией. Если сосуд открытый то покинувшие жидкость молекулы могут и не возвратиться в жидкость. В этих случаях испарение не компенсируется конденсацией и количество жидкости уменьшается. Когда поток воздуха над сосудом уносит образовавшиеся пары, жидкость испаряется быстрее, так как у молекулы пара уменьшается возможность вновь вернуться в жидкость.
Насыщенный пар. Если сосуд с жидкостью плотно закрыть, то убыль ее вскоре прекратится. При неизменной температуре система «жидкость — пар» придет в состояние теплового равновесия и будет находиться в нем сколь угодно долго.
В первый момент, после того как жидкость нальют в сосуд и закроют его, она будет испаряться и плотность пара над жидкостью — увеличиваться. Однако одновременно с этим будет расти число молекул, возвращающихся в жидкость. Чем больше плотность пара, тем большее число молекул пара возвращается в жидкость. В результате в закрытом сосуде при постоянной температуре в конце концов установится динамическое (подвижное) равновесие между жидкостью и паром. Число молекул, покидающих поверхность жидкости, будет равно числу молекул пара, возвращающихся за то же время в жидкость. Одновременно с процессом испарения происходит конденсация, и оба процесса в среднем компенсируют друг друга.
|
|
|
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Это название подчеркивает, что в данном объеме при данной температуре не может находиться большее количество пара.
Если воздух из сосуда с жидкостью предварительно откачан, то над поверхностью жидкости будет находиться только насыщенный пар.
Давление насыщенного пара. Что будет происходить с насыщенным паром, если уменьшать занимаемый им объем, например, сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем, поддерживая температуру содержимого цилиндра постоянной?
При сжатии пара равновесие начнет нарушаться. Плотность пара в первый момент немного увеличивается, и из газа в жидкость начинает переходить большее число молекул, чем из жидкости в газ. Это продолжается до тех пор, пока вновь не установится равновесие и плотность, а значит, и концентрация молекул не примет прежнее значение. Концентрация молекул насыщенного пара, следовательно, не зависит от объема при постоянной температуре.
Так как давление пропорционально концентрации в соответствии с формулой р=nkT, то из независимости концентрации (или плотности) насыщенных паров от объема следует независимость давления насыщенного пара от занимаемого им объема.
Независимое от объема давление пара P, при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара. При сжатии насыщенного пара все большая часть его переходит в жидкое состояние. Жидкость данной массы занимает меньший объем, чем пар той же массы. В результате объем пара при неизменной его плотности уменьшается.
|
|
|
Мы много раз употребляли слова «газ» и «пар». Никакой принципиальной разницы между газом и паром нет, и эти слова в общем-то равноправны. Но мы привыкли к определенному, относительно небольшому интервалу температуры окружающей среды. Слово «газ» обычно применяют к тем веществам, давление насыщенного пара которых при обычных температурах выше атмосферного (например, углекислый газ). Напротив, о паре говорят тогда, когда при комнатной температуре давление насыщенного пара меньше атмосферного и вещество более устойчиво в жидком состоянии (например, водяной пар).
 Независимость давления насыщенного пара от объема установлена на многочисленных экспериментах по изотермическому сжатию пара, находящегося в равновесии со своей жидкостью. Пусть вещество при больших объемах находится в газообразном состоянии. По мере изотермического сжатия плотность и давление его увеличиваются (участок изотермы АВ на рисунке 51). При достижении давления р0 начинается конденсация пара. В дальнейшем при сжатии насыщенного пара давление не меняется до тех пор, пока весь пар не обратится в жидкость (прямая ВС на рисунке 1). После этого давление при сжатии начинает резко возрастать (отрезок кривой СD), так как жидкости мало сжимаемы.
Независимость давления насыщенного пара от объема установлена на многочисленных экспериментах по изотермическому сжатию пара, находящегося в равновесии со своей жидкостью. Пусть вещество при больших объемах находится в газообразном состоянии. По мере изотермического сжатия плотность и давление его увеличиваются (участок изотермы АВ на рисунке 51). При достижении давления р0 начинается конденсация пара. В дальнейшем при сжатии насыщенного пара давление не меняется до тех пор, пока весь пар не обратится в жидкость (прямая ВС на рисунке 1). После этого давление при сжатии начинает резко возрастать (отрезок кривой СD), так как жидкости мало сжимаемы.
Изображенная на рисунке 1 кривая носит название изотермы реального газа.
ЗАВИСИМОСТЬ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА ОТ ТЕМПЕРАТУРЫ. КИПЕНИЕ. КРИТИЧЕСКАЯ ТЕМПЕРАТУРА
Зависимость давления насыщенного пара от температуры.
Состояние насыщенного пара приближенно описывается уравнением состояния идеального газа (3.4), а его давление приближенно определяется формулой
P=nkT
С ростом температуры давление растет. Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры.
 Однако эта зависимость P0(Т), найденная экспериментально, не является прямо пропорциональной, как у идеального газа при постоянном объеме. С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (рис. 2, участок кривой АВ).
Однако эта зависимость P0(Т), найденная экспериментально, не является прямо пропорциональной, как у идеального газа при постоянном объеме. С увеличением температуры давление насыщенного пара растет быстрее, чем давление идеального газа (рис. 2, участок кривой АВ).
Это происходит по следующей причине. При нагревании жидкости с паром в закрытом сосуде часть жидкости превращается в пар. В результате согласно формуле (P=nkT) давление пара растет не только вследствие повышения температуры, но и вследствие увеличения концентрации молекул (плотности) пара. Основное различие в поведении идеального газа и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объема при постоянной 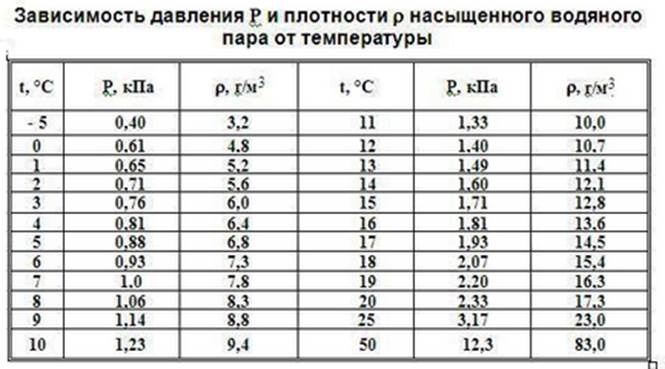 температуре) меняется масса пара. Жидкость частично превращается в пар или, напротив, пар частично конденсируется. С идеальным газом ничего подобного не происходит.
температуре) меняется масса пара. Жидкость частично превращается в пар или, напротив, пар частично конденсируется. С идеальным газом ничего подобного не происходит.
|
|
|
Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропорционально абсолютной температуре (участок ВС на рисунке 2).
Кипение. Зависимость давления насыщенного пара от температуры объясняет, почему температура кипения жидкости зависит от давления. При кипении по всему объему жидкости образуются быстро растущие пузырьки пара, которые всплывают на поверхность. Очевидно, что пузырек пара может расти, когда давление насыщенного пара внутри него немного превосходит давление в жидкости, которое складывается из давления воздуха на поверхность жидкости (внешнее давление) и гидростатического давления столба жидкости.
Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в жидкости.
 Чем больше внешнее давление, тем выше температура кипения. Так, при давлении в паровом котле, достигающем 1,6·106 Па, вода не кипит и при температуре 200°С. В медицинских учреждениях кипение воды в герметически закрытых сосудах - автоклавах (рис. 3) — также происходит при повышенном давлении. Поэтому температура кипения значительно выше 100°С. Автоклавы применяют для стерилизации хирургических инструментов, перевязочного материала и т. д.
Чем больше внешнее давление, тем выше температура кипения. Так, при давлении в паровом котле, достигающем 1,6·106 Па, вода не кипит и при температуре 200°С. В медицинских учреждениях кипение воды в герметически закрытых сосудах - автоклавах (рис. 3) — также происходит при повышенном давлении. Поэтому температура кипения значительно выше 100°С. Автоклавы применяют для стерилизации хирургических инструментов, перевязочного материала и т. д.
Наоборот, уменьшая давление, мы тем самым понижаем температуру кипения. Откачивая насосом воздух и пары воды из колбы, можно заставить воду кипеть при комнатной температуре (рис. 4). При подъеме в горы атмосферное давление уменьшается. Поэтому уменьшается температура кипения. На высоте 7134 м (пик Ленина на Памире) давление приближенно равно 4·104 Па (300 мм рт. ст.). Температура кипения воды там составляет примерно 70°С. Сварить, например, мясо при этих условиях невозможно.
|
|
|
Различие температур кипения жидкостей определяется различием в давлении их насыщенных паров. Чем выше давление насыщенного пара, тем ниже температура кипения соответствующей жидкости, так как при меньших температурах давление насыщенного пара становится равным атмосферному. Например, при 100°С давление насыщенных паров воды равно 101325 Па (760 мм рт. ст.), а паров ртути — всего лишь 117 Па (0,88 мм рт. ст.). Кипит ртуть при 357°С при нормальном давлении.
 Критическая температура При увеличении температуры одновременно с увеличением давления насыщенного пара растет также его плотность. Плотность жидкости, находящейся в равновесии со своим паром, наоборот, уменьшается вследствие расширения жидкости при нагревании. Если на одном рисунке начертить кривые зависимости плотности жидкости и ее пара от температуры, то для жидкости кривая пойдет вниз, а для пара — вверх (рис. 5).
Критическая температура При увеличении температуры одновременно с увеличением давления насыщенного пара растет также его плотность. Плотность жидкости, находящейся в равновесии со своим паром, наоборот, уменьшается вследствие расширения жидкости при нагревании. Если на одном рисунке начертить кривые зависимости плотности жидкости и ее пара от температуры, то для жидкости кривая пойдет вниз, а для пара — вверх (рис. 5).
При некоторой температуре, называемой критической, обе кривые сливаются, т. е. плотность жидкости становится равной плотности пара. Критической называется температура, при которой исчезают различия в физических свойствах между жидкостью и ее насыщенным паром.
При критической температуре плотность (и давление) насыщенного пара становится максимальной, а плотность жидкости, находящейся в равновесии с паром,— минимальной. Удельная теплота парообразования уменьшается с ростом температуры и при критической температуре становится равной нулю.
Каждое вещество характеризуется своей критической температурой. Например, критическая температура воды ≈ 375°С, а жидкого оксида углерода (IV) СО2≈З1°С.
|
|
|


