 |
Преимущества процесса «Ярсинтез»
|
|
|
|
§ Процесс одностадийный и отличается предельной простотой технологического оформления.
§ Эффективная реализация принципа «каталитической дистилляции» позволяет достигать практически 100% конверсии метанола и селективности процесса.
§ Используется катализатор, производящийся в промышленном масштабе.
§ Технология может быть адаптирована практически к любому качеству метанола.
Технология одностадийного синтеза диметилового эфира из природного газа
Одностадийный синтез ДМЭ осуществляется с использованием бифункционального катализатора, когда в реакторе идёт образование метанола с его одновременной дегидратацией в ДМЭ; далее необходима лишь стадия разделения этих продуктов с учетом значительной разницы в температуре кипения ДМЭ (-28 °С), метанола (56 °С) и воды (100 °С) эта стадия осуществляется достаточно просто – ректификацией или последовательной конденсацией.
Производство ДМЭ прямым синтезом, минуя стадию получения метанола, экономически более выгодно, т.к. характеризуется меньшими эксплуатационными и капитальными затратами даже в сравнении с производством метанола.
Предполагается, что механизм образования ДМЭ из  и
и 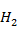 отвечает схеме последовательного восстановления оксидов углерода водородом:
отвечает схеме последовательного восстановления оксидов углерода водородом:

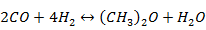
Синтез проводят при давлении около 30,0 МПа, температуре 290-400 °С в адиабатическом реакторе в присутствии катализатора СНМ-У модифицированного (разработка ГНИПИ «Химтехнология», производство ООО НПК «Алвиго-КС», г.Северодонецк, Украина). Ключевой стадией процесса химической конверсии природного газа в ДМЭ является стадия превращения метана в синтез-газ, поэтому основной акцент при разработке технологий следует сделать на поиске способа получения более дешевого синтез-газа. Кроме того, обеспечивается низкий уровень выбросов вредных веществ (NО2, SО2, СО) в атмосферу. В отличие от западных технологий конверсию синтез-газа в ДМЭ можно осуществлять без стадии ректификации. Общая рециркуляционная схема, характерная для синтеза метанола, остается без изменений.
|
|
|
Предлагаемый способ позволяет получить ДМЭ без примесей метанола. Основным аппаратом в синтезе ДМЭ служит 4-полочный реактор для экзотермических реакций, в котором на решётках уложен в четыре слоя катализатор в виде гранул размерами 5x5 мм. От синтеза метанола он отличается лишь способом размещения катализатора дегидратации метанола и циркулирующим агентом, используемым для охлаждения образующихся продуктов. Реактор предназначен для получения газообразного ДМЭ из синтез-газа, поступающего со стадии конверсии природного газа.
Температурный режим реактора поддерживают подачей холодного (байпасного) газа между слоями катализатора.
Производительность катализатора СНМ-У-модифицированного с учетом всех потерь по ДМЭ – 12-13 т/сут. Бифункциональный катализатор загружается в количестве 6,2 м3 в 4-полочную колонну синтеза ДМЭ. Распределение катализатора по слоям будет следующим: на первую полку загружается – 0,5 м3 катализатора, на вторую полку – 0,9 м3 на третью – 1,7 м3, на четвёртую – 3,1 м3.
Аппаратура процесса ректификации ДМЭ и метанола не отличается от общеизвестной ректификационной. Для ректификации используют аппараты колонного типа. Процесс обезэфиривания и предварительной ректификации осуществляют в колоннах как насадочного, так и тарельчатого типа. Колонны снабжены тарелками колпачковыми с туннельными и капсульными колпачками; ситчатыми (крупнодырчатыми), клапанными с клапанами типа «Глитч» и прямоточными клапанами. Лучше всего зарекомендовали себя ситчатые крупнодырчатые тарелки. Они просты в изготовлении и надёжны в работе. Свободное сечение тарелок по высоте колонны основной ректификации неодинаково и изменяется в пределах 6,0-8,4 %.
|
|
|
Отделение синтез-газа от циркуляционного газа осуществляется в горизонтальных или вертикальных сепараторах. При этом часть смеси ДМЭ, спиртов и воды оседает под действием гравитационных сил, а капельная и туманообразная жидкость отделяются на специально установленных в верхней части аппарата металлических сетках. [5]
Диметиловый эфир – потенциально крупнотоннажный продукт, масштабы потребления которого могут оказаться сопоставимыми с масштабами потребления бензина и дизельного топлива.
Предварительные технико-экономические расчеты специалистов показывают, что производство ДМЭ по цене может быть конкурентоспособным с производством нефтяного дизельного топлива и быть ниже цены дизельного топлива, полученного процессом Фишера-Тропша.
Спрос на данную продукцию будет расти из года в год. Причина – увеличение потребности в моторном топливе, недорогостоящем, имеющем высокоэффективные экологические показатели и сравнительно высокое качество.
2. Полный теоретический анализ избранного процесса получения ДМЭ
Для полного теоретического анализа возьмём процесс дегидратации метанола, протекающий по следующей реакции:

Производительность по метанолу (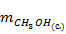 ) примем равной 100 кг/ч.
) примем равной 100 кг/ч.
Степень конверсии метанола ( ) примем равной 0,95.
) примем равной 0,95.
2.1. Стехиометрия и материальные расчеты
Рассчитаем массу продуктов реакции с учётом степени конверсии метанола
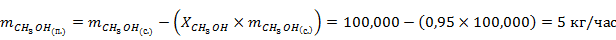
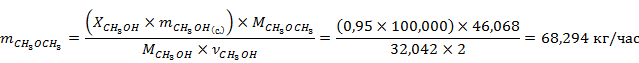
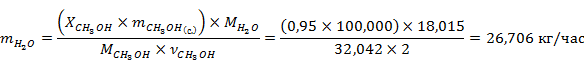
Рассчитаем количество вещества для всех компонентов реакции



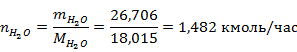
Результаты расчётов сведём в таблице 1.
Таблица 1. Сводная таблица материального баланса
| Компонент | М; кг/моль | Расход | Получено | ||
| m; кг/час | n; кмоль/час | m; кг/час | n; кмоль/час | ||
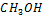
| 32,042 | 100,000 | 3,121 | 5,000 | 0,156 |
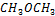
| 46,068 | 68,294 | 1,482 | ||
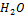
| 18,015 | 26,706 | 1,482 | ||
| Σ | 100,000 | 3,121 | 100,000 | 3,121 |
Рассчитаем селективность ДМЭ

Рассчитаем выход ДМЭ на пропущенное сырьё

2.2. Термохимический анализ процесса
Зададим температуру метанола на входе в реактор равную 150 °С (423 К). Потерями теплоты ( – в расчёте пренебрегаем и схема теплового баланса реактора будет выглядеть следующим образом:
– в расчёте пренебрегаем и схема теплового баланса реактора будет выглядеть следующим образом:
|
|
|

Выпишем в таблицу 2 термодинамические свойства компонентов при 423 К.
Таблица 2. Термодинамические свойства компонентов при 423 К
| Компонент |  ;
кДж/кмоль ;
кДж/кмоль
|  ;
кДж/кмоль×К ;
кДж/кмоль×К
| 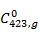 ;
кДж/кмоль×К ;
кДж/кмоль×К
|
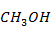
| -205528,540 | 256,483 | 53,279 |
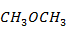
| -190117,613 | 292,778 | 82,669 |
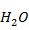
| -243070,317 | 200,488 | 34,488 |
Рассчитаем количества тепла, входящего в реактор
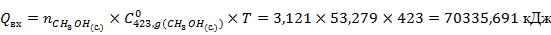
Рассчитаем тепло реакции

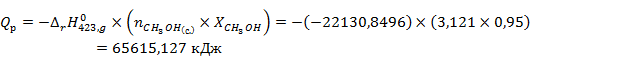
Рассчитаем количество тепла выходящего из реактора в условиях изотермы
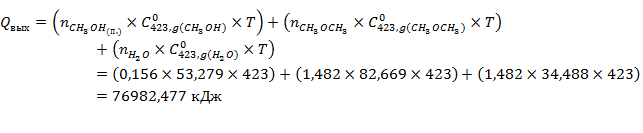
Результаты расчёта впишем в таблицу 3. По результатам расчётов можно сделать вывод о том, что данная реакция является экзотермической, следовательно необходимо организовать отвод тепла из реактора. Уравнение теплового баланса для данного процесса будет выглядеть следующим образом:

Таблица 3. Тепловой баланс процесса получения ДМЭ
| Приход; кДж | Расход; кДж | |

| 70335,691 | |

| 65615,127 | |

| 76982,477 | |

| 135950,818 | 76982,477 |

| 58968,341 | |
| Итого | 135950,818 | 135950,818 |
Рассчитаем количество тепла, требуемое для отвода

Рассчитаем перепад температур в условиях адиабат 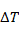 . Для этого примем температуру выхода из реактора
. Для этого примем температуру выхода из реактора 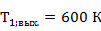 и
и  .
.
Выпишем в таблицу 4 термодинамические свойства компонентов при 600 К
Таблица 4. Термодинамические свойства компонентов при 600 К
| Компонент | 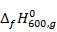 ;
кДж/кмоль ;
кДж/кмоль
|  ;
кДж/кмоль×К ;
кДж/кмоль×К
|  ;
кДж/кмоль×К ;
кДж/кмоль×К
|
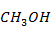
| -210622,560 | 277,525 | 67,028 |
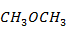
| -197066,400 | 325,641 | 105,269 |
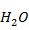
| -244764,000 | 212,966 | 36,317 |
Рассчитаем количества тепла, входящего в реактор при 

Рассчитаем тепло реакции при 

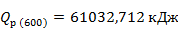
Рассчитаем количество тепла выходящего из реактора при 
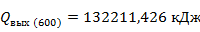
Выпишем в таблицу 5 термодинамические свойства компонентов при 700 К
Таблица 5. Термодинамические свойства компонентов при 700 К
| Компонент |  ;
кДж/кмоль ;
кДж/кмоль
|  ;
кДж/кмоль×К ;
кДж/кмоль×К
|  ;
кДж/кмоль×К ;
кДж/кмоль×К
|
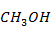
| -212881,920 | 288,361 | 73,722 |
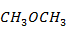
| -199953,360 | 342,711 | 116,148 |
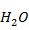
| -245642,640 | 218,656 | 37,447 |
Рассчитаем количества тепла, входящего в реактор при 

Рассчитаем тепло реакции при 
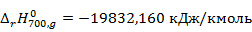
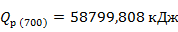
Рассчитаем количество тепла выходящего из реактора при 

Построим график зависимости выходящего тепла из реактора от температуры выхода

Рассчитаем температуру выхода из реактора, основываясь на полученном уравнении
|
|
|

где 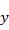 – количество тепла, выходящего из реактора (135950,818 кДж);
– количество тепла, выходящего из реактора (135950,818 кДж);  – температура выхода, при данном количестве тепла (
– температура выхода, при данном количестве тепла (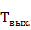 ; К).
; К).
Выразим  из полученного уравнения и найдём температуру выхода
из полученного уравнения и найдём температуру выхода
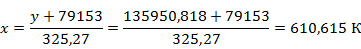
Рассчитаем перепад температур

Вывод: так как перепад температур составил более 100 К, то для проведения данного процесса необходимо предусмотреть отвод тепла из зоны реакции. Для этого конструкция реактора должна содержать либо змеевик, по которому прокачивается хладагент, расположенный в зоне реакции, либо водяную рубашку на корпусе реактора.
2.3. Качественный и количественный термодинамический анализ
Энтальпийный эффект реакции при 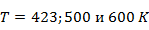 равен
равен



Рассчитаем энтропийный эффект реакции по закону Гесса при 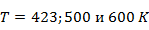
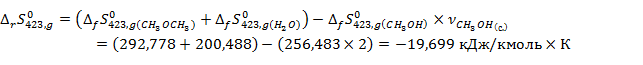
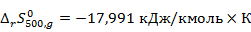

По вычисленным данным произведём графический анализ зависимости энтальпийных и энтропийных эффектов от температуры
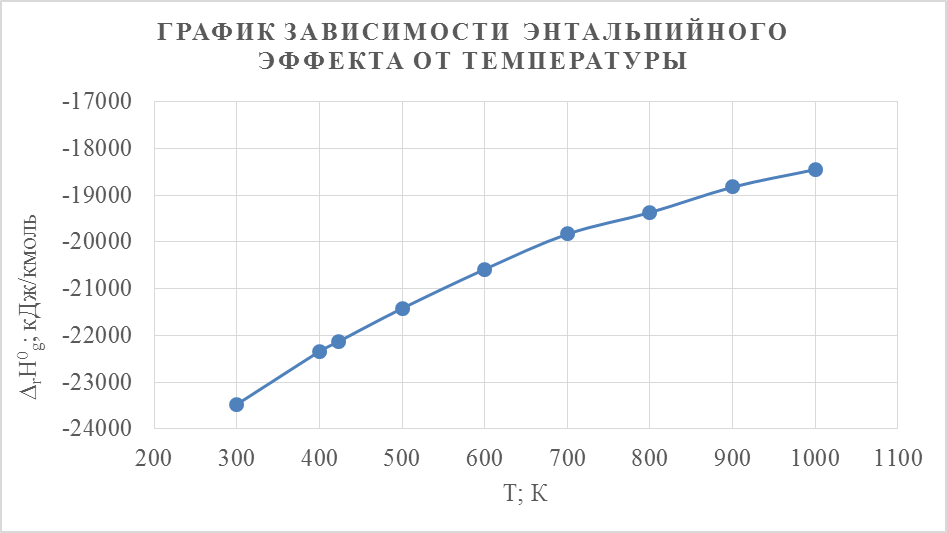

Вывод: повышение температуры способствует увеличению энтальпийного и энтропийного эффектов.
Рассчитаем константы равновесия при 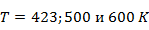

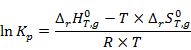
где  =8,314
=8,314 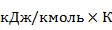 – универсальная газовая постоянная.
– универсальная газовая постоянная.




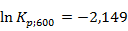

По полученным значениям построим график зависимости константы равновесия от температуры
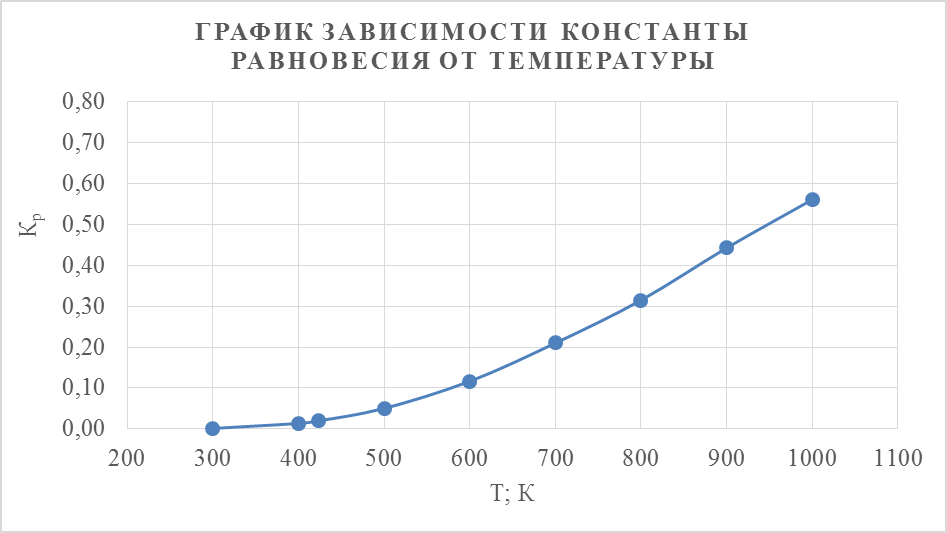
Вывод: с увеличением температуры константа равновесия увеличивается.
Рассчитаем термодинамическую возможность осуществления процесса по уравнению изотермы химической реакции

Так как  , то реакция протекает самопроизвольно и не имеет термодинамических ограничений.
, то реакция протекает самопроизвольно и не имеет термодинамических ограничений.
Рассчитаем равновесный состав
| Компонент | Мольные количества | Мольная доля в равновесной смеси | |
| Исходная смесь | Продукты реакции | ||
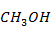
| 
| 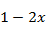
| 
|
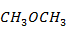
| 
| 
| 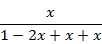
|
| 
| 
| 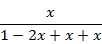
|
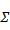
| 
| 
|
По закону Дальтона парциальное давление 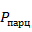 i-того компонента равно произведению мольных долей компонентов на
i-того компонента равно произведению мольных долей компонентов на 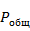 в системе
в системе
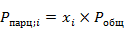

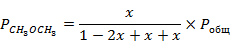

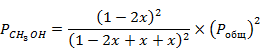
Для дальнейшего расчёта примем давление в системе  .
.

Подставим значение константы равновесия при 423 К в данное выражение и найдём 

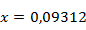
Равновесная степень превращения равна  или
или 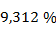 .
.
Рассчитаем мольную долю компонентов в равновесной смеси



Выполним проверку произведённого расчёта

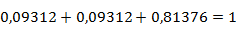
2.4. Качественный и количественный кинетический анализ
Реакция получения диметилового эфира протекает по радикально-цепному механизму
I-я стадия (инициирование):
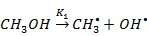
II-я стадия (рост цепи):



III-я стадия (обрыв цепи):

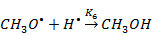
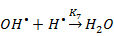
Составим кинетическую модель процесса (для упрощения возьмём только реакции 1; 2; 5). Целевым продуктом является ДМЭ, запишем уравнение для скорости реакции
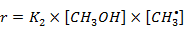
Примем 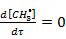 и запишем уравнение
и запишем уравнение

Из полученного уравнения выразим 

Подставим полученное выражение в уравнение для скорости реакции по целевому продукту
|
|
|

Рассчитаем константу скорости реакции при различных температурах
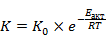
Для дальнейшего расчёта примем предэкспоненциальный множитель 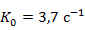 и энергию активации
и энергию активации 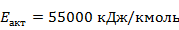 .
.
При температуре 700 К константа скорости реакции равна
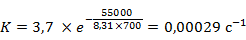
Аналогичным образом рассчитаем  для других температур и построим график зависимости константы скорости реакции от температуры.
для других температур и построим график зависимости константы скорости реакции от температуры.
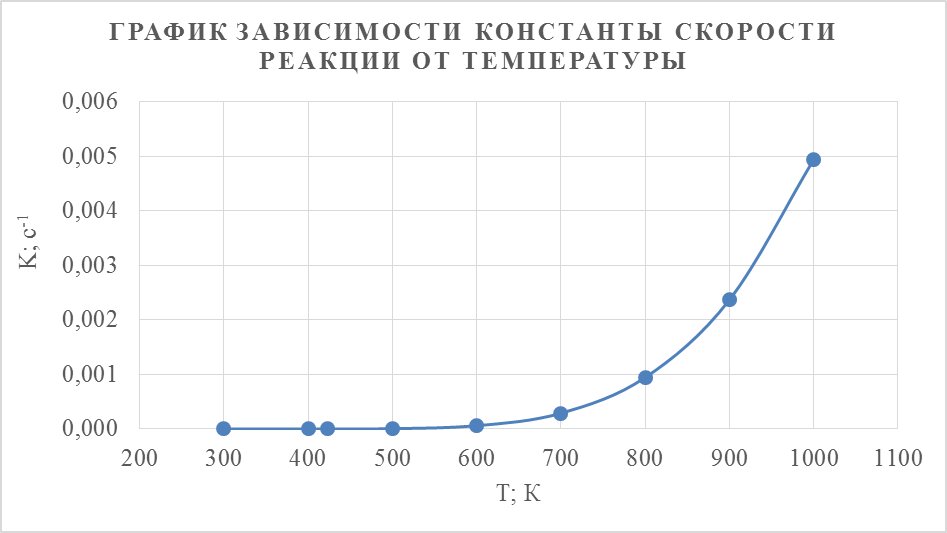
Из полученного графика видно, что с увеличением температуры константа скорости реакции увеличивается.
3. Рекомендации по условиям осуществления избранного процесса
Произведённый расчёт подтвердил возможность получения диметилового эфира путём дегидратации метанола при температуре 423 К и атмосферном давлении. Данная реакция протекает самопроизвольно и не имеет термодинамических ограничений. Так как перепад температур на входе в реактор и на выходе из реактора составил более 100 К, то для проведения данного процесса необходимо предусмотреть отвод тепла из зоны реакции.
Для проведения данного процесса можно предложить технологическую схему описанную в пункте 1.2 данной работы (получение ДМЭ по технологии «Ярсинетз») с добавлением водяной рубашки к реакционно-ректификационному аппарату К-10 в районе реакционной зоны для отвода тепла из зоны реакции.

Литература
1. Диметиловый эфир [Электронный ресурс]. www.xumuk.ru: Сайт о химии – Режим доступа: http://www.xumuk.ru/encyklopedia/1345.html (дата обращения: 14.06.2015).
2. Эфир диметиловый жидкий [Электронный ресурс]. http://n-azot.ru – Режим доступа: http://n-azot.ru/product.php?product=80&lang=RU (дата обращения: 14.06.2015).
3. Производство ДМЭ в Щекино: первое в России [Электронный ресурс]. Щекинский химик – информационно-аналитический сайт газеты города Щекино – Режим доступа: http://gazetahimik.ru/manufacture/schekino-news/12544.html (дата обращения: 14.06.2015).
4. В поисках ДМЭ [Электронный ресурс]. http://info.tatcenter.ru: Деловой центр республики Татарстан – Режим доступа: http://info.tatcenter.ru/print/41938/ (дата обращения: 14.06.2015).
5. Савенкова И.В., Михайлова Ю.Ю. Технология одностадийного синтеза диметилового эфира из природного газа. Вестник АГТУ. 2008. №6 (47). Стр. 145-146
|
|
|


