 |
Физическая и коллоидная химия.
|
|
|
|
Фотохимические реакции
Вопросы для самопроверки
1. Какие реакции называются фотохимическими? Какими количественными закономерностями описываются эти процессы?
2. В чем сущность фотосинтеза? Какова роль хлорофилла в этом процессе? Из каких стадий состоит фотохимический процесс?
3. Что такое квантовый выход?
4. в чем сущность закона Гротгуса? Как количество прореагировавшего при фотосинтезе вещества зависит от мощности света и от времени облучения растения?
5. В чем сущность закона фотохимической эквивалентности Эйнштейна?
Решение типовой задачи
На основании анализа установлено, что сахарная свекла на 1 га в день дает привес биомассы 80 кг. Считая, что в этом количестве 30% углерода, рассчитайте сколько литров СО2 усвоено растением и сколько кислорода при этом выделено?
Решение. Задача решается в предположении, что весь углерод поступает в растение при фотосинтезе:
6СО2+6Н2О=С6Н12О6+6О2
Рассчитаем, сколько углерода поглотилось:

Так как 1 кмоль составляет 12 кг С, то 2 кмоль – 24 кг. Из уравнения фотосинтеза следует, что 6 кмоль углекислого газа СО2 содержит 6 кмоль углерода и при его ассимиляции выделяется 6 кмоль О2. Если у нас имеется 2 кмоля С, значит столько же кмолей СО2 и О2. Из закона Авогадро следует, что 1 кмоль газа занимает объем 22,4 м3. Таким образом, было поглощено 22,4·2=44,8 м3 СО2 и выделилось 44,8 м3 О2.
ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
55-60. Рассчитайте объем кислорода, выделившегося при фотосинтезе, и объем поглощенного углекислого газа, если дан привес биомассы при фотосинтезе и предполагается (упрощено), что привес биомассы обусловлен образованием глюкозы.
| № задачи | привес биомассы на 1 га/день, кг | % сухого вещества в биомассе |
|
|
|
Химическое равновесие
Вопросы для самопроверки
- Дайте вывод выражения для константы химического равновесия на основе закона действия масс. В качестве примера используйте гомогенный N2+3Н2=2NН3 и гетерогенный процессы 2С+ О2=2СО.
- Каков физический смысл константы равновесия? Какие факторы влияют на величину константы равновесия?
- Что такое обратимый процесс и необратимый процесс с термодинамической и кинетической точек зрения?
- Что такое смещение равновесия?
- Какие факторы влияют и какие не влияют на положение равновесия?
- Сформулируйте принцип Ле-Шателье.
- Укажите, как смещается равновесие при увеличении (уменьшении) давления, температуры, концентрации исходных веществ для реакций:
СО2+СаСО3+ Н2О(пар)→ Са(НСО3)2 + Q
СаСО3→ СО2+ СаО – Q
Са(ОН)2+ СО2 →СаСО3 + Н2О (пар) + Q
СаО+ Н2О (пар) →Са(ОН)2+ Q
6СО2+6Н2О=С6Н12О6+6О2 – Q
- как нужно изменить условия (давление, температуру, концентрацию веществ), чтобы увеличить выход аммиака реакции N2+3Н2=2NН3 98+кДж/моль?
- Как связана константа равновесия процесса с изменением изобарно-изотермического потенциала реакции?
Решение типовых задач
- Вычислите равновесные концентрации водорода и иода при температуре 600˚К и реакции J2+Н2=2НJ, если их начальные концентрации составляют 0,03 моль/л. А равновесная концентрация иодистого водорода равна 0,04 моль/л. Найти константу равновесия и величину изобарно-изотермического потенциала реакции при этой температуре.
Решение. На образование двух молей JН в соответствии с уравнением J2+Н2=2НJ идет один моль J2, поэтому для образования 0,04 моля НJ требуется 0,02 моля Н2 и 0,02 моля J2, отсюда их равновесные концентрации составляют 0,03-0,02=0,01 моля.
Для расчета константы равновесия после написания выражения в общем виде подставим в это выражение численные данные:
|
|
|

Далее рассчитываем изменение изобарно-изотермического потенциала этого процесса, используя связь величины ∆G и К.
∆G = -RT ln K = -2,303 RT lg K
∆G= -2,303·8,313·600·lg 16=-2,303·8,313·600·1,204=-13830 Дж/моль=-13,830 кДж/моль.
Итак, равновесные концентрации водорода и иода равны 0,01 моль/л, константа равновесия равна 16, величина изобарно-термического потенциала равна -15,798 кДж/моль.
- Найти константу равновесия при температуре 25˚С реакции:
С2Н2 (газ) +2Н2 (газ) = С2Н6 (газ),
Если ∆Н˚ = -324,2 кДж/моль и ∆S˚ = -10,22 Дж/к·моль
Решение. Связь между константой равновесия в стандартных условиях и стандартным изобарно – термическим потенциалом реакции выражается уравнением ∆G = -RT ln K.
∆G˚= -2,3·8,3·293·lg К (1)
Стандартный изобарный потенциал связан со стандартными значениями энтальпии и энтропии реакции соотношением:
∆G˚ = ∆Н˚ - Т∆S˚ (2)
Найдем величину изобарно – изотермического потенциала по уравнению (2) из данной задачи, переводя ∆Н˚ в джоули.
∆G˚= -324200-298·(-10,22)= -327245 Дж/моль
Теперь, пользуясь найденным значением и уравнением (1), рассчитаем lg К кДж/моль:
lgK=  =+0,0575
=+0,0575
Используя таблицу антилогарифмов, находим значение К;
К= 1,139.
ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
61-65. Какова связь между константой равновесия и изобарным потенциалом реакции? Найдете константу равновесия реакций при стандартной температуре (298˚К) по данным таблицы:
| № задачи | Реакции | реакции кДж/моль | реакции Дж/моль·град. |
| N2+3Н2=2NН3 | -92,45 | -198,45 | |
| 2NO2=N2O4 | 58,07 | -176,14 | |
| H2CO3→H+ + HCO- 3 р-р р-р р-р | 7,46 | -99,47 | |
| 2Н2+О2=2Н2О (г) | 483,04 | -88,76 | |
| S +О2 = SO2 | -292,9 | 25,15 |
66-70. Для реакции, соответствующей номеру вашего шифра, выполните следующее задание:
1. Сформулируйте принцип Ле-Шателье.
2. Определите, как влияют изменения давления на положение равновесия реакции.
Составьте выражение для константы равновесия и вычислите ее значение. Равновесные концентрации реагирующих веществ (с, моль/л) приведены под соответствующими химическими формулами в уравнении реакции.
| № задачи | с, моль/л | реакция |
| с | N2+3Н2=2NН3 3 9 4 | |
| с | Н2+J2=2HJ 0,01 0,01 0,04 | |
| с | CO2 + Н2→СО + Н2О 0,04 0,64 0,16 0,16 | |
| с | 2SО2 +О2 =2 SO3 0,1 0,05 0,9 | |
| с | 2NO+ О2=2NO2 0,24 0,12 0,06 |
Растворы неэлектролитов
|
|
|
Вопросы для самопроверки
- Что такое раствор? В чем отличие растворов от химических соединений?
- Рассчитайте процентную, молярную и моляльную концентрации раствора, полученного смешением 1 г NaCI и 100 г H2O (плотность раствора примите равной 1).
- Укажите возможные виды взаимодействия между компонентами в растворе.
- В чем сущность физической теории растворов? В чем ее отличие от сольватной теории?
- Что называется осмосом? Каков его механизм? Каково его биологическое значение?
- В чем выражается аналогия между осмотическим давлением и давлением газов?
- Какие растворы называются изотоническими, гипертоническими, гипотоническими? Рассчитайте процентную концентрацию раствора глюкозы, изотонического с кровью (осмотическое давление крови равно 7,3 атм., плотность раствора примите равной 1).
- Используя кривые зависимости (давление водяных паров – температура для воды, водных растворов и льда), поясните, почему растворы замерзают при более высокой температуре, чем вода.
- На основе представлений об осмотическом давлении поясните, почему растения не могут существовать на засоленных почвах.
- Какой из трех приведенных растворов замерзает при более низкой температуре: содержащий в 1 л воды 18 г глюкозы, 18 г формальдегида или 18 г поваренной соли? Дайте ответ, не вычисляя значений температур замерзания.
- Что такое криоскопия, эбуллиоскопия? Рассчитайте молекулярную массу моносахарида, если при растворении 1,8 г его в 1 л воды температура замерзания полученного раствора понизилась на 0,186°.
Решение типовых задач
- Вычислить осмотическое давление раствора глицерина, содержащего 0,46 г в 100 мл раствора при 20°С.
Решение. По закону Вант-Гоффа Росм=CRT, где С – концентрация вещества в молях на литр раствора (молярная); R – универсальная газовая постоянная R=8,31  ;
;
Т – абсолютная температура;
Росм – осмотическое давление раствора.
Молярная концентрация С определяется из соотношения:
С=  ,
,
Где n– число молей растворенного вещества в данном объеме раствора;
g - вес растворенного вещества в граммах;
|
|
|
V- объем раствора в литрах;
M - молекулярная масса растворенного вещества;
Тогда:
Росм =  , Росм =
, Росм = 
Росм = 121,7 Па = 1,2 атм
2. Раствор, содержащий 0,48 г глицерина на 25 г воды, замерзает при температуре -0,387  . Вычислить молекулярную массу глицерина и осмотическое давление раствора при 0
. Вычислить молекулярную массу глицерина и осмотическое давление раствора при 0  .
.
Решение.
А) Определение молекулярного веса глицерина.

где К - криоскопическая константа, равная для водных растворов 1,86  ;
;
m = моляльная концентрация (моль/1000 г растворителя);
m= 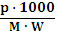 ,
,
где – р – вес растворенного вещества в граммах;
W – вес растворителя в граммах;
М - молекулярная масса вещества;


M=  , М = 92.
, М = 92.
Б) Определение осмотического давления.
Осмотическое давление раствора вычисляется с помощью уравнений:
Росм=CRT и 
Для разбавленных водных растворов С = m =  ,
,
Росм=  , Росм= 12,04
, Росм= 12,04  ,
,
Росм= 12,04  0,387=4,67 атм.
0,387=4,67 атм.
|
|
|


