 |
Методика и порядок выполнения работы
|
|
|
|
Исходные данные для расчетов:
– скорость фильтрования wф= 5м/ч;
– интенсивность взрыхляющий промывки i = 10 л/(см2);
- грязеемкостъ загрузки (контрольная) gг = 2 кг/м3 =2 мг/см3;
– продолжительность взрыхляющей промывки  =20 мин.
=20 мин.
Основные режимные характеристики процесса:
– объем промывной воды
Vвзр =(60 i fk t взр)/1000, м3;
– расход взрыхляющей воды
gвзр = (Vвзр 103)/  , мл/мин;
, мл/мин;
– расход фильтрующей воды через фильтр
gф = (Wф fk 106) /60, мл/мин;
– количество загрязнений, вводимых в исследуемую воду
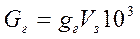 , г;
, г;
– объем фильтруемой воды (сравнивается с опытными данными)
VФ = (Gг 106)/Сг, мл;
– время фильтрации исследуемой воды
 ф=(Vф 60)/(Wф fф 106), мин.
ф=(Vф 60)/(Wф fф 106), мин.
Содержание отчета и его форма
Отчет по выполняемой работе должен содержать следующее:
• краткое описание основных положений теории осветления
фильтрованием;
• описание экспериментального стенда;
• результаты расчетов основных режимных характеристик процесса осветления воды фильтрованием
Вопросы для защиты работы
1. Сущность технологии фильтрации.
2. Основные технологические параметры процесса фильтрации воды.
3. Устройство опытного стенда.
Практическое занятие № 6
ИОНООБМЕННЫЙ МЕТОД УМЯГЧЕНИЯ ВОДЫ
6.1 Цель и содержание
Опытное определение технологических показателей ионообменного способа очистки при различных режимных факторах и установление их взаимной зависимости.
Теоретическое обоснование
Сущность процесса ионообмена заключается в обмене ионами в эквивалентных количествах между исходной водой (раствором) – сорбатом и твердым веществом – ионитом (сорбентом).
В практике очистки различных вод используют иониты, раздельно поглощающие как катионы, так и анионы. Первые называюткатионитами, а вторые – анионитами, соответственно и протекающие процессы – катионированием и анионированием.
|
|
|
В качестве катионитов на практике широко используют сульфоуголь и синтетическую смолу марки КУ-2-8, а в качестве анионитов – АВ-17-8, АН-18 и др.
Рассматриваемый процесс ионообмена обуславливается, в основном, следующими обстоятельствами: во-первых, практически все растворенные в воде неорганические соли, щелочи и кислоты в большей степени диссоциированы на ионы – на катионы кальция (Са2+), магния (Mg2+), натрия (Na+) и др., и анионы – бикарбонаты (HCO3–), хлориды (Cl–), сульфаты (SO42–) и др. и, во-вторых, способностью ионитов к ионному обмену с ионами, находящимися в воде. Любой ионит состоит из твердой основы, не растворимой в воде в виде молекулярной сетки, называемой матрицей. К ее поверхности и внутри ее массы тем или иным способом присоединены химически активные специальные функциональные группы атомов, способные к электролитической диссоциации в воде.
Технология процесса катионирования в практике водоочистки применяется для умягчения воды и в технологии ее обессоливания.
При Na- катионировании вода пропускается через слой катионита, загруженного в цилиндрический вертикальный сосуд, называемый фильтром, и предварительно заряженного в Na- форму концентрированным раствором натриевой соли. В результате соприкосновения воды с зернами катионита происходит процесс ионообмена между катионами Са 2+ и Mg2+ солей жесткости, находящихся в воде, и катионами Na +, находящимися в диффузионном слое гидратной оболочки каждого зерна катионита. Первые (Са 2+ и Mg2+), адсорбируясь в отмеченной оболочке, вытесняют из нее в эквивалентном количестве катионы Na+. Схему такого катионного обмена можно представить реакциями:
Са2++2Na+IR–→ Са2+ IR2– + 2Na+;
Mg2++ 2Na+IR–→ Mg2+ IR–+2Na+,
где R – обозначение радикала твёрдого катионита.
|
|
|
В результате такого катионного обмена воду можно умягчить до остаточной жесткости 5 мкг экв/л.
Этот процесс будет наблюдаться до проскока жесткости выше установившейся величины. В этом случае фильтр отключается, и катионит подвергается восстановлению, т.е. регенерации концентрированым раствором натриевых солей (например, NaCl).
При регенерации протекает обратная реакция катионного обмена:
Са2+ IR2–+2Na++Cl–→2Na+IR–+ Са2++ Cl–;
Mg2+ IR2–+2Na++Cl–→2Na+IR–+ Mg2++ Cl–.
Образовавшиеся продукты регенерации соли хлористого кальция и магния являются высокорастворимыми, и они отводятся с отработанными регенерационными водами в водоотводящую систему.
Процесс регенерации истощённого катионита осуществляется последовательно тремя операциями:
· взрыхление катионита;
· пропускание регенерационного раствора;
· отмывка катионита.
Взрыхление катионита осуществляется путем пропускания взрыхляющей воды через фильтр снизу вверх с целью его разрыхления, удаление мелочи (механически разрушенных зёрен катионита) и грязи, скопившейся на слое катионита в результате фильтрации умягченной воды. Взрыхление осуществляется до момента осветления воды, но дольше 15 минут.
Ввод регенерационного раствора с нормативной концентрацией в нем натриевой соли осуществляется сверху вниз с определенной нормативной скоростью фильтрации и предварительно рассчитанным объемом, в котором количество растворенной натриевой соли обеспечит полное восстановление катионита в форме Na +.
Отмывка катионита после регенерации осуществляется для удаления из слоя катионита продукта регенерации и избытка регенерационной соли.
Важнейшей технологической характеристикой ионитов (в том числе и катионита) является их обменная емкость. Она выражает количество ионов, которые могут быть поглощены единицей массы (г экв/кг)или единицей объема (г экв/м)ионита. Различают полную обменную и рабочую (до проскока жесткости). В практике эксплуатации фильтров используется рабочая обменная емкость.
Обменная емкость зависит от многих факторов:
– марка ионита;
– фракционный состав ионита;
– катионный и анионный состав очищаемой воды, ее солесодержание и величина рН;
– удельный расход регенерационного реагента;
|
|
|
– высота фильтрующего слоя катионита;
– скорость фильтрования очищаемой воды.
Три последних фактора нормируются определенными величинами, установленными длительным опытом эксплуатации водоподготовительных установок. Удельный расход регенерационного реагента обеспечивает интенсивность и полноту восстановительного ионообмена, а два последних фактора – продолжительность контакта очищаемой воды с зернами ионита.
Аппаратура и материалы
Экспериментальный стенд, схема приведена на рисунке 6.1.
Насосы-дозаторы.
Секундомер.
Стол титровальный с бюретками.
Весы аналитические с разновесами.
рН-метр.
Солемер.
Ионообменные смолы: катиониты и аниониты.
Реагенты: NaCl; CaCl2 или MgCl2; набор водоподготовщика.
Схема экспериментальной установки приведена на рисунке 6.1. Она состоит из двух колонок 7, одна из которых загружена сильнокислотным катионитом 2 марки КУ–2, а другая – сульфоуглем марки СМ–1. Каждая колонка имеет дренажную систему 3 из пористого материала и запорно-регулирующие краны 4, 7, 5, 9. Верхней частью каждая колонка при помощи штуцера 5, вставленного в резиновую пробку 6 колонки, и резинового шланга 10 может быть подсоединена к дозатору 11 регенерационного раствора или к сосуду 13 взрыхляющей отмывочной или умягчаемой воды. Отбор проб исследуемой воды производится в мерную посуду 12. Колонки могут работать как индивидуально, так и последовательно в зависимости от поставленной задачи. В последнем случае кран 4 первой колонки шлангом соединяется с верхним штуцером 5 второй колонки.
Скорость пропускания регенерационного раствора и отмывочной водырегулируется степенью открытия крана 3. Скорость пропускания исходной воды при ее умягчении регулируется либо так же степенью открытия крана 3, либо, при наличии насоса, изменением его производительности. Расходы раствора и воды контролируются объемным способом при помощи мерного сосуда и секундомером.
Характеристики колонок:
– внутренний диаметр колонки dK= 16 мм;
– площадь сечения колонки fK= 2•10–4 м2;
|
|
|
– объем загрузки катиона в колонке VK= 6•10–6 м3;
- высота загрузки катионита в колонке Нсл= 3•10–2 м.
Химический состав исходной воды определяется химическим анализом,
т. е. ее показателями: жесткостью (Жо) и щелочностью (Що).

Схема регенерации фильтра Схема умягчения воды
Рисунок 6.1
|
|
|


