 |
Основные типы электродов и гальванических элементов.
|
|
|
|
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Сейчас широко распространены следующие гальванические элементы:
| Тип | ЭДС (В) | Достоинства |
| угольно-цинковые (солевые) | 1,5 | дешёвые |
| щелочные (жаргонное название — алкалиновые) | 1,6 | высокий ток, ёмкие |
| никельоксигидроксидные (NiOOH) | 1,6 | высокий ток,очень ёмкие |
| литиевые | 3,0 | очень высокий ток, очень ёмкие |
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
Zn | ZnSO4 || CuSO4 | Cu,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || - солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu
Левый электрод: Zn2+ + 2e = Zn
Общая реакция: Cu2+ + Zn = Cu + Zn2+
Типы гальванических элементов window.top.document.title = "7.4.1. Типы гальванических элементов";
Концентрационные элементы состоят из одинаковых электродов, отличающихся активностями потенциалопределяющего иона  ЭДС этих элементов обычно очень мала. Концентрационные элементы используются при определении pH и концентраций труднорастворимых солей.
ЭДС этих элементов обычно очень мала. Концентрационные элементы используются при определении pH и концентраций труднорастворимых солей.
|
|
|
В топливных гальванических элементах (электрохимических генераторах) процесс окисления некоторых видов топлива используется для непосредственного получения электрической энергии. Основным их преимуществом является принципиальная возможность достижения очень высоких КПД использования топлив.
В щелочном водородно-кислородном топливном элементе

|
где M1 и M2 – проводники первого рода, в основном серебро, металлы платиновой группы и некоторые другие, играющие роль катализаторов электродных процессов и токоотводов, на аноде идет реакция

|
а на катоде –
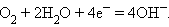
|
Суммарный процесс соответствует реакции горения водорода:
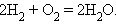
|
Батарея топливных элементов с устройствами для подвода топлива и окислителя, вывода продуктов реакции, поддержания и регулирования температуры, называется электрохимическим генератором. Кислородно-водородные генераторы применяются на космических кораблях. Они обеспечивают космический корабль и космонавтов не только энергией, но и водой, которая является продуктом реакции в топливном элементе.
Аккумуляторами называются обратимые гальванические элементы многоразового действия. При пропускании через них электрического тока (зарядке) они накапливают химическую энергию, которую потом при их работе (разрядке) отдают потребителю в виде электрической энергии. Наиболее распространены два вида аккумуляторов: кислотный (свинцовый) и щелочные.
Анод заряженного свинцового аккумулятора состоит из свинца, катод – из диоксида свинца. Металлический тип проводимости PbO2 делает его пригодным для работы в качестве электрода. Электролитом служит раствор H2SO4 (32–39 %), в котором PbSO4 и PbO2 малорастворимы.
Схему аккумулятора можно изобразить так:
|
Анодный процесс работающего аккумулятора
|
|
|
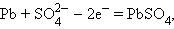
|
катодный процесс –

|
Таким образом, в свинцовом аккумуляторе осуществляется реакция

|
При зарядке протекает обратная реакция и электроды меняют свои функции: катод становится анодом, а анод – катодом. ЭДС свинцового аккумулятора зависит от отношения активности кислоты и воды:

|
В процессе работы аккумулятора концентрация кислоты падает, а следовательно, падает и ЭДС. Когда ЭДС достигает 1,85 В, аккумулятор считается разрядившимся. При более низкой ЭДС пластины покрываются тонким слоем PbSO4 и и аккумулятор разряжается необратимо. Во избежание этого аккумулятор периодически подзаряжают.
В заряженном щелочном железо-никелевом аккумуляторе анодом служит железо, катодом – гидроксид никеля (III), электролит – 20%-й раствор KOH:
|
При работе аккумулятора на аноде происходит окисление железа:

|
на катоде – восстановление гидроксида никеля (III):

|
Суммарная активность процесса:

|
В уравнении Нернста для данного аккумулятора под знаком логарифма стоят не концентрации, а произведения растворимости ПР участвующих в этой реакции труднорастворимых веществ:

|
ЭДС щелочного аккумулятора не зависит от концентрации щелочи, поскольку в выражение под знаком логарифма входят постоянные величины.
Аналогично работают щелочные кадмий-никелевый и серебряно-цинковый аккумуляторы:

|
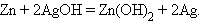
|
Водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал платины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
|
|
|
2Н+ + 2e− = H2
 то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Схема стандартного водородного электрода:
1. Платиновый электрод.
2. Подводимый газообразный водород.
3. Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.
4. Водяной затвор, препятствующий попаданию кислорода воздуха.
5. Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Хлорсеребряный электрод (ХСЭ) благодаря стабильности потенциала и простоте конструкции является одним из наиболее часто употребляемых в лабораторной практике электродов сравнения. Представляет собой серебряную пластинку или проволочку, покрытую слоем малорастворимой соли серебра (обычно - хлорида) и опущенной в насыщенный раствор хлорида калия. Схематически записывается как: Ag|AgCl|KCl|Cl−.
Потенциалоопределяющим для такого электрода является анион хлорида в равновесии: AgCl(s) ↔ Ag+ + Cl−
При 25 °С потенциал насыщенного ХСЭ составляет 0,222 В[1].
ЭЛЕКТРОДЫ СРАВНЕНИЯ, электрохим. системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения абс. величины потенциала отдельного электрода. В принципе в качестве электрода сравнения может служить любой электрод в термодинамически равновесном состоянии, удовлетворяющий требованиям воспроизводимости, постоянства во времени всех характеристик и относит, простоты изготовления. Для водных электролитов наиб, часто применяют в качестве электродов сравнения водородный, каломельный, галогеносеребряные, оксидно-ртутный и хингидронный электроды.
Водородный электрод сравнения представляет собой кусочек платиновой фольги или сетки, покрытый слоем электролитич. Pt и погруженный частично в р-р, через к-рый пропускают Н2. При адсорбции на электроде образуются адсорбир. атомы Надс. Электродные р-ции на водородном электроде сравнения описываются ур-ниями: Н2  2Надс
2Надс 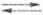 2Н+ + 2е (е - электрон). Водородный электрод при давлении водорода рН2 равном 1 атм (1,01 х 105 Па), термодинамич. активности ионов водорода в р-ре аН+, равной 1, наз. стандартным водородным электродом, а его потенциал условно принимают равным нулю. Потенциалы других электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов (см. Стандартный потенциал). Для водородного электрода сравнения Нернста уравнение записывается в виде:
2Н+ + 2е (е - электрон). Водородный электрод при давлении водорода рН2 равном 1 атм (1,01 х 105 Па), термодинамич. активности ионов водорода в р-ре аН+, равной 1, наз. стандартным водородным электродом, а его потенциал условно принимают равным нулю. Потенциалы других электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов (см. Стандартный потенциал). Для водородного электрода сравнения Нернста уравнение записывается в виде:
|
|
|

где Т - абс. т-ра; F - постоянная Фарадея; R - газовая постоянная. При рН2 = 1 атм электродный потенциал

Используется в широком диапазоне рН - от значений, соответствующим конц. к-там, до значений, соответствующим конц. щелочам. Однако в нейтральных р-рах водородный электрод сравнения может нормально функционировать лишь при условии, что р-р обладает достаточно хорошими буферными св-вами (см. Буферный раствор). Это связано с тем, что при установлении равновесного потенциала на платинированной платине, а также при пропускании тока через водородный электрод сравнения появляется (или исчезает) нек-рое кол-во ионов Н+, т. е. изменяется рН р-ра, что особенно заметно в нейтральных средах. Водородный электрод применяют в широком интервале т-р, отвечающем существованию водных р-ров. Следует, однако, учитывать, что при повышении т-ры парциальное давление водорода падает вследствие роста давления паров р-рителя и обусловленное этим изменение потенциала электрода сравнения соответствует ур-нию
 , где р - барометрич. давление (в кПа), a ps - суммарное давление насыщ. паров над р-ром (кПа). Возможность использования водородного электрода в орг. средах требует спец. проверки, т. к. Pt может катализировать процессы с участием орг. соед., вследствие чего нарушается равновесие электродной р-ции и электрод приобретает стационарный потенциал, отличный от равновесного.
, где р - барометрич. давление (в кПа), a ps - суммарное давление насыщ. паров над р-ром (кПа). Возможность использования водородного электрода в орг. средах требует спец. проверки, т. к. Pt может катализировать процессы с участием орг. соед., вследствие чего нарушается равновесие электродной р-ции и электрод приобретает стационарный потенциал, отличный от равновесного.
Каломельный электрод сравнения изготавливают, используя ртуть и р-ры каломели в хлориде калия. Электродная р-ция на этом электроде отвечает ур-нию: 2Hg + 2Сl- 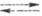 Hg2Cl2, а соответствующее ур-ние Нернста имеет вид:
Hg2Cl2, а соответствующее ур-ние Нернста имеет вид:
|
|
|

где E0 - стандартный потенциал. В зависимости от концентрации КС1 различают насыщенный, нормальный и децинормальный каломельные электроды сравнения. Эти электроды сравнения хорошо воспроизводимы, устойчивы и пригодны для работы при т-рах до 80 °С. При более высоких т-рах начинается разложение хлорида ртути. Часто каломельный электрод сравнения подсоединяют через солевой мостик, состоящий из концентриров. р-ра КС1 для снижения диффузионного потенциала. Потенциал Е каломельного электрода сравнения зависит от т-ры, причем температурный коэф. минимален для децинормального электрода, для к-рого Е =0,3365 - 6 х 10-5(t-25), где t - т-ра (°С).
Галогеносеребряные электроды сравнения представляют собой серебряную проволоку, покрытую галогенидом серебра, к-рый наносится путем термич. или электрохим. разложения соли серебра. Электродная р-ция отвечает ур-нию: Ag + Hal-  AgHal + е (Hal - галоген), а ур-ние Нернста имеет вид:.
AgHal + е (Hal - галоген), а ур-ние Нернста имеет вид:.

Удобны при работе с электрохим. ячейками без жидкостного мостика, применимы как в водных, так и во мн. неводных средах, устойчивы при повышенных т-рах. В области т-р 0-95 °С потенциал хлорсеребряного электрода сравнения описывается ур-нием: E=0,23655-- 4,8564 x 10-4t - 3,4205 x 10-6t2 + 5,869 x 10-9t3.
Оксидно-ртутный электрод сравнения приготавливают из ртути и насыщенных р-ров оксида ртути в водном р-ре щелочи. Электродная р-ция: Hg2O + 2e + H2O  2Hg + 2OH;
2Hg + 2OH;
ур-ние Нернста:

Удобен при работе в щелочных р-рах, т. к. при этом легко реализовать цепи без жидкостного соединения.
Хингидронный электрод сравнения представляет собой платиновую проволочку, опущенную в насыщ. р-р хингидрона. Электродная р-ция: С6Н4(ОН)2  С6Н4О2 + 2Н+ + 2е. Стандартный потенциал E° = 0,6992 В. Используется в интервале рН 0-6, а в буферных р-рах в отсутствие сильных окислителей - до рН
С6Н4О2 + 2Н+ + 2е. Стандартный потенциал E° = 0,6992 В. Используется в интервале рН 0-6, а в буферных р-рах в отсутствие сильных окислителей - до рН 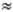 8,5. В интервале т-р 0-50 °С потенциал хингидронного электрода сравнения выражается ур-нием: Е = 0,6992 - 7,4 x 10-4(t -25) + [0,0591 + 2 x 10-4(t -25)] lgaН+.
8,5. В интервале т-р 0-50 °С потенциал хингидронного электрода сравнения выражается ур-нием: Е = 0,6992 - 7,4 x 10-4(t -25) + [0,0591 + 2 x 10-4(t -25)] lgaН+.
При измерениях в неводных средах в принципе можно применять водные электроды сравнения, если создать воспроизводимую границу водного и неводного р-ров и учитывать возникающий на этой границе диффузионный потенциал. Часто в неводных средах используют электроды сравнения на основе серебра в р-ре его соли.
В расплавленных солевых системах наиболее часто используются электроды сравнения, основанные на паре AgI/Ag, к-рая стабильна в разл. расплавах.
Потенциалы водных электродов сравнения по отношению к стандартному водородному электроду при 25 °С приведены в табл.:
| Электрод | Потенциал, В |
| Насыщенный каломельный: Hg | Hg2Cl2, насыщенный КС1 | 0,2412 |
| Нормальный каломельный: Hg| Hg2Cl2, 1M КС1 | 0,2801 |
| Децинормальный каломельный: Hg| Hg2Cl2, 0,1M KC1 | 0,3337 |
| Хлорсеребряный: Ag | AgCl, насыщенный КС1 | 0,197 |
| Оксидно-ртутный: Hg| HgO, 0.1M NaOH | 0,926 |
|
|
|




