 |
Рекомендательный библиографический список
|
|
|
|
Орлов А.К.
О664. Основы производства и обработки металлов: Учебное пособие / А.К.Орлов, Г.В.Коновалов. Санкт-Петербургский государственный горный институт (технический университет). СПб, 2006. 115 с.
ISBN 5-94211-190-1
УДК 669.2/8 (075.80)
ББК 34.33
| ISBN 5-94211-190-1 | Ó Санкт-Петербургский горный институт им. Г.В.Плеханова, 2006 |
Введение
Производство металлов возникло в глубокой древности и долгое время было лишь искусным ремеслом, секреты которого передавались из поколения в поколение. Постепенно, с XVIII в. более интенсивно, расширилась номенклатура и масштабы производства металлов, началась разработка теоретических основ процессов производства металлов. В наши дни металлургия – это и отрасль промышленности, производящая из природных руд и других источников сырья металлы и сортовые сплавы, и область науки, занимающаяся теорией и практикой получения и рафинирования металлов и сплавов.
Из 109 химических элементов периодической таблицы Менделеева к металлам относят около 90, а промышленная номенклатура металлов сейчас включает больше 70 наименований.
К настоящему времени сложилась промышленная классификация металлов, согласно которой все металлы условно делятся на две группы: черные и цветные. К черным металлам относят железо и его сплавы, а также марганец, хром и ванадий. Все остальные металлы называют цветными и подразделяют на несколько групп:
· тяжелые (плотность 5-13,6 г/см3) – Cu, Ni, Pb, Zn, Sn (основные), Cd, Co, As, Sb, Hg, Bi (младшие);
· легкие (плотность менее 4 г/см3) –Al, Mg, Na (основные), Be, Li, Ba, Ca, Sr, K (младшие);
· благородные – Au, Ag, Pt, Pd, Os, Ir, Ru, Rh;
· редкие – W, Mo, Ti, Zr, Hf, Nb, Ta, Re (тугоплавкие, температура плавления более 1650 °С), Ga, Tl, Ge, Se, Te, In, Rb, Cs (рассеянные), Sc, Y, La и все лантаноиды (редкоземельные), U, Th, Ac, Pa, Ra и др. (радиоактивные).
|
|
|
На долю железа и его сплавов приходится около 93 % общей массы производимых металлов. Ежегодное мировое производство стали в последние годы составляет около 1000 млн т. Мировое производство некоторых цветных металлов в 2004 г. характеризуют следующие данные, тыс.т: первичный и вторичный алюминий около 35000, первичная и вторичная медь 15800, цинк 10000, свинец 6700, никель 1230, магний 430, молибден 140, кобальт 48, серебро 27, кадмий 20.
|
По одному из прогнозов к 2050 г. ожидается значительный рост потребления, млн т/год: алюминий до 48,5-54,5, медь 25,3-28,6, цинк 15,3-17,4, свинец 10,9-12,7.

|
В производстве металлов различают два вида сырья: первичное (природное) и вторичное. Первичным сырьем являются руды и получаемые при их обогащении концентраты. Рудами называют горные породы, содержащие рудные (извлекаемые) минералы в количествах, которые достаточны для их переработки с приемлемыми экономическими показателями. Вторую часть руды составляют минералы пустой породы. Вторичное металлосодержащее сырье представляет собою отходы различных производств, а также промышленный и бытовой лом.
Для получения металла или сортового сплава из любого вида металлосодержащего сырья приходится применять различные металлургические процессы, в результате которых основной металл постепенно отделяется от пустой породы, от химических элементов, с которыми он связан в рудном минерале, спутников. Последовательность операций обработки металлосодержащего сырья образует технологическую схему его переработки. В качестве примера приведем принципиальные технологические схемы переработки сульфидной медной руды пирометаллургическим методом и сульфидных цинковых концентратов гидрометаллургическим методом.
|
|
|
Для получения меди из сульфидной руды с использованием плавки на штейн (рис.1) медь нужно отделить от основной массы пустой породы, железа и серы, что принципиально можно сделать по четырем вариантам, различающимся числом стадий в головной части технологической схемы. В каждом из них промежуточным продуктом является черновая медь, дальнейшим огневым и электролитическим рафинированием которой получают конечный продукт – катодную медь.
Переработка сульфидных цинковых концентратов гидрометаллургическим методом (рис.2) также состоит в отделении цинка от серы и других примесей. Серу на стадии обжига удаляют в газовую фазу, переводя при этом цинк из сульфида в форму оксида, который хорошо растворяется в водном растворе серной кислоты. Итогом выщелачивания и очистки раствора от примесей является получение чистого раствора сульфата цинка, из которого выделяют цинк электролизом, получая металл требуемой чистоты.
1. ФИЗИКОХИМИЯ МЕТАЛЛУРГИЧЕСКИХ ПРОЦЕССОВ
Конечной задачей любого металлургического производства является получение из исходного сырья металлов в свободном виде (в том числе и в виде сплавов) или в виде соединений, являющихся товарным продуктом. Как уже отмечалось, для этого нужно отделить основной металл от примесей.
Чаще всего металлы присутствуют в исходном сырье в виде оксидов и сульфидов. Поведение каждого из оксидов и сульфидов металлов в пирометаллургических процессах при высоких температурах определяется, как правило, прочностью этих соединений или сродством металлов с кислородом и серой. В общем виде для двухвалентного металла можно написать следующие реакции образования и диссоциации МеО и MeS:
2Me + O2 Û 2MeO; (1)
2Me + S2 Û 2MeS. (2)
Константы равновесия этих реакций соответственно
 и
и  ,
,
где а – активность соответствующих элементов или соединений; Р О2и Р S2– упругость диссоциации оксида и сульфида соответственно.
Для конденсированных фаз, находящихся в свободном состоянии, а МеО, а Ме и а MeS являются постоянными, могут быть приняты равными единице. Тогда константы равновесия можно записать в виде  и
и  .
.
Константы равновесия химических реакций зависят от температуры и связаны с энергией Гиббса уравнением
|
|
|
DG0 = – RT ln K p,
где R – газовая постоянная; Т – температура.
Таким образом, прочность оксидов и сульфидов металлов (или сродство их с кислородом и серой) можно оценить по величине энергии Гиббса или упругости диссоциации оксида и сульфида. Чем меньше величина энергии Гиббса образования соединения, тем прочнее соединение и тем, соответственно, меньше Р О2или Р S2
Для удобства оценки прочности однотипных соединений строят диаграммы зависимости их энергии Гиббса образования или упругости диссоциации от температуры. Используя такие диаграммы, можно написать ряд по возрастающей прочности при высоких температурах оксидов и сульфидов некоторых металлов, соответственно
Ag2O ® CuO ® Fe2O3 ® Cu2O ® PbO ® NiO ® Fe3O4 ®
® ZnO ® FeO ® SiO2 ® Al2O3 ® MgO ® CaO;
CuS ® FeS2 ® NiS ® PbS ® FeS ® Ni3S2 ® Cu2S ® ZnS.
В обоих случаях более прочными являются низшие соединения одного и того же металла (например, FeO по сравнению с Fe3O4 и Fe2O3, Cu2S по сравнению с CuS и т.д.). На различии прочности соединений металлов с кислородом основаны восстановительные процессы, а различия в прочности соединений металлов с серой и кислородом лежат в основе процессов, в которых приходится иметь дело с сульфидными материалами.
Восстановительные процессы. Наиболее часто используемыми восстановителями в металлургии являются СО, Н2, углеводороды, твердый углеродистый материал (кокс, каменный уголь и др.), некоторые металлы.
Реакции восстановления оксида металла (МеО) оксидом углерода (II) или водородом имеют вид
МеО + СО Û Ме + СО2; (3)
МеО + Н2 Û Ме + Н2О. (4)
Если оксид металла и металл находятся в конденсированном состоянии во взаимонерастворимых фазах, то константы равновесия реакций (3) и (4) соответственно
 и
и  .
.
Поскольку константы равновесия реакций зависят от температуры, то равновесный состав газовой фазы для оксидов разных металлов будет зависеть от их природы и температуры. Из диаграммы зависимости восстановимости оксидов некоторых металлов оксидом углерода (II) можно установить, каким должно быть содержание СО в газовой смеси (СО и СО2), чтобы термодинамически при заданной температуре могло происходить восстановление оксида металла до свободного металла. Например, при 1000 °С для восстановления FeO до Fe в газовой фазе должно содержаться более 70 % СО, тогда как Fe3O4 будет восстанавливаться до FeO при этой температуре при содержании СО более 20 %. Поддерживая соответствующий состав газовой фазы, можно селективно восстановить оксид одного или оксиды нескольких металлов до свободного состояния, а другие оставить в форме оксидов.
|
|
|
В случае использования в качестве восстановителя твердого углерода процесс идет обычно по двухступенчатой схеме по реакциям
МеО + СО Û Ме + СО2
СО 2 + С Û 2СО (5)
МеО + С = Ме + СО. (6)
Константа равновесия реакции (5)  .
.
|
Термодинамически минимальная температура для протекания процесса восстановления оксида металла в системе МеО – С при избытке углерода в шихте определяется точкой пересечения равновесных кривых реакций (3) и (5). Из рис.3 видно, что для системы FеО – С эта температура составляет около 700 °С, тогда как для восстановления ZnO до металла углеродом требуется температура более 950 °С.
Поскольку термодинамически минимальная температура восстановления того или иного оксида металла при избытке твердого углерода в шихте является определенной величиной, то это обстоятельство ограничивает возможность селективного восстановления одного или нескольких оксидов из многокомпонентного сырья при таком ведении процесса.
Большие возможности для обеспечения селективности восстановления оксидов металлов при переработке многокомпонентного сырья с использованием твердого углеродистого восстановителя дает проведение процесса с недостатком углерода в шихте, при котором влиять на процесс можно, не только меняя температуру в рабочем пространстве печи, но и регулируя содержание СО и СО2 в газовой фазе за счет изменения соотношения углерода в шихте и кислорода, подаваемого в печь с дутьем.
Плавки на штейн. Этот вид плавок наиболее распространен в металлургии меди и никеля. В основе плавок на штейн, помимо различия сродства металлов с кислородом и серой, лежит плохая взаимная растворимость штейна и шлака и различие их плотности (плотность штейна больше плотности шлака). Напомним, что штейн представляет собой сплав низших сульфидов металлов, устойчивых при высоких температурах, а шлак – это сплав оксидов металлов.
Плавка на штейн медь- и никельсодержащего сырья позволяет извлечь подавляющую часть этих металлов в штейн, тогда как пустая порода и часть железа уходят в шлак. Этот вид плавки называют еще концентрационным.
При плавке на штейн газовая фаза может иметь нейтральный, окислительный и восстановительный характер. При плавке в нейтральной среде химические превращения отдельных составляющих шихты обусловлены, в основном, действием на них только высоких температур. В этом случае развиваются процессы разложения соединений (например, высших сульфидов металлов), состав штейна практически не регулируется и зависит от состава исходного сырья.
|
|
|
При плавке в окислительных условиях можно часть сульфидов железа перевести в форму оксидов, которые уйдут в шлак. Это дает возможность получить более богатый по содержанию цветных металлов штейн и иметь меньший его выход. Можно регулировать состав штейна в зависимости от степени окисления сульфидов железа. А так как окисление сульфидов сопровождается выделением тепла, то оно используется в процессе плавки.
Если плавка на штейн ведется в восстановительной среде, то часть оксидов металлов, содержащихся в шихте (например, оксиды железа, никеля), может восстанавливаться до свободных металлов и штейны получаются металлизированными (содержат часть металлов в свободном виде).
При восстановительно-сульфидирующей плавке происходят процессы восстановления части оксидов железа и оксидов цветных металлов до свободных металлов и процессы сульфидирования цветных металлов и части железа.
Продукты и полупродукты плавки. Основными продуктами и полупродуктами металлургических плавок являются металлы, штейны, файнштейны, шлаки, пыль и газы.
Металлы и сплавы металлов можно рассматривать как основной вид продукции металлургического производства и как черновые металлы, которые обычно подвергают рафинированию (очистке от примесей). Характеризуются металлы и сплавы химическим составом, температурой плавления, температурой кипения и плотностью. Черновые металлы могут содержать 90-99 % основного металла и различное число и концентрацию примесей. Рафинированные металлы обычно содержат не менее 99,9 % основного металла. К числу легкоплавких металлов относятся свинец, цинк, алюминий (температура плавления соответственно 327,4, 419,4 и 660 °С), умеренная температура плавления у меди (1083 °С) значительно выше температуры плавления никеля (1455 °С) и железа (1535 °С), а одним из самых тугоплавких металлов является вольфрам (3395 °С). В твердом состоянии плотность алюминия, меди, свинца и вольфрама соответственно 2,7, 8,94, 11,34 и 19,3 г/см³. В жидком состоянии она существенно ниже (плотность алюминия при 700 °С и свинца при 400 °С соответственно 2,369 и 10,667 г/см³).
Штейны и файнштейны являются сплавами низших сульфидов цветных металлов и железа, устойчивых при высоких температурах: Cu2S, Ni3S2, FeS, CoS, ZnS, PbS. Штейны и файнштейны также характеризуются химическим составом, температурой плавления и плотностью. Основными составляющими медных штейнов являются медь (10-60 %), железо (15-50 %) и сера (23-26 %). Температура плавления медных штейнов 900-1050 °С, плотность 4-5,7 г/см3. Плавкость различных штейнов можно оценить по соответствующим диаграммам состояния систем (например, плавкость медных штейнов по двойной диаграмме состояния системы Cu2S – FeS или по тройной диаграмме состояния системы Cu – Fe – S).
Файнштейны представляют собой сплав сульфидов цветных металлов с небольшим содержанием железа. Их получают при переработке никелевых и медно-никелевых штейнов конвертированием.
Шлаки – сплавы оксидов металлов – являются непременным продуктом всех металлургических плавок. Основные свойства шлаков: температура плавления, вязкость (или жидкотекучесть), плотность, небольшой унос извлекаемого металла, экономичность – зависят от их химического состава и свойств отдельных составляющих, основную долю которых составляют SiO2, CaO, FeO, Al2O3, MgO, ZnO. Для шлаков цветной металлургии характерно присутствие SiO2, CaO и FeO, для шлаков черной металлургии – SiO2, CaO и Al2O3. Соответственно плавкость и вязкость шлаков цветной металлургии можно оценить по тройной диаграмме состояния системы SiO2 –CaO – FeO (или по двойным диаграммам, например, для конвертерных шлаков по диаграмме состояния системы SiO2 – FeO), а для доменных шлаков по тройной диаграмме состояния системы SiO2 – CaO – Al2O3. Температура плавления шлаков цветной металлургии чаще всего 1050-1200 °С.
Пыль уносится из рабочего пространства плавильных и других металлургических печей отходящими газами и представляет собою механический и химический унос шихтовых составляющих.
Отходящие газы являются продуктами горения топлива, химического взаимодействия дутья с шихтой и других процессов, протекающих в металлургических агрегатах. Назовем основные составляющие отходящих газов: СО, СО2, SO2, SO3, О2, N2, Н2О и др.
2. ОСНОВЫ ПРОИЗВОДСТВА ЧУГУНА И СТАЛИ
Чистое железо – металл серебристо-белого цвета, вязкий и ковкий. Его плотность при 20 °С 7,87 г/см3, температура плавления 1535±5 °С, температура кипения 2450 °С. До 768 °С железо ферромагнитно. Железо имеет три аллотропические модификации: до 910 °С a-железо, 910-1400 °С g-железо, более 1400 °С d-железо. Железо растворяет углерод (предельная растворимость углерода в g-железе 1,98 %) и образует с углеродом карбиды, в частности Fe3C – цементит. Сплавы железа с углеродом, содержащие до 2 % С (обычно менее 1,5 %), называют сталями, а сплавы с содержанием более 2-2,5 % С называют чугунами. Наиболее вредными примесями железа являются сера (придает сталям красноломкость) и фосфор (придает сталям хладноломкость). Для получения сталей с различными свойствами в них добавляют различные легирующие элементы: Cr, V, Ni, Co, Mo, W, Mn и др.
Природным сырьем для производства чугуна и стали служат железные руды, в которых железо представлено различными оксидными минералами. Перечислим основные типы этих руд:
· Гематитовые руды (красный железняк) содержат железо в виде гематита Fe2O3 (70,8 % Fe). Руды этого типа обычно богаты железом (45-65 %). Руды, содержащие менее 40 % Fe и до 40-50 % SiO2, называют железистыми кварцитами. Бурые железняки содержат железо в виде Fe2O3 n H2O (52,2-66,1 % Fe), где n = 0,5¸3 (2Fe2O3H2O – турьит, Fe2O3H2O – гетит, Fe2O33H2O – лимнит и др.). Руды этого типа содержат 25-50 % Fe.
· Магнетитовые руды содержат железо в виде магнетита Fe3O4 (72,4 % Fe) и преимущественно богаты железом (50-60 %).
· Сидеритовые руды содержат в качестве основного минерала сидерит FeCO3 (48,2 % Fe). Руды этого типа содержат до 30-40 % Fe.
Подготовка железных руд к металлургической переработке начинается на обогатительных фабриках, где их подвергают дроблению, измельчению, классификации по крупности, обогащению (промывке, магнитной сепарации, флотации и др.). В результате обогащения из руд получают концентраты, содержащие 55-68 % Fe, 5-10 % SiO2 и другие примеси.
Основным методом металлургической переработки железосодержащего сырья продолжает оставаться двухстадийная технология, при которой на первой стадии получают чугун, а на второй стадии чугун перерабатывают в сталь. Производство чугуна, как правило, осуществляют в процессе доменной плавки с получением двух видов чугуна: передельного (производство стали) и литейного (литейное производство). При наличии дешевой электроэнергии можно получать чугун и в электропечах. В доменных печах можно получать также некоторые ферросплавы, но чаще для этого используют электрические печи.
В последние десятилетия уже нашли промышленное применение и продолжают развиваться процессы прямого получения железа и стали, не требующие кокса и доменной плавки.
2.1. Подготовка мелкого железосодержащего сырья
к доменной плавке
Основной процесс подготовки – окускование. Для этих целей используют два метода: агломерацию и получение железорудных окатышей.
При выборе способа окускования руководствуются следующими соображениями. Если после обогащения получают грубозернистый концентрат, то всегда применяют агломерацию. Из тонкозернистых концентратов (размер зерна менее 0,05 мм) производят окатыши, что особенно важно в тех случаях, когда фабрика окускования находится на удалении от доменного цеха, так как окатыши имеют более высокую прочность в холодном состоянии и лучше (без разрушения) переносят транспортировку.
При агломерации (аглообжиге) шихту, состоящую из мелких железосодержащих материалов (рудная мелочь, концентрат, пыль), известняка, оборотных материалов и коксика (5-7 %, крупность менее 3 мм), увлажняют до 8-15 % и подают на паллеты (тележки с дном в виде колосниковой решетки) ленточной агломерационной машины (рис.4) равномерным слоем высотой 250-400 мм. Проходя под зажигательным горном, поверхностный слой шихты нагревается до 750-850 °С и коксик начинает гореть. При дальнейшем движении паллет к разгрузочному концу в зоне горения коксика температура шихты достигает 1300-1500 °С, часть ее переходит в расплавленное состояние, смачивает нерасплавившиеся частицы шихты, а после снижения температуры затвердевает и скрепляет их. В результате этого образуется пористый кусковой продукт – агломерат.
|
На практике используют агломашины с площадью спекания 50-600 м2. Их удельная производительность по шихте 30-40 т/(м2×сут). Для улучшения показателей доменной плавки агломерат получают офлюсованный: S(CaO,MgO)/S(SiO2, Al2O3) = 1,3¸1,5 по массе.
При получении железорудных окатышей мелкую шихту, увлажненную до 8-10 %, без добавки или с добавкой связующего (чаще всего 0,5-1,5 % бентонита от массы концентрата) окомковывают на барабанных (диаметр до 3 м, длина до 10-11 м) или тарельчатых (наклоненная под углом 30-60° чаша диаметром до 6-8 м с бортами; скорость вращения 5-15 об./мин) грануляторах (окомкователях), получая гранулы диаметром 12-25 мм. Сырые окатыши подвергают упрочняющему обжигу, нагревая их до 1200-1400 °С на конвейерных машинах, аналогичных ленточной агломашине, с рабочей площадью 100-780 м2 или в комбинированных агрегатах, состоящих из конвейерной машины (сушка и подогрев окатышей) и трубчатой вращающейся печи (обжиг окатышей).
2.2. Доменная плавка
|
Шихта доменных печей состоит из кускового железосодержащего материала (руда, агломерат, окатыши), кокса (топливо и восстановитель) и флюсов (известняк). Цель доменной плавки – извлечь из сырья железо в виде чугуна. Доменная печь представляет собою агрегат с рабочим пространством, вертикально вытянутым вверх (рис.5). Главными ее элементами являются колошник, шахта печи, распар, заплечики и горн. Основным огнеупорным материалом для кладки печи является высококачественный шамот; горн внутри выкладывают из углеродистых блоков. Доменные печи характеризуют объемом рабочего пространства, составляющего 1000-5500 м3. Высота доменной печи объемом 5500 м3 достигает 41 м, а диаметр в области распара 16,5 м.
Шихта, загруженная в печь, перемещается сверху вниз навстречу восходящему потоку газов, образующемуся за счет горения кокса в области фурм. Воздух подается в печь через фурмы предварительно нагретым в кауперах до 1000-1200 °С. Давление дутья 280-420 кПа. Вместе с дутьем практикуют подачу в печь топливных добавок (природный газ, угольная пыль и др.). Максимальная температура продуктов сгорания кокса достигает 1900-2000 °С, но уже на расстоянии 1,5-2 м от фурм она снижается до 1450-1600 °С. Температура газов, удаляемых из доменной печи, 200-400 °С.
Из загруженной в доменную печь шихты в результате совокупности протекающих в ней процессов (химических, физических, теплообменных, массообменных, механических) получают продукты плавки: чугун, шлак, газы и пыль. Жидкие продукты плавки (чугун и шлак), скапливающиеся в горне печи, периодически или непрерывно выпускают через соответствующие летки.
Основные процессы доменной плавки. Среди физических и химических процессов, протекающих в доменной печи, выделим следующие: дегидратацию шихты, разложение карбонатов, горение кокса, восстановление оксидов, науглероживание железа и превращение его в чугун, шлакообразование и расплавление шлака, взаимодействие металла и шлака.
Физико-механическая влага удаляется из шихты при ее нагреве до 100-200 °С, гидроксиды железа обезвоживаются при температуре около 300 °С, а из гидратированных силикатов влага уходит при температуре до 900 °С.
Карбонаты железа разлагаются при 400-600 °С, а карбонаты кальция при 800-900 °С.
Горение кокса в области фурм за счет кислорода вдуваемого воздуха идет по реакциям:
| С + О2 = СО2 + 393,5 кДж; | (7) |
| 2С + О2 = 2СО + 221,1 кДж; | (8) |
| 2СО + О2 = 2СО2 + 565,9 кДж; | (9) |
| СО2 + С = 2СО – 172,4 кДж. | (10) |
Вблизи фурм, в окислительной зоне, протекают все реакции (7)-(10), но, когда весь кислород израсходуется, газы будут реагировать с раскаленными кусками кокса только по реакции (10) в восстановительной зоне. В результате этих процессов при работе на воздушном дутье образуется восстановительный газ, содержащий % по объему: СО 34; N2 65,3; Н2 < 1. Тепло от горения кокса у фурм должно обеспечить общее теплопотребление процесса доменной плавки.
Восстановление оксидов железа в верхних зонах печи за счет СО (косвенное) происходит ступенчато при температуре до 570 и более 570 °С по схемам соответственно
Fe2O3 ® Fe3O4 ® Fe;
Fe2O3 ® Fe3O4 ® FeO ® Fe.
Химические реакции этих процессов следующие:
| 3Fe2O3 + CO = 2Fe3O4 + CO2 + 52,25 кДж; | (11) |
 Fe3O4 + CO = Fe3O4 + CO = 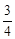 Fe + CO2 + 5,7 кДж; Fe + CO2 + 5,7 кДж;
| (12) |
| Fe3O4 + CO = 3FeO + CO2 – 35,45 кДж; | (13) |
| FeO + CО = Fe + CO2 + 13,2 кДж. | (14) |
Для анализа термодинамики этих реакций нужно обратиться к рис.3. Кинетически реакции (11), (13) и (14) протекают соответственно при температурах более 200, 300-400 и 750-800 °С. Основная масса оксидов железа восстанавливается при температуре 900-1000 °С и более в области распара и заплечиков за счет твердого углерода (прямое восстановление), которое фактически протекает также через участие СО в две стадии по реакциям
| FeO + CO = Fe + CO2 + 13,2 кДж | |
| С + СО 2 = 2СО – 172,4 кДж 1 | |
| FeO + C = Fe + CO – 159,2 кДж. | (15) |
Восстановление оксидов железа заканчивается в области распара и заплечиков при 1100-1200 °С.
Высшие оксиды марганца (MnO2, Mn2O3 и Mn3O4) оксидом углерода (II) ступенчато восстанавливаются до MnO, а последний в зоне высоких температур восстанавливается по реакции
MnO + C = Mn + CO – 288,2 кДж. (16)
Частичное восстановление SiO2 при высоких температурах имеет место по реакции
SiO2 + 2C = Si + 2CO – 646 кДж. (17)
Фосфор, находящийся в шихте в виде фосфатов железа и кальция, восстанавливается углеродом и СО до свободного фосфора, который образует фосфиды железа (Fe2P, Fe3P), растворяющиеся в железе:
3CaOP2O5 + 5C = 3CaO + 2P + 5CO. (18)
Науглероживание железа начинает происходить при температуре до 1000 °С за счет сажистого углерода по суммарной реакции
3[Fe] + 2CO = [Fe3C] + CO2. (19)
Дальнейшее науглероживание железа идет за счет твердого углерода при более высоких температурах по реакции
3[Fe] + C = [Fe3С]. (20)
Углерод понижает температуру плавления железа, поэтому, начиная с 1200 °С, происходит оплавление частиц железа, образование капель чугуна, которые, стекая по кускам кокса, дополнительно науглероживаются. В горне содержание углерода в чугуне достигает 3,7-4,5 %.
Первичные капли шлакового расплава в зависимости от наличия легкоплавких оксидов в шихте появляются при 1170-1355 °С. Этот шлак содержит до 20 % FeO. Стекая вниз по кускам кокса, он обедняется оксидами Fe и Mn за счет их восстановления и постепенно обогащается оксидом кальция. Из процессов между металлом и шлаком, протекающих на границе их раздела, наиболее важным является десульфурация чугуна, которая может быть выражена суммарной реакцией
[FeS] + (CaO) + [C] = (CaS) + [Fe] + CO – Q. (21)
Продукты доменной плавки и показатели ее работы. Чугун из печи выпускают при температуре около 1400 °С в ковши емкостью 90-140 т и передают в миксерное отделение или на разливочную машину, где отливают чушки массой около 45 кг. Состав чугуна зависит от состава сырья и режима работы печи. Примерный состав передельного чугуна, %: Si 0,5-1,3, Mn 0,6-1,2, P 0,15-0,2, S 0,03-0,07, С 3,7-4,5.
Шлак (0,5-1,0 от массы чугуна) выпускают при температуре около 1500 °С в шлаковозные чаши объемом до 24 м3 и чаще всего гранулируют. Грануляция шлака может осуществляться и непосредственно при выпуске из доменной печи. Химический состав шлака следующий, %: SiO2 30-40; CaO 40-50; Al2O3 10-25; MgO до 6; MnO до 4; FeO 0,5-1,0.
Доменный газ содержит следующие соединения, % по объему: СО2 8-17; S(СО, СО2) 40-42; СН4 0,1-0,2; Н2 0,9-2; N2 55-59. После очистки в несколько стадий от пыли газ используют в качестве горючего. Его теплотворная способность 3800-4200 кДж/м3. На 1 т кокса получается до 4000 м3 колошникового газа.
Одним из показателей работы доменных печей является их суточная производительность по чугуну Р, которая зависит от объема печи V, для больших печей Р > 10000 т/сут. Более важным показателем является коэффициент использования полезного объема печи (КИПО или K = V / P), обычно K = 0,4¸0,6 м3×сут/т. Удельный расход кокса на 1 т передельного чугуна на современных печах 0,35-0,55 т. Снижению расхода кокса способствует использование нагретого дутья, обогащение его кислородом (до 24-26 %) и подача с дутьем топливных добавок (природный газ, мазут, пастообразное или пылевидное топливо). Время пребывания шихты в доменной печи 5-7 ч. Срок службы печи 5-11 лет.
2.3. Производство стали из чугуна
Производство стали является вторым переделом двухстадийной технологии извлечения железа из руд путем переработки чугуна и металлоотходов в сталь. Сущность сталеплавильных процессов сводится к окислению примесей (С, Si, Mn, P и др.), содержащихся в чугуне и стальном ломе, за счет кислорода воздуха, технического кислорода, оксидов железа шлака и железной руды и доведению состава жидкого металла до состава марочной стали, а затем к ее раскислению и легированию.
Для производства стали используют различные металлургические печи, а сталеплавильные процессы характеризуются большим разнообразием условий их проведения.
В современной мировой практике примерно 60 % стали производят кислородно-конвертерным способом, около 30 % стали выплавляют в электропечах, а остальную сталь получают в мартеновских и двухванных печах.
Основные реакции сталеплавильных процессов. Окисление и удаление примесей из чугуна основано на большем сродстве этих примесей, чем железа, с кислородом. Процесс окисления примесей идет как за счет кислорода газовой фазы, так и путем передачи кислорода оксидами железа через шлак, образующийся за счет оксидов выгоревших примесей (SiO2, MnO, Cr2O3, P2O5 и др.), флюсующих добавок (СаО, SiO2) и огнеупорной футеровки печи (MgO, CaO, SiO2 и др.).
В любом металлургическом агрегате для производства стали есть три фазы – металл, шлак и газ, которые участвуют в передаче кислорода примесям. Механизм передачи кислорода примесям во всех случаях один и тот же, но в зависимости от конструкции печи и условий ее работы превалирует тот или другой путь передачи кислорода. С этой точки зрения и рассмотрим процессы, протекающие на границе раздела фаз и в их объеме.
На границе раздела металл – газовая фаза могут происходить реакции:
| 2Fe + O2 = 2FeO + Q; | (22) |
| Si + O2 = SiO2 + Q; | (23) |
| 2Mn + O2 = 2MnO + Q. | (24) |
На границе раздела газовая фаза – шлак протекает реакция
2FeO +  O2 = Fe2O3 + Q. (25)
O2 = Fe2O3 + Q. (25)
Окисление железа (II) до железа (III) может происходить также за счет СО2 и Н2О газовой фазы:
СО2 + 2FeO = Fe2O3 + CO;
H2O + 2FeO = Fe2O3 + H2.
Кроме того, оксид железа Fe2O3 может поступать в шлак с загружаемой в печь железной рудой.
Оксид железа (III) диффундирует от границы раздела газ – шлак к границе раздела шлак – металл, где имеет место реакция
Fe2O3 + Fe = 3FeO. (26)
Образующийся оксид железа (II) частично диффундирует к границе раздела газовая фаза – шлак и снова окисляется до Fe2O3 кислородом по реакции (25), а также СО2 и Н2О. Кроме того, он частично окисляет примеси здесь же, на границе раздела шлак – металл, частично растворяется в металле и окисляет примеси в объеме металлической фазы.
Окисление углерода, кремния и марганца с участием FeO идет по реакциям
| [C] + (FeO) = [Fe] + CO – Q; | (27) |
| [Si] + 2(FeO) = (SiO2) + 2[Fe] + Q; | (28) |
| [Mn] + (FeO) = (MnO) + [Fe] + Q. | (29) |
Окисление и удаление фосфора идет при участии СаО:
2[P] + 5(FeO) + 4(CaO) = (4CaO×P2O5) + 5[Fe] + Q. (30)
Для удаления фосфора шлак должен иметь высокое содержание СаО (СаО:SiO2» 3,0).
Десульфурация стали (удаление серы) основным шлаком происходит по схеме
[FeS] ® (FeS); (FeS) + (CaO) = (CaS) + (FeO).
Одновременно с этими реакциями на границе шлак – металл происходит удаление серы по реакции (21).
Порядок, скорость и степень удаления примесей зависит как от их природы, так и условий ведения процесса.
Раскисление и легирование стали. Раскисление – это удаление из стали растворенного в ней кислорода, который ухудшает механические свойства стали (прочность, пластичность). Раскисление осуществляют двумя методами, осаждающим и диффузионным. Раскислителями являются химические элементы, имеющие более высокое сродство с кислородом, чем железо. К ним относятся Mn, Si, Ti, Al и др.
Процесс осаждающего раскисления протекает в объеме металла по реакции
[O] + [R] = RO(газ, ж, тв). (31)
На практике в качестве раскислителей используют: ферросилиций (12; 45 и 75 % Si), ферромарганец (72 % Mn), сплав AMS (18,5 % Mn, 14,4 % Si, 9,1 % Al) и др.
Диффузионное раскисление стали заключается в восстановлении FeO в шлаке элементами-раскислителями, входящими в состав смесей. Снижение содержания FeO в шлаке вызывает диффузию [O] из металла в шлак до момента установления равновесия при заданной температуре согласно закону распределения L FeO = [O]/(FeO) = const, где L – коэффициент распределения.
Преимуществом этого (более дорогого) способа является то, что металл получается чище по неметаллическим включениям (продукты раскисления остаются в шлаке). Порошкообразные раскислительные смеси, в состав которых обычно входят углеродистые материалы, Fe-Si и Al, подают на поверхность шлака в несколько приемов.
Легирование стали производят различными легирующими элементами (Ni, Cr, Mo, Mn, Si, Ti, W, V, Co, Nb, B и др.).
Практика производства стали. Оборудование для производства стали разнообразно: конвертеры, мартеновские, дуговые и индукционные электрические печи. Конвертер вертикального типа с кислородным дутьем (рис.6) представляет собой емкость грушевидной формы, корпус которой сварен из стальных листов толщиной до 50-100 мм. Внутри он футерован магнезитовым или хромомагнезитовым кирпичом. Емкость конвертеров 50-400 т. Конвертер вместимостью 300-350 т имеет наружный диаметр 8,5 м, высоту 10,77 м. Дутье – технически чистый кислород (95-98 % О2), а также его смесь с водяным паром или СО2, – подают в конвертер сверху через непогруженную фурму, нижний конец которой в момент продувки находится на расстоянии около 1,0-2,5 м от уровня расплава. Давление дутья 0,8-1,6 МПа. Длительность продувки 15-20 мин. Глубина ванны в конвертере 1,0-1,75 м. Шихтовые материалы: жидкий чугун, железный скрап и железная руда (охладители), известь (флюс), боксит и плавиковый шпат (уско
|
|
|









