 |
Присоединение происходит стереоселективно как транс.
|
|
|
|
Правила ориентации при электрофильном замещении в бензольном кольце основаны на взаимном влиянии атомов в молекуле. Если в незамещенном бензоле С6Н6 электронная плотность в кольце распределена равномерно, то в замещенном бензоле С6Н5Х под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на легкость и направление реакций электрофильного замещения. Место вступления нового заместителя определяется природой уже имеющегося заместителя.
Правила ориентации
Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее действие.
По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода.. Ориентанты 1-го рода (орто-пара-ориентанты) направляют последующее замещение преимущественно в орто- и пара-положения.
К ним относятся электронодонорные группы (электронные эффекты групп указаны в скобках):
-R (+I); -OH (+M,-I); -OR (+M,-I); -NH2 (+M,-I); -NR2 (+M,-I)
+M-эффект в этих группах сильнее, чем -I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто- и пара-положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов.
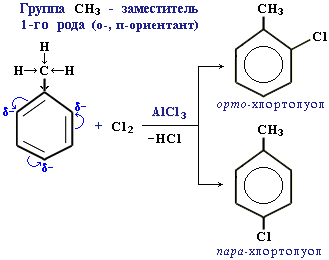 Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства: -F (+M<–I), -Cl (+M<–I), -Br (+M<–I). Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце. Ориентанты 2-го рода (мета-ориентанты) направляют последующее замещение преимущественно в мета-положение.
Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства: -F (+M<–I), -Cl (+M<–I), -Br (+M<–I). Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце. Ориентанты 2-го рода (мета-ориентанты) направляют последующее замещение преимущественно в мета-положение.
|
|
|
К ним относятся электроноакцепторные группы:
-NO2 (–M, –I); -COOH (–M, –I); -CH=O (–M, –I); -SO3H (–I); -NH3+ (–I); -CCl3 (–I).
Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто- и пара-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше.
 Все ориентанты 2-го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения. Таким образом, легкость электрофильного замещения для соединений (приведенных в качестве примеров) уменьшается в ряду: толуол C6H5CH3 > бензол C6H6 > нитробензол C6H5NO2. Если в бензольном ядре имеется не один, а два заместителя, то их ориентирующее действие может совпадать (согласованная ориентация) или не совпадать (несогласованная ориентация). В первом случае можно рассчитывать на преимущественное образование каких-то определенных изомеров, а во втором будут получаться сложные смеси.
Все ориентанты 2-го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения. Таким образом, легкость электрофильного замещения для соединений (приведенных в качестве примеров) уменьшается в ряду: толуол C6H5CH3 > бензол C6H6 > нитробензол C6H5NO2. Если в бензольном ядре имеется не один, а два заместителя, то их ориентирующее действие может совпадать (согласованная ориентация) или не совпадать (несогласованная ориентация). В первом случае можно рассчитывать на преимущественное образование каких-то определенных изомеров, а во втором будут получаться сложные смеси.
44. Гидрогенизация (гидрирование) — реакция присоединения водорода по кратной связи, обычно в присутствии катализаторов:


Отщепление водорода от соединений называется дегидрогенизацией. Гидрогенизация и дегидрогенизация связаны динамическим равновесием. Наиболее важные промышленные процессы гидрогенизация — синтез циклогексана из бензола, синтез метилового спирта из СО и Н2, синтез насыщенных жиров из ненасыщенных (получение маргарина), синтез искусственного жидкого топлива. В качестве катализаторов применяют Ni, Pt, Co, Fe, Pd, Cu, V и др. Реакция, как правило, проходит при повышенной температуре и/или повышенном давлении. Для проведения реакции в таких условиях необходим взрывобезопасный химический реактор. Также известны гомогенные катализаторы (в основном комплексы переходных металлов), например катализатор Уилкинсона RhCl•(PPh3)3. Гидрирование с применением гетерогенных катализаторов приводит к продуктам цис-присоединения водорода.
|
|
|
Также для гидрирования алкинов до алкенов может быть использован натрий в жидком аммиаке:
HCCH + 2Na +2NH3 = СН2=СН2 + 2NaNH2.
Присоединение происходит стереоселективно как транс.
Алкадиены могут быть гидрированы до алкенов с помощью натрия в Этиловом спирте:
CH2=CH-CH=CH2 + 2Na + 2C2H5OH = CH3-CH=CH-CH3. Присоединение хлора происходит к третичному углеродному атому 1 2-звеньев. Реакцию проводят пропусканием НС1 через раствор полибутадиена в ароматическом растворителе (бензоле, толуоле, ксилоле) при температуре от - 50 до 80 С. Окисление - процесс отдачи электронов, с увеличением степени окисления.При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:окислитель + e− ↔ сопряжённый восстановитель. Окисление боковых цепей в ароматических углеводородах некаталитическим путем ведет к образованию соответствующих кар-боновых кислот. Окисление боковой цепи объясняется, по-видимому, существованием активной таутомерной формы толуола.
Окисление боковых цепей в алкилбензолах в карбоксильные группы проводят чаще всего водным раствором перманганата калия.Окисление боковых цепей галогенсодержащпх гомологи бензола азотной кислотой протекает е трудом, но облегчается добавлением нитрата серебра для связывания галогена. Галоген, в ядре также нередко затрудняет окисление; он часто защищает от окисления находящуюся в орто-положении алкжльнувд группу. Замещение в алкилбензолах
|
|
|
Гомологи бензола (алкилбензолы) С6Н5–R более активно вступают в реакции замещения по сравнению с бензолом.Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
 При бромировании толуола также замещаются три атома водорода:
При бромировании толуола также замещаются три атома водорода:
 Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6:
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6:
 и облегчает замещение именно в этих положениях. Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов:
и облегчает замещение именно в этих положениях. Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов: 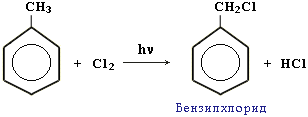 Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с p-электронной системой бензольного кольца
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с p-электронной системой бензольного кольца
45. Нафтали́н — С10Н8 твердое кристаллическое вещество с характерным запахом, в воде не растворяется, хорошо растворяется в бензоле, эфире.
 Сульфирование нафталин концентрированной H2SO4 при температуре ниже 80 °С приводит к 1-нафталинсульфокислоте, при температуре выше 150°С - к 2-нафталинсульфокислоте; при действии 20%-ного олеума при 40 °С 1-нафталинсульфокислота превращается в смесь 1,5- и 1,6-нафталиндисульфокислот, дальнейшее сульфирование которых 30%-ным олеумом при 90 °С приводит к смеси 1,3,5- и 1,3,6-нафталинтрисульфокислот. Нитрование нафталина Следует проводить в строго определенных условиях, чтобы избежать образования динитросоединений, так как нитрогрупна, введенная в одно кольцо нафталина, оказывает только слабое дезактивирующее влияние на его другое кольцо. Нафталин реагирует значительно легче, чем бензол, и лучшие результаты получаются при нитровании смесью разбавленных кислот. Нитрование нафталина проходит столь легко, что во избежание динитрации и для лучшего наблюдения за ходом процесса применяют нитрующую смесь слабее, чем при нитровании бензола. Отработанную кислоту сливают, куски нитронафталина отмывают от кислоты и гранулируют путем вливания расплавленного вещества в воду при размешивании. Нитрование нафталина всегда происходит в а-положение. Нитрование тетрагидронафталииа дает равные количества 5 - и 6-нитросоединений, которые фракционируются и дегидрогени-руются нагреванием с бромом при 100, давая а - и - нитронафта-лины. При восстановлении нафталина в подобных образуется 1,4-дигидронафталин:
Сульфирование нафталин концентрированной H2SO4 при температуре ниже 80 °С приводит к 1-нафталинсульфокислоте, при температуре выше 150°С - к 2-нафталинсульфокислоте; при действии 20%-ного олеума при 40 °С 1-нафталинсульфокислота превращается в смесь 1,5- и 1,6-нафталиндисульфокислот, дальнейшее сульфирование которых 30%-ным олеумом при 90 °С приводит к смеси 1,3,5- и 1,3,6-нафталинтрисульфокислот. Нитрование нафталина Следует проводить в строго определенных условиях, чтобы избежать образования динитросоединений, так как нитрогрупна, введенная в одно кольцо нафталина, оказывает только слабое дезактивирующее влияние на его другое кольцо. Нафталин реагирует значительно легче, чем бензол, и лучшие результаты получаются при нитровании смесью разбавленных кислот. Нитрование нафталина проходит столь легко, что во избежание динитрации и для лучшего наблюдения за ходом процесса применяют нитрующую смесь слабее, чем при нитровании бензола. Отработанную кислоту сливают, куски нитронафталина отмывают от кислоты и гранулируют путем вливания расплавленного вещества в воду при размешивании. Нитрование нафталина всегда происходит в а-положение. Нитрование тетрагидронафталииа дает равные количества 5 - и 6-нитросоединений, которые фракционируются и дегидрогени-руются нагреванием с бромом при 100, давая а - и - нитронафта-лины. При восстановлении нафталина в подобных образуется 1,4-дигидронафталин:
|
|
|
 Замещенные нафталины ведут себя подобно производным бензола: при наличие в -положении электроноакцепторной группы образуются 1,4-дигидропроизводные, а при наличии электронодонорного заместителя - 5,6-дигидропроизводные. Окисление конденсированных ароматических углеводородов приводит к различным продуктам в зависимости от используемого реагента и условий реакции. Реагенты на основе хрома (VI) в кислой среде окисляют нафталин и алкилнафталины до нафтохинонов, тогда как бихромат натрия в водном растворе окисляет только алкильные группы. Окисление нафталина перманганатом калия в щелочной среде сопровождается деструкцией одного ароматического кольца с образованием моноциклических дикарбоновых кислот:
Замещенные нафталины ведут себя подобно производным бензола: при наличие в -положении электроноакцепторной группы образуются 1,4-дигидропроизводные, а при наличии электронодонорного заместителя - 5,6-дигидропроизводные. Окисление конденсированных ароматических углеводородов приводит к различным продуктам в зависимости от используемого реагента и условий реакции. Реагенты на основе хрома (VI) в кислой среде окисляют нафталин и алкилнафталины до нафтохинонов, тогда как бихромат натрия в водном растворе окисляет только алкильные группы. Окисление нафталина перманганатом калия в щелочной среде сопровождается деструкцией одного ароматического кольца с образованием моноциклических дикарбоновых кислот: 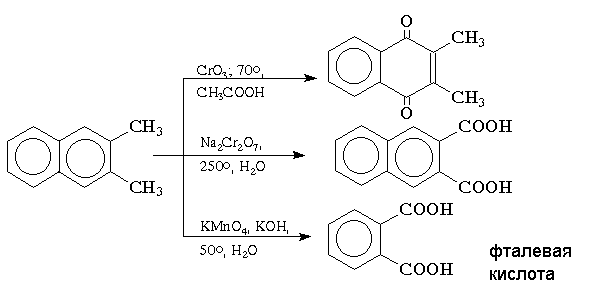
46. Галогенопроизводные углеводородов являются продуктами замещения атомов водорода на атомы галогенов: фтора, хлора, брома или йода. Галогенопроизводные имеют очень большое синтетическое значение и являются важными промышленными продуктами. Многие галогенопроизводные используются в медицине. По номенклатуре ИЮПАК положение и название галогена указывается в приставке. Нумерация начинается с того конца молекулы, к которому ближе расположен атом галогена. Если присутствует двойная или тройная связь, то она определяет начало нумерации. До сих пор широко используется т.н. “рациональная номенклатура” для составления названий галогенопроизводных. В этом случае название строится следующим образом: углеводородный радикал + галогенид. этилхлорид бутилбромид винилхлорид (ИЮПАК: хлорэтан 1-бромбутан хлорэтэн). В случае некоторых галогенопроизводных используются тривиальные названия:
CHCl3 CHBr3 CHI3
хлороформ бромоформ йодоформ.Физ-е св-ва: Температуры плавления и кипения повышаются в ряду: R-Cl, R-Br, R-I а также при увеличении количества атомов углерода в радикале. Галогенопроизводные являются гидрофобными веществами: они плохо растворяются в воде и хорошо растворяются в неполярных гидрофобных растворителях. Многие галогенопроизводные часто используются как хорошие растворители. Например, хлороформ, хлористый метилен, четырѐххлористый углерод используются для растворения масел, жиров, эфирных масел.
|
|
|
Перфторалканы (полностью фторированные алканы, “пер” означает полностью) обладают аномально высокой способностью растворять газы, например кислород.Получение: Галогенирование алканов
Реакция алканов с хлором и бромом идет на свету или при нагревании. Реакция с йодом практически не идѐт, а фтор реагирует слишком активно, поэтому для фторирования алканов используется не сам фтор, а фторид кобальта (III).
Реакции идут по механизму радикального замещения SR. Гидрогалогенирование – присоединение галогеноводородов к ненасыщенным углеводородам.
Реакция, как правило, идет по механизму электрофильного присоединения (AE). Присоединение HCl к ацетилену используется в промышленности для получения винилхлорида (хлорэтилена). Замещение гидроксигруппы спиртов на галоген
Эти реакции идут по механизму SN. Этот обмен может быть осуществлѐн действием галогеноводородных кислот в присутствии катализаторов. Декарбоксилирование солей карбоновых кислот под действием галогенов (Br2, Cl2, I2).
CH2CH2COOAgCH3+ Br2CH2CH2BrCH3+ CO2 + AgBr
Существуют разновидности этой реакции, например реакция Кочи: окислительное декарбоксилирование карбоновых кислот в присутствии галогенидов лития приводит к алкилгалогенидам.
.  Галогенопроизводные алканов (галогеналканы) имеют очень важное значение для синтеза многих соединений. Замена атомов водорода на галоген делает соединение химически активным, т.к. связь углерода с более электроотрицательным атомом галогена является полярной и довольно реакционноспособной в реакциях ионного типа. Полярность ковалентной связи, например С–Cl, приводит к смещению электронной плотности соседних связей в молекуле (индуктивный эффект).
Галогенопроизводные алканов (галогеналканы) имеют очень важное значение для синтеза многих соединений. Замена атомов водорода на галоген делает соединение химически активным, т.к. связь углерода с более электроотрицательным атомом галогена является полярной и довольно реакционноспособной в реакциях ионного типа. Полярность ковалентной связи, например С–Cl, приводит к смещению электронной плотности соседних связей в молекуле (индуктивный эффект).
Галогенопроизводные алканов широко применяются для синтеза алканов с заданным строением молекул. Для этого используется реакция взаимодействия их с активными металлами (реакция Вюрца):
 Кроме пропана C3H8 образуются бутан C4H10 (из 2-х молекул C2H5Br) и этан C2H6 (из 2-х молекул CH3Br).
Кроме пропана C3H8 образуются бутан C4H10 (из 2-х молекул C2H5Br) и этан C2H6 (из 2-х молекул CH3Br).
Для галогенпроизводных характерно замещение галогена на другие группы атомов при действии воды, оснований и солей. Эти реакции протекают по механизму нуклеофильного замещения (SN), т.к. положительно заряженный углеродный атом, связанный с галогеном, является центром атаки нуклеофильными частицами (OH-, OR-, CN-, NH2- и др.). 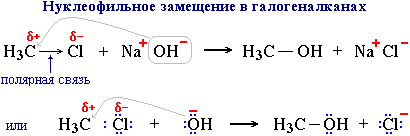 Под действием нуклеофильного реагента (донора пары электронов) OH- происходит гетеролитический разрыв полярной связи С-Cl. Электронная пара этой связи отходит к более электроотрицательному атому Cl, который превращается в анион Cl-.На лимитирующей стадии в механизме I (SN1) происходит образование карбокатиона. Чем стабильнее этот катион, тем легче он образуется. Третичный катион R3C+ стабильнее, чем вторичный R2CН+ и, тем более, первичный RCН2+ (три +I-эффекта алкильных групп R в третичном катионе, два - во вторичном и один - в первичном).
Под действием нуклеофильного реагента (донора пары электронов) OH- происходит гетеролитический разрыв полярной связи С-Cl. Электронная пара этой связи отходит к более электроотрицательному атому Cl, который превращается в анион Cl-.На лимитирующей стадии в механизме I (SN1) происходит образование карбокатиона. Чем стабильнее этот катион, тем легче он образуется. Третичный катион R3C+ стабильнее, чем вторичный R2CН+ и, тем более, первичный RCН2+ (три +I-эффекта алкильных групп R в третичном катионе, два - во вторичном и один - в первичном).
С другой стороны, энергия переходного состояния в одностадийном механизме II (SN2) тем ниже, чем меньше пространственные препятствия для его достижения, т.е. чем меньше алкильных групп у атакуемого атома углерода.
48. Элиминирование— это отщепление двух атомов или групп атомов от соседних атомов углерода с образованием между ними π-связи. Атомы углерода при элиминировании переходят из sр3- в sp2-гибридное состояние (или из sр2- в sp). Исходными веществами могут служить представители разных классов органических соединений. (р-ции отщепления), отщепление от молекулы орг. соед. частиц (атомов или атомных групп) без замены их другими. Различают и d-Э. р. При -элиминировании (отщепление частиц от одного атома) образуются валентно-ненасыщ. соед. (напр., карбены, нитрены), при -элиминировании (отщепление частиц от соседних атомов) - соед. с кратными связями (С = С, С = С, С = N, C = N), при либо -элиминировании (отщепление частиц от атомов, разделенных одним или двумя атомами) - циклич. соед. Разновидность Э. р.- выброс фрагмента из углеродной цепи или цикла с образованием новой -связи (такие р-ции иногда наз. р-циями экструзии).
Наиб. изучены р-ции -элиминирования. Для них возможны 3 механизма - Е2, Е1 и Е1 сВ (обозначение Е от англ. elimination). В р-циях бимол. элиминирования (механизм Е2) две группы отщепляются одновременно в одну стадию, при этом
протон связывается с катализатором-основанием В:
 ДЕГАЛОГЕНИРОВАНИЕ, элиминирование галогена из молекулы орг. соед. или замещение его на атом Н. Элиминирование атомов галогена может протекать с отщеплением галогена от соседних атомов С в соед. алифатич. ряда с образованием кратных связей или с отщеплением удаленных друг от друга атомов галогена с образованием циклич. соед. Дегидрата́ция — реакция отщепления воды от молекул органических соединений
ДЕГАЛОГЕНИРОВАНИЕ, элиминирование галогена из молекулы орг. соед. или замещение его на атом Н. Элиминирование атомов галогена может протекать с отщеплением галогена от соседних атомов С в соед. алифатич. ряда с образованием кратных связей или с отщеплением удаленных друг от друга атомов галогена с образованием циклич. соед. Дегидрата́ция — реакция отщепления воды от молекул органических соединений
Дегидратация спиртов:
внутренняя:C2H5OH —> CH2=CH2 + H2O (в присутствии концентрированной H2SO4)
CH3−CH(CH3)−CH(OH)−CH3 −> CH3−C(CH3)=CH−CH3 + H2O (в присутствии концентрированной H2SO4). Дегидрогалогенирование- отщепление галогеноводорода от молекулы органического соединения с образованием цикла или кратной связи между атомами. Зайцева правило, закономерность отщепления элементов галогеноводорода от алкилгалогенидов. Согласно Зайцева правило, при отщеплении от алкилгалогенида молекулы НХ (X - атом галогена) отрыв водорода происходит от того атома углерода, с которым связано наименьшее число атомов водорода, т. е. от наименее гидрогенизованного. Например, при действии на (CH3)2CHCHICH3 спиртового раствора KOH образуется в основном триметилэтилен (CH3)2C=CHCH3 и лишь незначительное количество (CH3)2CH-CH=CH2.
49. Хлорофо́рм (он же трихлормета́н или метилтрихлорид) — органическое химическое соединение с формулой CHCl3. В нормальных условиях является бесцветной летучей жидкостью c эфирным запахом и сладким вкусом. Практически нерастворим в воде, смешивается с большинством органических растворителей. Негорюч. Возможны отравления фосгеном при работе с хлороформом, который долго хранился в теплом месте. В конце XIX и начале XX веков хлороформ использовался как анестетик при проведении хирургических операций. Однако в данной роли он впоследствии был заменён более безопасными веществами. В настоящее время (2005 год) хлороформ используется при производстве фреонового хладагента R-22.
Хлороформ также используется в качестве растворителя в фармакологической промышленности, а также для производства красителей и пестицидов.Хлороформ, содержащий дейтерий (CDCl3) — наиболее общий растворитель, используемый в ядерном магнитном резонансе (ЯМР).Поступающий в продажу хлороформ содержит этиловый спирт (1-2%)в качестве стабилизатора, который связывает образующийся при длительном хранении на свету и в присутствии кислорода фосген. Иодоформ получаются из этанола или ацетона, действием иода и щелочей или карбонатов щелочных металлов:
6NaHCO3 + 4I2 + C2H5OH → CHI3↓ + HCOONa + 5NaI + 5H2O + 6CO2↑
Реакция про
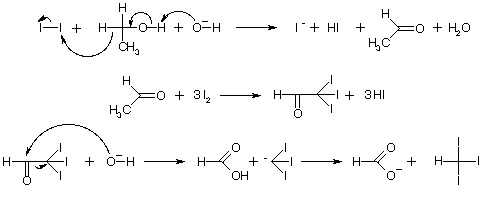 текает по следующей схеме: Иодоформ также можно получить электролизом иодида калия или натрия в спиртовом растворе. При электролизе образуются иод и щелочь, необходимые для процесса. Образующийся при реакции иодид калия (натрия) снова подвергается электролизу, и, таким образом, весь иод соли идет на образование иодоформа.Также иодоформ можно получить иодоформной пробой. В медицине иодоформ применяют как антисептик. В частности, используется для полоскания горла. Тетрахлормета́н (четырёххлористый углерод) CCl4 — бесцветная тяжёлая жидкость, по запаху напоминающая хлороформ. Негорюч. Применяется как растворитель (жиров, смол, каучука и др.), для получения фреонов, как экстрагент, в медицине.
текает по следующей схеме: Иодоформ также можно получить электролизом иодида калия или натрия в спиртовом растворе. При электролизе образуются иод и щелочь, необходимые для процесса. Образующийся при реакции иодид калия (натрия) снова подвергается электролизу, и, таким образом, весь иод соли идет на образование иодоформа.Также иодоформ можно получить иодоформной пробой. В медицине иодоформ применяют как антисептик. В частности, используется для полоскания горла. Тетрахлормета́н (четырёххлористый углерод) CCl4 — бесцветная тяжёлая жидкость, по запаху напоминающая хлороформ. Негорюч. Применяется как растворитель (жиров, смол, каучука и др.), для получения фреонов, как экстрагент, в медицине.
Тетрахлорметан являлся стандартным наполнителем переносных огнетушителей для советской бронетехники.[источник не указан 559 дней] Тушение пожара в машине требовалось выполнять в противогазах — при попадании тетрахлорида углерода на горячие поверхности происходила химическая реакция частичного замещения хлора атмосферным кислородом с образованием фосгена — сильнодействующего ядовитого вещества удушающего действия. В промышленности тетрахлорметан производят хлорированием, например, метана или хлорметана, нагревая смесь хлора и второго вещества до температуры 400—500 °C. При этой температуре происходит серия химических реакций, постепенно превращающих метан или метилхлорид в соединения с большим содержанием хлора.
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 +Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
Результатом процесса является смесь, состоящая из метилхлорида, дихлорметана, хлороформа и тетрахлорметана. Разделение веществ осуществляется дистилляцией.Хлорэтил-(хлористый этил), C2H5Cl, бесцв. легколетучая жидкость, tкип 12,27 °C. Применяется для получения тетраэтилсвинца и этилцеллюлозы; экстрагент жиров, эфирных масел; в медицине (под назв. хлорэтил) средство для поверхностного местного обезболивания. Хлористый этил - бесцветный газ, хорошо растворим в органических растворителях.
Получение. Хлористый этил получают гидрохлорированием этилена в жидкой фазе в присутствии AlCl3 при -10°C: H2C=CH2 + HCl --> H3C-CH2Cl хлорированием этана в газовой фазе в объеме; Применение. для получения тетраэтилсвинца (ТЭС). В последнее время это производство практически повсеместно прекращено по экологическим соображениям; для производства этилцеллюлозы, кремнийорганических соединений; как растворитель фосфора, серы, жиров, масел, природных смол, восков; как средство для наружного наркоза; Винилхлори́д (хло́ристый вини́л, хлорвини́л, хлорэтиле́н, хлорэте́н, этиленхлори́д) — органическое вещество; бесцветный газ со слабым сладковатым запахом, имеющий формулу C2H3Cl и представляющий собой простейшее хлорпроизводное этилена. Вещество является чрезвычайно огне- и взрывоопасным, выделяя при горении токсичные вещества. Винилхлорид — сильный яд, оказывающий на человека канцерогенное, мутагенное и тератогенное действие.Промышленное производство винилхлорида входит в первую десятку производства крупнейших многотоннажных продуктов основного органического синтеза; при этом почти весь производимый объём используется для дальнейшего синтеза полихлорвинила (ПВХ), мономером которого и является винилхлорид. Получение. Основные количества хлористого винила в промышленности получают из этилена в две стадии. На первой стадии этилен хлорируют параллельно в двух реакторах в равных пропорциях до 1,2-дихлорэтана. В одном реакторе происходит жидкофазное хлорирование молекулярным хлором, в другом - окислительное парофазное хлорирование хлористым водородом в присутствии катализатора (CuCl2). На следующей стадии дихлорэтан подвергается парофазному дегидрохлорированию в трубчатой печи при 400-550°C до винилхлорида и HCl. Реакционные газы охлаждают, отделяют от продуктов осмоления и разделяют. Получившийся хлористый водород возвращают в реактор для окислительного хлорирования этилена:
H2C=CH2 + Cl2 --> ClH2C-CH2Cl (прямое хлорирование)
H2C=CH2 + 2HCl + 1/2O2 --> ClH2C-CH2Cl + H2O (окислительное хлорирование)
ClH2C-CH2Cl --> H2C=CHCl + HCl (дегидрохлорирование)
более старый, сейчас практически не используемый способ основан на гидрохлорировании ацетилена при 150-220°C на катализаторе (активированный уголь, пропитанный раствором сулемы Hg2Cl2): HCCH + HCl --> H2C=CHCl
Применение. в основном винилхлорид используют для производства поливинилхлорида (ПВХ), а также ряда сополимеров;
как сырье для получения хлорированных углеводородов - винилиденхлорида (HCCCl) и 1,1,1-трихлорэтана (метилхлороформа), 1,2-дихлорэтана, трихлорэтилена, тетрахлорэтилена. Галотан (российское наименование — Фторотан) — мощное средство для ингаляционного наркоза, что позволяет использовать его самостоятельно (в смеси с воздухом либо кислородом) или в сочетании с другими наркотическими средствами, главным образом с закисью азота для достижения хирургической стадии наркоза. Фторотановый наркоз используют при различных операциях, в том числе полостных (на органах брюшной или грудной полости); у детей и лиц пожилого возраста; у больных бронхиальной астмой. Особенно полезно применение фторотанового наркоза в тех случаях, когда следует избегать возбуждения и напряжения пациента (например, в нейрохирургии, офтальмологии и т.п.) Невоспламеняемость препарата облегчает применение во время операции электро- и рентгеновской аппаратуры.
50.
52. Спирты́ (устар. алкого́ли, англ. alcohols; от лат. spiritus — дух) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящемся в состоянии sp³ гибридизации) атомом углерода[1]. Спирты можно рассматривать как производные воды (H−O−H), в которых один атом водорода замещен на органическую функциональную группу: R−OH.Если гидроксильная группа связана с двойной C=C связью, такие соединения называют енолы. Если гидроксильная группа связана напрямую с бензольным кольцом, такие соединения называют фенолы.
Спирты являются обширным и очень разнообразным классом органических соединений: они широко распространены в природе, имеют важнейшее промышленное значение и обладают исключительными химическими свойствами.
Спирты классифицируются следующим образом (в скобках приведены примеры)[5]:
По числу гидроксильных групп:
— одноатомные спирты (метанол);
— двухатомные спирты (этиленгликоль);
— трехатомные спирты (глицерин);
— четырёхатомные спирты (пентаэритрит);
— многоатомные спирты (пятиатомный спирт: ксилит).
трёхатомный спирт глицерин четырёхатомный спирт пентаэритрит
В зависимости от насыщенности углеводородного заместителя:
— предельные или насыщенные спирты (бутанол);
— непредельные или ненасыщенные спирты (аллиловый спирт, пропаргиловый спирт);
— ароматические спирты (бензиловый спирт).
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— алициклические спирты (циклогексанол);
— алифатические или ациклические спирты (этанол).
В зависимости от того, при каком атоме углерода находится гидроксильная группа:
— первичные спирты (пропанол);
— вторичные спирты (изопропиловый спирт);
— третичные спирты (2-метилпропан-2-ол). Систематическая номенклатура
Основная статья: Систематическая номенклатура спиртов, фенолов и их производныхПо номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого указывается арабской цифрой.Правила построения названия спиртов (функциональная группа −OH):1. Выбирается родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей функциональную группу. Он формирует базовое название (по числу атомов углерода).

 2. Родительский углеводород нумеруется в направлении, которое дает суффиксу функциональной группы самое низкое число.
2. Родительский углеводород нумеруется в направлении, которое дает суффиксу функциональной группы самое низкое число.
3. Если в соединении помимо функциональной группы имеется другой заместитель, суффикс функциональной группы получает самое низкое число.
4. Если для суффикса функциональной группы получено одно и то же число в обоих направлениях, цепь нумеруется в направлении, которое дает другому заместителю самое низкое число.
5. Если имеется несколько заместителей, они перечисляются в алфавитном порядке.
Имена заместителей ставятся перед именем родительского углеводорода, а суффикс функциональной группы — после. ИЮПАК рекомендует цифру, характеризующую положение функциональной группы, писать сразу после имени углеводородного заместителя перед суффиксом функциональной группы.
Для многоатомных спиртов перед суффиксом -ол по-гречески (-ди-, -три-, …) указывается количество гидроксильных групп (например: пропан-1,2,3-триол).
[править]
Рациональная и тривиальная номенклатура
Спирты, даже в научной литературе, часто называются по правилам, отличным от современной номенклатуры ИЮПАК. Очень распространённым является образование названия, как производного от соответствующего алкана, преобразованного в прилагательное с добавлением слова спирт:
этан С2Н6 → этиловый спирт C2H5OH;
гексан С6Н14 → гексиловый спирт C6H13OH.
Рациональная номенклатура спиртов рассматривает их как производные метанола CH3OH или по другому карбинола:
(СH3)2CНOH → диметилкарбинол;
(С6H5)3COH → трифенилкарбинол.
В популярной и научной литературе можно нередко встретить исторические или тривиальные названия спиртов, которые вследствие сложившейся традиции используются вместо официальной химической терминологии. Спирты геометрически подобны молекуле воды. Угол R−O−H в молекуле метанола равен 109°[51]. Гидроксильный кислород находится в состоянии sp³ гибридизации. Подобно воде, спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений.Так, из ряда монозамещённых производных метана, метанол имеет необычно высокую температуру кипения, несмотря на относительно небольшую молекулярную массу.
 Энергия разрыва водородной связи значительно меньше, чем обычной химической связи, но тем не менее, она существенным образом влияет на физические свойства спиртов. Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, алкилгалогениды, амины, карбонильные соединения, эпоксиды. Существует множество методов получения спиртов, среди которых выделим наиболее общие:
Энергия разрыва водородной связи значительно меньше, чем обычной химической связи, но тем не менее, она существенным образом влияет на физические свойства спиртов. Спирты могут быть получены из самых разных классов соединений, таких как углеводороды, алкилгалогениды, амины, карбонильные соединения, эпоксиды. Существует множество методов получения спиртов, среди которых выделим наиболее общие:
реакции окисления — основаны на окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные или активированные C−H связи;В качестве окислительных агентов для алканов и циклоалканов используются сильные неорганические окислители: озон, перманганат калия, оксид хрома (VI), хромовая кислота, диоксид селена, а также пероксид водорода и некоторые пероксикислоты. Из-за возможности более глубокого окисления, метод имеет значение, как правило, только для получения третичных спиртов. 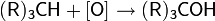 Окисление алкенов значительно более распространено в лабораторной практике, особенно когда речь идёт о получении диолов. В зависимости от выбора реагента можно осуществить син-гидроксилирование (тетраоксид осмия, перманганат калия, хлорат натрия, иод с карбоксилатом серебра и пр.) или анти-гидроксилирование (пероксид водорода и пероксикислоты, оксиды молибдена (VI) и вольфрама (VI), оксид селена (IV) и пр.)
Окисление алкенов значительно более распространено в лабораторной практике, особенно когда речь идёт о получении диолов. В зависимости от выбора реагента можно осуществить син-гидроксилирование (тетраоксид осмия, перманганат калия, хлорат натрия, иод с карбоксилатом серебра и пр.) или анти-гидроксилирование (пероксид водорода и пероксикислоты, оксиды молибдена (VI) и вольфрама (VI), оксид селена (IV) и пр.)
 Алкены также могут гидроксилироваться в аллильное положение синглетным кислородом с миграцией двойной связи и образованием гидропероксидов, которые затем восстанавливаются до спиртов.
Алкены также могут гидроксилироваться в аллильное положение синглетным кислородом с миграцией двойной связи и образованием гидропероксидов, которые затем восстанавливаются до спиртов.  реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
реакции восстановления — восстановление карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров;
Для восстановления альдегидов или кетонов, обычно, пользуются борогидридом натрия или калия, а также алюмогидридом лития в протонном растворителе.  реакции гидратации — кислотно-катализируемое присоединение воды к алкенам (гидратация);
реакции гидратации — кислотно-катализируемое присоединение воды к алкенам (гидратация);  реакции присоединения:
реакции присоединения:
присоединение синтез-газа, формальдегида, оксирана по кратным углеводородным связям;Простейший пример такой реакции — промышленный синтез метанола.  реакции замещения (гидролиза) — реакции нуклеофильного замещения, при которых имеющиеся функциональные группы замещаются на гидроксильную группу;
реакции замещения (гидролиза) — реакции нуклеофильного замещения, при которых имеющиеся функциональные группы замещаются на гидроксильную группу;
На практике для реакций замещения, как правило, используются галогенпроизводные:
 Кислотно-основные реакции спиртов.Со щелочными и щелочноземельными металлами, алюминием, галлием, таллием и некоторыми другими металлами, а также сильными основаниями (например: амидами или гидридами) спирты способны реагировать с образованием алкоголятов.
Кислотно-основные реакции спиртов.Со щелочными и щелочноземельными металлами, алюминием, галлием, таллием и некоторыми другими металлами, а также сильными основаниями (например: амидами или гидридами) спирты способны реагировать с образованием алкоголятов.  .
.

 С сильными кислотами Льюиса спирты ведут себя подобно основаниям, образуя донорно-акцепторные комплексы.
С сильными кислотами Льюиса спирты ведут себя подобно основаниям, образуя донорно-акцепторные комплексы.  Первичные и вторичные оксониевые соединения получают взаимод. спиртов, простых эфиров или кетонов с комплексными к-тами [H4Fe(CN)6, H3Fe(CN)6, H3Co(CN)6, H2PtCl6] или с гало-генидами металлов (SbCl5, FeCl3, AlCl3, SnCl4, ZnCl2) и безводным НСl. Р-цию проводят при т-ре от -70 до - 80 °С при полном отсутствии влаги, напр.:
Первичные и вторичные оксониевые соединения получают взаимод. спиртов, простых эфиров или кетонов с комплексными к-тами [H4Fe(CN)6, H3Fe(CN)6, H3Co(CN)6, H2PtCl6] или с гало-генидами металлов (SbCl5, FeCl3, AlCl3, SnCl4, ZnCl2) и безводным НСl. Р-цию проводят при т-ре от -70 до - 80 °С при полном отсутствии влаги, напр.:

53.
54. Важнейшие из многоатомных спиртов - этиленгликоль и глицерин:
 Химические свойства. Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В реакциях могут участвовать одна или две гидроксильные группы. Взаимное влияние гидроксильных групп проявляется в том, что многоатомные спирты — более сильные кислоты, чем одноатомные спирты. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. По аналогии с алкоголятями соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
Химические свойства. Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. В реакциях могут участвовать одна или две гидроксильные группы. Взаимное влияние гидроксильных групп проявляется в том, что многоатомные спирты — более сильные кислоты, чем одноатомные спирты. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. По аналогии с алкоголятями соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
Качественной реакцией на многоатомные спирты, содержащие группы ОН при соседних атомах углерода, является ярко, синее окрашивание при действии свежеосажденного гидроксида меди (II). Цвет раствора обусловлен образованием комплексного гликолята меди:
 Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина, известный под названием нитроглицерин (последнее название неверно с химической точки зрения, поскольку в нитросоединениях группа -NO2 непосредственно связана с атомом углерода):
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина, известный под названием нитроглицерин (последнее название неверно с химической точки зрения, поскольку в нитросоединениях группа -NO2 непосредственно связана с атомом углерода):

55. Окисление.
Окислители – KMnO4, K2Cr2O7+H2SO4, CuO, O2+катализатор. Легкость окисления спиртов уменьшается в ряду:
первичные ≥ вторичные >> третичные.
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
 При окислении вторичных спиртов образуются кетоны.
При окислении вторичных спиртов образуются кетоны.
 Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой). Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислением алкена. Например:
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой). Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислением алкена. Например:
 Предельное окисление гидроксисоединений до CO2 и Н2О происходит при их горении, например:
Предельное окисление гидроксисоединений до CO2 и Н2О происходит при их горении, например:
2CH3OH + 3O2 2CO2 + 4H2O. Полное окисление метанола идет схеме:
 При сгорании спиртов выделяется большое количество тепла. C2H5OH + 3O2 2CO2 + 3H2O + 1370 кДж.Окисление этанола-2СН3-СН2-ОН + О2 = 2CH3 -COH + 2H2OОкисление глицерина в тканях и клетках протекает при участии фосфорной кислоты.
При сгорании спиртов выделяется большое количество тепла. C2H5OH + 3O2 2CO2 + 3H2O + 1370 кДж.Окисление этанола-2СН3-СН2-ОН + О2 = 2CH3 -COH + 2H2OОкисление глицерина в тканях и клетках протекает при участии фосфорной кислоты.
Окисление глицерина протекает последовательно по трем спиртовым группам, что приводит к образованию разнообразных продуктов.
Окисление глицерина происходит согласно тем же правилам. Реакция идет в двух направлениях: окислению может подвергнуться в первую очередь либо первичная спиртовая группа, либо вторичная. В первом случае получается сперва глицериновый альдегид-глицероза, во втором-диокси-ацетон.
Окисление глицерина и подобных ему веществ избытком раствора перманганата в щелочной среде приводит к образованию карбоната, воды и переменных количеств щавелевой кислоты. После подкисления перманганат далее окисляет щавелевую кислоту до угольной кислоты и воды. Глицерин окисляется в известных условиях количественно. Избыток неизрасходованного перманганата определяют в подкисленном растворе титрованием щавелевой кислотой.
Окисление глицерина может быть осуществлено с помощью различных реагентов, селективно атакующих различные места в моле
|
|
|


