 |
Предельные углеводороды. Метан.
|
|
|
|
Органическая химия.
Тема 2.2. «Углеводороды»
Предельные углеводороды. Метан.
1. Метан: строение, физические и химические свойства, нахождение в природе, применение.
2. Гомологический ряд алканов: особенности строения, номенклатура, свойства, закономерности в изменении свойств.
3. Понятие о циклоалканах.
Углеводороды – органические соединения, в состав которых входит только два химических элемента – углерод и водород. Как и все органические соединения их делят на алифатические и циклические. Кроме того, их делят на предельные (насыщенные) и непредельные (ненасыщенные) углеводороды. А среди циклических выделяют еще особую группу ароматических углеводородов. Изучение органической химии всегда начинается с предельных углеводородов.
Метан (СН4) - простейший представитель предельных углеводородов. Рассмотрим гомологический ряд метана. Гомологи метана называют алканами, а также предельными и насыщенными углеводородами, потому что все связи в них одинарные (σ-связи) и к атомам углерода присоединено максимально возможное число атомов водорода. Общая формула алканов – СnH2n+2
Строение. Данные физико-химического анализа говорят о том, что молекула метана имеет форму тетраэдра, и все четыре связи углерода с атомами водорода равноценны. В 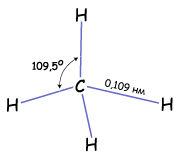
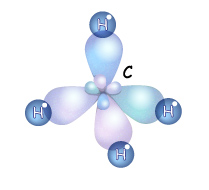 ыше мы рассматривали понятие гибридизации и ее виды. Если атом углерода находится в состоянии sp3 – гибридизации, то все четыре гибридные орбитали могут перекрываться с орбиталями атомов водорода на прямой, связывающей центры атомов углерода и водорода. Они образуют прочные
ыше мы рассматривали понятие гибридизации и ее виды. Если атом углерода находится в состоянии sp3 – гибридизации, то все четыре гибридные орбитали могут перекрываться с орбиталями атомов водорода на прямой, связывающей центры атомов углерода и водорода. Они образуют прочные  -связи (сигма-связи).
-связи (сигма-связи).

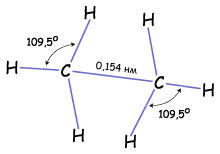
 Если хотя бы одна из гибридных орбиталей углерода образует связь не с водородом, а с гибридной орбиталью другого атома углерода, то получается молекула очень похожая по строению на метан, но немного длиннее. Таким образом, может соединиться практически любое число атомов углерода, находящихся в sp3-гибридном состоянии. Углы между связями 109о, поэтому в пространстве молекулы будут принимать зигзагообразную форму или другую форму, т.к. вокруг одинарной σ-связи возможно свободное вращение.
Если хотя бы одна из гибридных орбиталей углерода образует связь не с водородом, а с гибридной орбиталью другого атома углерода, то получается молекула очень похожая по строению на метан, но немного длиннее. Таким образом, может соединиться практически любое число атомов углерода, находящихся в sp3-гибридном состоянии. Углы между связями 109о, поэтому в пространстве молекулы будут принимать зигзагообразную форму или другую форму, т.к. вокруг одинарной σ-связи возможно свободное вращение.
|
|
|
 Но при изображении структурных формул это не учитывают, а показывают только порядок соединения атомов углерода: СН3-СН2-СН2-СН3. Каждый из последующих углеводородов будет отличаться от предыдущего на группу СН2, которую называют гомологической разностью. Связи в молекуле метана прочные, ковалентные, малополярные. И, поскольку смещение направлено от вершин тетраэдра в центр фигуры, равнодействующая будет равна 0. А это значит молекула метана неполярна, несмотря на полярность, пусть и слабую связей С-Н. Кристаллическая решетка алканов молекулярная и между молекулами очень слабое взаимодействие.
Но при изображении структурных формул это не учитывают, а показывают только порядок соединения атомов углерода: СН3-СН2-СН2-СН3. Каждый из последующих углеводородов будет отличаться от предыдущего на группу СН2, которую называют гомологической разностью. Связи в молекуле метана прочные, ковалентные, малополярные. И, поскольку смещение направлено от вершин тетраэдра в центр фигуры, равнодействующая будет равна 0. А это значит молекула метана неполярна, несмотря на полярность, пусть и слабую связей С-Н. Кристаллическая решетка алканов молекулярная и между молекулами очень слабое взаимодействие.
Номенклатура алканов. Названия алканов приведены в таблице в лекции №1. Если надо подчеркнуть неразветвленный характер цепи, то перед названием ставят букву n. Боковые цепи (углеводородные радикалы) называют как алканы, заменяя суффикс –ан, на -ил. Их перечисляют в алфавитном порядке, множительные приставки при этом не учитывают. Между цифрами ставят запятую, между цифрой и словом – дефис. 2,3-диметилбутан 2,4-диметил-3-этилгексан


Физические свойства. Метан – это газ, без цвета и запаха, температура кипения (-168 С0), почти в 2 раза легче воздуха. В воде не растворим, но растворим в органических растворителях. Рассмотрим таблицу, в которой приведены формулы и свойства первых десяти членов ряда алканов
| формула | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | С6Н14 | С7Н16 | С8Н18 | С9Н20 | С10Н22 |
| плавление кипение | -182 -162 | -183 -89 | -187 -42 | -138 -0,5 | -130 +36 | -95 +69 | -91 +98 | -57 +126 | -54 +151 | -30 +174 |
По данным таблицы видно, что с увеличением молекулярной массы возрастают температуры кипения и плавления. Т.е. при обычных условиях первые четыре гомолога (С1-С4) являются газами. Нормальные алканы с С5-С17 жидкости, с более длинной углеродной цепью – твердые вещества. При одинаковом числе атомов углерода алканы с разветвленным строением имеют менее плотную упаковку и более низкие температуры кипения, чем нормальные алканы. В воде алканы не растворяются, но хорошо смешиваются друг с другом и с другими неполярными растворителями. Плотность у них меньше, чем у воды.
|
|
|
Химические свойства. В обычных условиях алканы инертны, не взаимодействует с концентрированными кислотами и щелочами, не окисляется сильными окислителями. Русский химик М.И.Коновалов назвал их «химическими мертвецами».
1) Как и все органические вещества алканы горят. Например, метан горит
СН4 + О2 → СО2 + Н2О (это полное или жесткое окисление, ∆Н = -890 кДж/моль, голубое пламя). С воздухом метан образует взрывоопасные смеси. Это является причиной взрывов в шахтах и жилых домах.
При мягких условиях (пониженная температура, присутствие катализаторов) продуктами окисления могут быть соответствующий спирт, альдегид или кислота. Например, СН4 + О2→ СН3ОН, СН2О, НСООН
Или С3Н8 + О2 → СО2 + Н2О (полное или жесткое окисление, чем больше молекулярная масса, тем ниже температура пламени (светящееся пламя), для высших алканов характерно неполное окисление, т.е. образование СО или сажи (коптящее пламя)). Возможно для алканов и мягкое (каталитическое) окисление, при этом образуются кислородсодержащие вещества: спирты, альдегиды, кислоты.
2) Как и все органические вещества метан при нагревании без доступа воздуха подвергается термическому разложению (крекингу). Крекинг – дегидрирование (отщепление водорода) при высокой температуре.
СН4 + СН4 → СН3-СН3 + H2
СН3-СН3 → СН2=СН2 + H2
СН2=СН2 → СН  СН + Н2
СН + Н2
СH  CН→ С + Н2
CН→ С + Н2
Или СН3-СН2- СН3 → СН3-СН=СН2 + H2→…→ С + Н2
Все эти реакции идут с гомолитическим разрывом связи: А:В → А∙ + В∙, где А∙ и В∙ свободные радикалы, т.е. частицы с неспаренным электроном, химически очень активные. В принципе может быть и гетеролитический разрыв связи: А: В → А:- + В+. Но это возможно, если связь полярная или в присутствии катализаторов. Тогда при разрыве связи образуются ионы, или как принято говорить в органике, нуклеофильные и электрофильные частицы.
|
|
|
Многообразие органических соединений, огромное разнообразие электронных структур и конфигураций у этих молекул приводит к большому числу химических превращений, которые трудно сгруппировать в определенную схему. Но большинство реакций можно отнести к одному из трех типов: замещения, присоединения, распада. Только надо помнить, что в органических реакциях вещества «неравноправны». Есть «субстрат» - органическая молекула, большая и ленивая. А есть «реагент» - маленький и активный. Поэтому есть расхождения в понимании некоторых терминов с неорганической химией. Причем для всех этих типов можно выделить определенный алгоритм написания уравнений реакций. Замещение (2→2): в органической молекуле замещается атом или группа атомов, обязательно есть побочный продукт. Присоединение (2→1): к молекуле органического вещества присоединяется молекула реагента, побочных продуктов нет. Отщепление (1→2): от органической молекулы отрывается группа атомов, обычно низкомолекулярное неорганическое вещество.
Реагентов вообще-то не очень много, и названия реакций подскажет нам этого второго участника химической реакции. Например, «гидратация» - в реакции участвует вода. А «галогенирование» -?
| Классификация органических реакций |
| По электронной природе реагента: нуклеофильные электрофильные, свободнорадикальныее, протоннодонорные, окисление… |
| По изменению числа частиц в ходе реакции: замещения (S), присоединения (A), распада (E) перегруппировки… |
| По механизмам элементарных стадий: нуклеофильное замещение SN, электрофильное замещение SE, электрофильное присоединение AE, свободнорадикальное замещение SR… |
| По частным признакам: гидратация и дегидратация, гидрирование и дегидрирование,нитрование, изомеризация,окисление или восстановление, полимеризация, пиролиз… |
|
|
|
Инертность химических связей в органических соединениях обусловливает большую роль электронной природы реагента в химических реакциях. Поэтому в органической химии в дополнение к обычной классификации (реакции присоединения, замещения и т.д.) вводят понятие нуклеофильных и электрофильных реагентов. Нуклеофильные реагенты – это анионы или молекулы с повышенной электронной плотностью, имеющие пару электронов на внешнем уровне, при образовании связи выступают как доноры электронов. Например: сильные нуклеофилы – ОН-, СН3СОО-, F-, NH3, H2O, и слабые - Cl-,Br-, I-, HSO4 -. Электрофильные реагенты – это катионы водорода и металлов или молекулы, обладающие сродством к электрону, имеют свободную орбиталь на внешнем уровне, при образовании связи выступают как акцептор. Например: H+, Me+n, H2SO4, HNO3.
3) характерной для метана (и всех его гомологов) считается реакция замещения с галогенами (галогенирование). Прочные химические связи в алканах не склонны к гетеролитическому разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны реакции радикального замещения, в которых атомы водорода замещаются на другие атомы или группы атомов. Обозначаются реакции этого типа символом SR. По этому механизму легче всего происходит замещение у третичных атомов углерода, затем у вторичных и первичных. Но т.к. первичных атомов в молекуле больше, и они более доступны для атаки, то одновременно проходят несколько реакций. Галогены (фтор, хлор, бром и иод) взаимодействуют с метаном (и его гомологами!) при облучении ультрафиолетовым светом или высокой температуре.
Общая схема: СН4 → СН3Сl → СН2Сl2 → СНСl3 → ССl4
Реакция протекает по цепному механизму и может быть описана следующими стадиями:
1) инициирование (образование) цепи, т.е. образование свободного радикала, начинающего цепь происходит под действием ультрафиолета (связь в галогенах рвется легче, чем в метане) Сl2→ 2Cl.
2) рост цепи Cl. + СН4 → HCl + CH3. u CH3. + Сl2 → СН3Сl + Cl. и т.д.
Стадии 1) и 2) повторяются, пока не накопиться много свободных радикалов и не станет преобладать стадия 3) – обрыв цепи.
в) обрыв цепи Cl. + Cl. → Сl2 или CH3. + CH3. → CH3-CH3 или CH3. + Cl. → СН3Сl
Суммарное уравнение первой стадии: СН4+ Сl2 → HCl+ СН3Сl. Образующийся хлорметан СН3Сl подвергается дальнейшему хлорированию аналогичным образом. Образуется дихлорметан (СН2Сl2), трихлорметан (СНСl3 ), и наконец тетрахлорметан (ССl4).
Т.е. уравнение 2 стадии: СН3Сl+ Сl2 → HCl+ СН2Сl2
Для 3 стадии: СН2Сl2+ Сl2 → HCl+ СНСl3
Для 4 стадии: СНСl3+ Сl2 → HCl+ ССl4
|
|
|
Процесс можно изобразить схемой: СН4 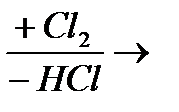 СН3Сl
СН3Сl 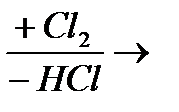 СН2Сl2
СН2Сl2 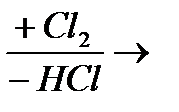 СНСl3
СНСl3 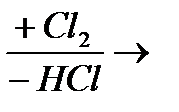 ССl4
ССl4
Реакция протекает пока не закончится хлор, продуктами реакции будет смесь хлорпроизводных метана. А если хлора будет в избытке – то пока все атомы водорода в метане не заместятся на атомы хлора. Обратите внимание: в реакциях замещения обязательно образуется побочный продукт, в реакции хлорирования – это хлороводород.
Галогенирование пропана будет проходить по следующим стадиям:
а) инициирование цепи Сl2  2Cl. (вспомните условия!)
2Cl. (вспомните условия!)
б) рост цепи Cl.+ СН3 –СН2- СН3  HCl + СН3 –СН2- CH2. u
HCl + СН3 –СН2- CH2. u
СН3 –СН2- CH2. + Сl2  СН3 –СН2- CH2Сl + Cl. (повторяются)
СН3 –СН2- CH2Сl + Cl. (повторяются)
в) обрыв цепи Cl. + Cl.  Сl2 или СН3 –СН2- CH2. + СН3 –СН2- CH2.
Сl2 или СН3 –СН2- CH2. + СН3 –СН2- CH2.  СН3 –СН2- CH2 –СН2 –СН2- CH3
СН3 –СН2- CH2 –СН2 –СН2- CH3
или СН3 –СН2- CH2. + Cl.  СН3 –СН2- CH2Сl
СН3 –СН2- CH2Сl
суммарное уравнение первой стадии: СН3 –СН2- CH3 + Сl2  HCl+ СН3 –СН2- CH2Сl
HCl+ СН3 –СН2- CH2Сl
образующийся 1-хлорпропан подвергается дальнейшему хлорированию аналогичным образом.
Нитрование алканов – тоже реакция замещения, т.е. тоже свойство, только реакция с другим реагентом. Азотная кислота может быть представлена как ОН- NO2, где нитрогруппа является свободным радикалом. Реакция протекает при повышенной температуре и давлении. Ее иногда называют реакцией Коновалова.
СН3-СН3 + НNO3 →СН3-СН2 NO2 +Н2О
4) Реакция изомеризации (возможна если в цепи 4 и более атомов углерода). Она проходит при высокой температуре, в присутствии катализатора (платина).

Нахождение алканов в природе: Метан образуется при гниении органических веществ без доступа воздуха, на болотах, в шахтах, заброшенных колодцах и т.д. Составляет основную часть природного газа (до 98%). Другие газообразные алканы входят в состав природного газа и составляют основную часть попутного газа. Попутным называют газ, растворенный в нефти. Жидкие алканы входят в состав нефти. Высшие алканы (парафины), сопутствуют нефти.
|
|
|


