 |
Вода реагирует с металлами
|
|
|
|
Билет № 24.
Вода и её свойства.
Рассмотрите состав воды, строение её молекулы, физические свойства. Составьте уравнения реакций, характеризующих химические свойства воды (разложение, взаимодействие с активными металлами и их оксидами, взаимодействие с оксидами неметаллов). Оцените значение воды в природе и в деятельности человека. Перечислите основные загрязнители природной воды. Составьте условную схему очистки сточных вод. Назовите процессы, лежащие в основе круговорота воды в природе.
Без воды не было бы жизни на Земле. Все живое нуждается в воде, которая является одновременно и важнейшей составной частью растений и животных. Наше тело примерно на 65 % состоит из воды; у некоторых медуз ее содержание доходит даже до 99 %. Если бы вода внезапно исчезла с поверхности Земли, то она превратилась бы в мертвую пустыню. Вода - уникальное вещество и все её аномальные свойства: высокая температура кипения, значительная растворяющая и диссоциирующая способность, малая теплопроводность, высокая теплота испарения и другие обусловлены строением её молекулы и пространственной структурой.
  Н Н
| 
|
  + О: + О:
| |
 Н .. Н ..
|
 Строение молекулы воды
Строение молекулы воды
 Н2О – ковалентная полярная связь
Н2О – ковалентная полярная связь

Итак, молекула воды имеет уголковое строение.
 Таким образом, обе связи в молекуле воды — ковалентные, полярные, равноценные. В то же время распределение зарядов в молекуле воды осуществляется таким образом, что формируются две противоположно заряженные области, которые находятся на некотором расстоянии друг от друга. Значит, на атоме кислорода частичный отрицательный заряд (
Таким образом, обе связи в молекуле воды — ковалентные, полярные, равноценные. В то же время распределение зарядов в молекуле воды осуществляется таким образом, что формируются две противоположно заряженные области, которые находятся на некотором расстоянии друг от друга. Значит, на атоме кислорода частичный отрицательный заряд (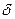 -), а на атомах водорода -
-), а на атомах водорода - 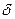 +. Следовательно, вода диполь.
+. Следовательно, вода диполь.
Угловое строение воды, а также наличие в ней противоположно заряженных центров приводит к возникновению так называемых водородных связей. Отрицательно заряженный атом кислорода одной молекулы притягивается к положительно заряженному атому водорода другой молекулы, и наоборот. Таким образом возникают межмолекулярные взаимодействия:
|
|
|
Молекулы воды оказываются ассоциированными (объединенными) посредством водородных связей. В единый комплекс объединяется по 5—7 молекул воды. Такое объединение ведет к «утяжелению» частиц вещества, что и обусловливает физические свойства воды.
 Физические свойства воды, её роль в природе.
Физические свойства воды, её роль в природе.
Н2О – жидкость без цвета и запаха, tкип. = 1000С, tплавл. = 00С,  =1г/см3
=1г/см3
· Это единственное вещество, существующее в природных условиях в трех агрегатных состояниях: твердое (льды, снег), жидкое, газообразное (туман, облака).
· Плотность воды (максимальна при +4° С) от +4 до 0° С понижается, поэтому лёд легче воды и в воде не тонет. Вода - единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твёрдом, так как структура льда более рыхлая, чем структура жидкой воды. Свойство льда иметь меньшую плотность по сравнению с плотностью жидкости не дает водоемам замерзнуть до самого дна. Под коркой льда могут зимовать рыбы и другие обитатели водоемов. Этим объясняется и то, что при замерзании объем воды увеличивается. Поэтому опасно оставлять ее в закрытом сосуде на морозе. Замерзающая вода его разорвет. Это свойство воды является причиной выветривания горных пород. Дождевая вода, попадая в щели и замерзая там, за счет своего расширения увеличивает размеры щелей, и постепенно, при многократном повторении этого процесса, даже очень твердые породы рассыпаются в песок.
· Вода обладает аномально высокой теплоемкостью 4,18 Дж/г К. Ни одно вещество не требует таких затрат теплоты для повышения его температуры на 10С. Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение её температуры. Объясняется такое явление тем, что значительная часть этой энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды. Если бы воды на Земле не было, то поверхность планеты очень сильно разогревалась бы днем, а ночью так же сильно охлаждалась. В ночное время, а также при переходе от лета к зиме вода остывает медленно: охлаждение, конденсация и кристаллизация воды сопровождается выделением тепла. Днем или при переходе от зимы к лету она медленно нагревается: при этом энергия поглощается. Это делает воду регулятором и переносчиком тепла на всей планете.
|
|
|
· Вода имеет большую теплоту испарения. Скрытая теплота испарения есть мера количества тепловой энергии, которую необходимо сообщить жидкости для её перехода в пар, то есть для преодоления сил молекулярного сцепления в жидкости. Испарение воды требует довольно значительных количеств энергии (2494 Дж/г). Это объясняется существованием водородных связей между молекулами воды. Именно в силу этого температура кипения воды - вещества со столь малыми молекулами - необычно высока.
· Вода – универсальный растворитель. Вода - превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие как соли, у которых заряженные частицы (ионы) диссоцииируют в воде, когда вещество растворяется, а также некоторые неионные соединения, например сахара и простые спирты, в молекуле которых присутствуют заряженные (полярные) группы (-OH).
Биологическая роль воды. Вода входит в состав всех клеток и тканей тела, в ней протекают все биохимические процессы. Вода служит основой крови и лимфы. Вода является той средой, где совершаются процессы пищеварения. Без воды пища не может ни проходить по желудочно-кишечному тракту, ни усваиваться организмом. На процессы пищеварения и выделения расходуется около 6 кг воды в виде поджелудочного сока, слюны, мочи, пота и др. Вода вымывает из клеток организма отработанные продукты обмена веществ и выносит их из организма. Она выносит их как через почки (с мочой), так и через кожу (с потом). Вода выступает как растворитель веществ и как переносчик веществ по организму. У нее есть еще одна важная роль: через систему потоотделения она регулирует температуру тела.
|
|
|
Химические свойства воды.
| 0 +1 +1 0 |
| 2Na + 2H2O = 2NaOH + H2 |
 в- тель Na0 – e = Na+ 2 окисление в- тель Na0 – e = Na+ 2 окисление
|
| ок- тель 2H+ + 2 e = H20 1 восстановление |
Вода реагирует с металлами
· с щелочными и щелочно-земельными при обычной температуре с образованием щелочи и водорода:
| 0 +1 t +2 0 |
 Zn + H2O = ZnO + H2 Zn + H2O = ZnO + H2
|
| в- тель Zn0 – 2 e = Zn2+ 1 окисление |
| ок- тель 2H+ + 2 e = H20 1 восстановление |
· с металлами средней активности при нагревании с образованием оксида металла и водорода:
· малоактивные металлы с водой не реагируют
2. Вода взаимодействует с основными и кислотными оксидами с образованием соответственно щелочей и кислот: Na2O + H2O = 2NaOH гидроксид натрия (реагируют только оксиды щелочных и щелочно-земельных металлов); P2O5 +3H2O = 2H3PO4 ортофосфорная кислота (не реагирует с водой оксид кремния)
| Al4C3 + 12HOH = 4Al(OH)3 + 3CH4 |
| карбид алюминия метан |
| K4Si + 4HOH = 4KOH + SiH4 |
| силицид калия силан |
3. Вода разлагает бинарные соединения (необратимый гидролиз):
| +1 -2 ток 0 0 |
| 2H2O = O2 + 2H2 |
 в- тель 2О-2 –4 e = О20 1 окисление в- тель 2О-2 –4 e = О20 1 окисление
|
| ок- тель 2H+ + 2 e = H20 2 восстановление |
4. Под действием электрического тока (электролиз) вода разлагается на кислород и водород:
Основные потребители воды: коммунальное хозяйство, сельское хозяйство, энергетика (гидроэлектростанции), металлургия и другие отрасли промышленности.
К основным загрязнителям воды относятся: промышленные и бытовые стоки, твердые отходы, отходы сельского хозяйства (удобрения), естественные примеси, радиоактивные и тепловые загрязнители.
Очистка воды производится в промышленных масштабах на очистных сооружениях. В общем случае очистка воды включает три стадии:1)первичная очистка проводится с целью удаления механических примесей (отстаивание, фильтрование); 2) вторичная очистка, при которой происходит разложение содержащихся органических веществ под действием микроорганизмов или хлора (обеззараживание); 3) третичная очистка включает биологическую, химическую и физическую обработку вод. Эта стадия позволяет довести сточные и природные воды до такого уровня чистоты, что она отвечает стандартам на питьевую воду.
|
|
|
Круговорот воды в природе. Вода встречается на Земле почти повсеместно, 70 % земной поверхности занимает мировой океан; более 1,5 триллионов тонн воды содержатся в этом гигантском резервуаре. Под влиянием солнечного тепла часть морской воды постоянно испаряется, а образующийся водяной пар поднимается в воздух. Если воздух, содержащий водяной пар, охладится, то выделятся мельчайшие водяные капельки (конденсация). Из таких капелек состоят облака, которые переносятся потоками ветра с моря на континент. При определенных условиях мелкие капельки сливаются в более крупные, и на Землю выпадает дождь, снег или град. Почва впитывает эти осадки и собирает их в грунтовые воды. Избыток воды пробивается из почвы в виде родников, из них вытекают ручьи, сливающиеся в малые и большие реки. А реки несут воду опять в море, и так завершается этот круговорот воды в природе.
|
|
|


