 |
Материалы, необходимые для проведения исследования методом ПЦР
|
|
|
|
Материалы и оборудование для этапа экстракции ДНК
1) Комплекты реагентов для выделения РНК/ДНК, разрешенные для применения в установленном порядке и рекомендованные в инструкциях наборов реагентов для ПЦР-диагностики коклюша и паракоклюша.
2) Ламинарный бокс, класс биологической безопасности II тип А.
3) Термостат для пробирок типа «Эппендорф» от 25 до 100 °С.
4) Микроцентрифуга для пробирок типа «Эппендорф» до 16 тыс. об./мин.
5) Вортекс.
6) Вакуумный отсасыватель медицинский с колбой-ловушкой для удаления надосадочной жидкости.
7) Набор электронных или механических дозаторов переменного объема от 10 до 200 мкл и от 100 до 1 000 мкл.
8) Одноразовые полипропиленовые плотно закрывающиеся микропробирки объемом 1,5 мл.
9) Одноразовые наконечники для дозаторов переменного объема с аэрозольным барьером до 200 и до 1 000 мкл.
10) Одноразовые наконечники для дозаторов переменного объема до 10 и 200 мкл.
11) Штативы для микропробирок объемом 1,5 мл и наконечников.
12) Холодильник от 2 до 8 °С с морозильной камерой не выше минус 16 °С.
13) Отдельный халат и одноразовые перчатки.
14) Емкость с дезинфицирующим раствором.
Материалы и оборудование для этапа постановки ПЦР
с детекцией в режиме реального времени
1) Наборы реагентов для выявления и дифференциации ДНК возбудителей коклюша (Bordetella pertussis), паракоклюша (Bordetella para pertussis) и бронхисептикоза (Bordetella bronchiseptica) в биологическом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией, разрешенные к применению в установленном порядке.
2) Бокс абактериальной воздушной среды (ПЦР-бокс).
3) Центрифуга/вортекс.
4) Автоматические и электронные дозаторы переменного объема (от 5 до 20 мкл, от 20 до 200 мкл).
|
|
|
5) Одноразовые наконечники с фильтром до 10, 100, 200 мкл.
6) Штативы для пробирок объемом 0,2 мл или 0,1 мл.
7) Холодильник от 2 до 8 °С с морозильной камерой не выше минус 16 °С для выделенных проб ДНК.
8) Отдельный халат, шапочки, обувь и одноразовые перчатки по МУ 1.3.2569—09.
9) Емкость для сброса наконечников.
10) Программируемый амплификатор роторного типа или амплификатор планшетного типа, рекомендованные в инструкциях и методических рекомендациях по применению используемого набора реагентов для ПЦР с детекцией в режиме реального времени.
11) Одноразовые полипропиленовые тонкостенные пробирки для ПЦР в соответствии с инструкцией по применению используемого набора реагентов объемом:
а) 0,2 мл или 0,1 мл с плоской крышкой – при использовании прибора роторного типа для ПЦР с детекцией в режиме реального времени;
б) 0,2 мл с выпуклой крышкой – при использовании прибора планшетного типа для ПЦР с детекцией в режиме реального времени;
в) 0,1 мл в стрипах по 4 шт. с крышками – при использовании прибора роторного типа для ПЦР с детекцией в режиме реального времени.
Материалы и оборудование для этапа постановки ПЦР
с детекцией методом электрофореза
Для проведения амплификации
1) Амплификатор для пробирок 0,5 мл или 0,2 мл.
2) ПЦР-бокс.
3) Термостат для пробирок типа «Эппендорф» от 25 до 100 °С.
4) Вортекс.
5) Набор электронных или механических дозаторов переменного объема.
6) Одноразовые полипропиленовые пробирки для ПЦР на 0,5 (0,2) мл.
7) Одноразовые наконечники с фильтром до 200 мкл.
8) Штативы для наконечников и пробирок на 0,5 (0,2) мл.
9) Холодильник от 2 до 8 °С с морозильной камерой не выше минус 16 °С.
10) Отдельный халат и одноразовые перчатки.
11) Емкость для сброса наконечников.
Для детекции продуктов ПЦР методом электрофореза в агарозном геле
1) Камера для горизонтального электрофореза объёмом не более 400 мл.
|
|
|
2) Источник постоянного тока с напряжением 150—460 В.
3) Ультрафиолетовый трансиллюминатор с кабинетом для просмотра гелей.
4) Видеосистема с цифровой камерой для регистрации результатов и передачи изображения.
5) Аквадистиллятор.
6) Холодильник от 2 до 8 °С.
7) Микроволновая печь для плавления агарозы.
8) Колба коническая из термостойкого стекла на 250 мл (ГОСТ 21400—75) для плавления агарозы.
9) Мерный цилиндр на 1 л (ГОСТ 1770—74).
10) Штатив для пробирок на 0,5 (0,2) мл.
11) Отдельный механический или электронный дозатор объемом 10—40 мкл.
12) Одноразовые наконечники до 200 мкл в штативе.
13) Пластиковая ёмкость на 5 л для дезактивации буфера и гелей, содержащих бромид этидия.
14) Отдельный халат и одноразовые перчатки.
8. Серологические методы исследования
В условиях массовой вакцинопрофилактики существенно снизилось число тяжелых форм заболевания, участились случаи позднего обращения за медицинской помощью, нередко уже на фоне проводимой антибактериальной терапии. При этом возросло значение серологических методов как средств поздней (ретроспективной) диагностики.
Обнаружение специфических антител к возбудителям коклюша проводится с использованием реакции агглютинации (РА) и иммуноферментного анализа (ИФА). В РА обнаруживаются представленные в крови агглютинирующие антитела к B. pertussis и B. parapertussis. ИФА позволяет обнаруживать антитела классов IgM, IgA и IgG к различным антигенам B. pertussis (чаще к коклюшному токсину (PT) и филаментозному гемагглютинину (FHA), наибольшей специфичностью обладают антитела к PT).
При первичной инфекции антитела классов IgM и IgA образуются не раньше второй недели от появления клинических симптомов, спустя еще 1 неделю начинают обнаруживаться и антитела класса IgG, достигая своего максимума к 6—8 неделе, после чего их уровень снижается. IgG-антитела могут выявляться до достижения взрослого возраста в низкой концентрации. В связи с этим серологическую диагностику коклюша и паракоклюша целесообразно применять не ранее второй недели болезни; оптимальные сроки для серологической диагностики – с 3 по 6 неделю заболевания. После вакцинации образуются антитела класса IgG. Поэтому в течение 1 года после вакцинации серологическое исследование в диагностических целях проводить не рекомендуется, а у детей, вакцинированных против коклюша, и у взрослых для серологической диагностики необходимо использовать только парные сыворотки крови, полученные с интервалом минимум 2 недели. При исследовании однократно взятой сыворотки результат по обнаружению антител класса IgG может быть расценен как положительный только в случае высокого титра, при этом значения, которые считаются высоким титром, могут варьировать в наборах реагентов разных производителей, и их следует уточнить в инструкции по применению используемого диагностического набора.
|
|
|
Обнаружение значимого уровня IgM (с различными комбинациями IgG или IgA) у непривитых детей и взрослых следует расценивать как острую инфекцию. Однако у некоторых пациентов при острой инфекции антитела класса IgM определяются на низком уровне. Дети младше 6 месяцев могут не отвечать на инфекцию выработкой антител класса IgA, поэтому отрицательный результат IgA у детей данного возраста не означает отсутствие заболевания.
В качестве подтверждающего теста для образцов с пограничными или положительными результатами, полученными в ИФА, может быть использован метод иммуноблота, в котором определяются антитела класса IgG и IgA с использованием антигенов Bordetella pertussis (PT в двух концентрациях и FHA).
Диагностическим титром в РА у не привитых и не болевших ранее коклюшем детей считают разведение 1: 80. У иммунизированных детей и взрослых положительные результаты РА учитывают только при исследовании парных сывороток при нарастании титра не менее чем в 4 раза. Следует учитывать, что у детей в возрасте до 3 месяцев собственные антитела не вырабатываются, но могут присутствовать материнские антитела, которые, как правило, определяются в низких титрах.
С целью определения защитного титра антител серологическое исследование проводят через 1,5 месяца после третьей вакцинации или ревакцинации с использованием РА при иммунизации вакциной с цельноклеточным коклюшным компонентом (н.-р., АКДС), ИФА с определением антител класса G к PT (или PT и FHA) – при иммунизации бесклеточной вакциной (н.-р., Инфанрикс, Пентаксим).
|
|
|
8.1. Взятие материала
Взятие крови (для ИФА обязательно натощак) проводят из вены в объеме 3—4 мл или из подушечки третьей фаланги среднего пальца в объеме 0,5—1,0 мл (у детей младшего возраста) в одноразовую пластиковую пробирку без антикоагулянта.
Взятие крови из локтевой вены для получения сыворотки производят одноразовой иглой (диаметр 0,8—1,1 мм) в пробирку типа Vacuetteâ без антикоагулянта или одноразовый шприц объемом 5 мл. При заборе в шприц кровь из него аккуратно (без образования пены) переносят в одноразовую стеклянную пробирку. Капиллярную кровь берут из пальца в асептических условиях в пробирки без антикоагулянта. Перед взятием крови кисть руки пациента согревают горячей водой, затем насухо вытирают. Подушечку пальца протирают 70°-м спиртом и прокалывают стерильным скарификатором одноразового использования. Кровь собирают непосредственно через край стерильной одноразовой центрифужной пробирки. После взятия крови место укола смазывают 5 %-м раствором йода. Пробы крови, взятые без антикоагулянта, отстаивают при комнатной температуре в течение 30 мин или помещают в термостат при 37 °С на 15 мин.Затем проводится центрифугирование в течение 10 мин при 3 000 об./мин. По окончании центрифугирования сыворотка переносится в стерильные пробирки с использованием для каждого образца отдельного наконечника с аэрозольным барьером.
8.2. Доставка и хранение материала
Срок хранения крови – не более 6 ч. Сыворотка крови хранится при комнатной температуре в течение 6 ч, при температуре 4—8 °С – в течение 5 сут., более длительно – при температуре не выше минус 16 °С. Многократное замораживание / размораживание сыворотки крови недопустимо.
Каждую пробирку маркируют в соответствии с прилагаемым в сопроводительном документе списком и помещают в полиэтиленовый пакет подходящего размера с ватой (или другим гигроскопичным материалом) в количестве, достаточном для адсорбции всего образца в случае его утечки, и герметично закрывают. Допустимо транспортировать образцы от разных пациентов в одном пакете. Направление материала на исследование оформляется согласно п. 5.3.
Полиэтиленовые пакеты помещают в термоизолирующий контейнер (сумка-холодильник), приспособленный для транспортирования биологических материалов и транспортируют при температуре от 4 до 8 °С. При транспортировании и хранении крови в зимнее время года необходимо создать условия, при которых не происходит ее замораживание.
Пакеты с материалом для ПЦР и серологического исследования могут транспортироваться в одном термоизолирующем контейнере.
|
|
|
8.3. Реакция агглютинации
При использовании РА серологическое исследование сыворотки крови следует проводить одновременно на коклюш и паракоклюш с использованием диагностических наборов, разрешенных в установленном порядке, согласно инструкции производителя.
Из исследуемой сыворотки готовят 9—10 последующих разведений: 1: 5, 1: 10 и так далее до 1: 1 280 или 1: 2 560. В 10-ю (или 11-ю) пробирку наливают вместо сыворотки 0,25 мл физиологического раствора (контроль). Реакцию агглютинации ставят в объеме 0,5 мл: к 0,25 мл соответствующего разведения сыворотки добавляют 0,5 мл диагностикума. Пробирки помещают в термостат при 37 °С на 2 ч и затем оставляют при комнатной температуре. Результаты учитывают на следующий день с помощью агглютиноскопа. Реакция учитывается как положительная при наличии в пробирке четкой агглютинации на четыре или три креста (4+ или 3+).
Диагностическим титром реакции агглютинации у непривитых и неболевших детей считают разведение 1: 80. У иммунизированных детей и взрослых положительные результаты реакции учитывают только при исследовании парных сывороток крови, взятых с интервалом не менее чем 2 недели при нарастании титра не менее чем в 4 раза.
Материалы и оборудование для серологического исследования методом РА
1) 0,9 %-й раствор натрия хлорида рН (7,0 ± 0,2) (ГОСТ 4233).
2) Пробирки для агглютинации, ГОСТ 25336—82.
3) Термостат, обеспечивающий температуру (36 ± 1) °С.
4) Пипетки, ГОСТ 29227—91.
5) Агглютиноскоп.
6) Диагностикум коклюшный жидкий для реакции агглютинации.
7) Диагностикум паракоклюшный жидкий для реакции агглютинации.
8) Одноразовые перчатки.
8.4. Иммуноферментный анализ
Серологическую диагностику методом ИФА проводят с использованием наборов реагентов, разрешенных для применения в установленном порядке, в качественном, полуколичественном и количественном форматах. Для исследования используется сыворотка крови, все манипуляции и интерпретация результатов проводятся по инструкции изготовителя диагностического набора. Результаты учитываются на спектрофотометре при длине волны 450/620 нм. Расчеты проводятся графоаналитическим методом. Не рекомендуется использование мутных вследствие липемии или загрязненных образцов. Присутствие взвеси или преципитата в сыворотке может быть причиной получения неправильных результатов. Такие образцы перед исследованием должны быть центрифугированы или профильтрованы.
Материалы и оборудование для серологического исследования методом ИФА
1) Наборы реагентов для определения антител (IgG, IgA, IgM) к Bordetella pertussis или отдельным антигенам методом ИФА (Anti-Bordetella pertussis toxin ELISA, Bordetella pertussis/toxin ELISA и др.), разрешенные для применения в установленном порядке.
2) Чистые пробирки для разведения образцов сыворотки.
3) Одноразовая пластиковая посуда для разведения концентрата конъюгата.
4) Калиброванные дозаторы и многоканальные дозаторы (диапазоны объемов 5-50, 50-200 и 200-1 000 мкл) и одноразовые сменные наконечники.
5) Мерные цилиндры объемом 50 мл и 1 л, ГОСТ 1770—74.
6) Бутыль для промывочного буфера.
7) Фильтровальная бумага.
8) Вортекс.
9) Водяная баня 37 °C с крышкой или влажная камера, помещенная в инкубатор при 37 °C.
10) ИФА-анализатор с возможностью измерений при 450 и 620 нм.
11) Дистиллированная или дважды деионизированная вода, ГОСТ 6709—72.
12) Одноразовые перчатки.
8.5. Иммуноблот
В качестве подтверждающего теста для образцов с пограничными или положительными результатами, полученными в ИФА, или для самостоятельной диагностики может быть использован метод иммуноблота, в котором определяются антитела класса IgG и IgA в сыворотке крови с использованием антигенов Bordetella pertussis (PT в двух концентрациях и FHA).
Принцип исследования заключается в проведении реакции связывания специфических антител с высоко очищенными рекомбинантными антигенами, нанесенными в виде полос на стрипы из нитроцеллюлозной мембраны, предварительно обработанной раствором белка, с целью блокировки свободных сайтов неспецифического связывания иммуноглобулинов. В ходе анализа стрипы инкубируют с разведенными образцами сыворотки крови человека. Если в образце присутствуют специфические антитела, то во время инкубации они связываются с антигенами, фиксированными на стрипе. После промывки стрипы инкубируют с антителами к IgG или IgA человека, конъюгированными с пероксидазой хрена, и повторяют промывку. Специфически связанные антитела выявляют с помощью цветной реакции, добавляя субстрат, взаимодействующий с пероксидазой хрена. Проявляющиеся темные полосы в соответствующем месте стрипа указывают на присутствие комплекса антиген-антитело. Коклюшный токсин нанесен на стрип в двух концентрациях – PT и PT-100. Концентрация PT стандартизована: положительная реакция на IgG (появление полосы) при взаимодействии исследуемой сыворотки с PT-100 означает, что уровень IgG в сыворотке превышает 100 МЕ/мл по стандарту ВОЗ.
Контроль реакции проводится с использованием четырех полос (бенда), расположенных параллельно одна за другой на верхнем краю стрипа:
1) полоса положительного контроля реакции, которая должна присутствовать при анализе каждой сыворотки;
2) две полосы положительного контроля конъюгата (IgG/IgA), которые служат контролями выявления каждого класса антител;
3) «контроль Cut-off» (для контроля реакции окрашивания): интенсивность этой полосы является основной для оценки реактивности антител и интерпретации результата анализа конкретного стрипа.
Результаты анализа учитываются только в случае получения адекватных результатов контролей. Интенсивность полос зависит от концентрации антител, специфичных к Bordetella pertussis, присутствующих в исследуемой сыворотке, оценка результата проводится по отношению к интенсивности полосы Сut-off.
Положительная реакция по обнаружению IgG к PT в титре более 100 МЕ/мл стандарта ВОЗ может расцениваться как признак острой инфекции у не вакцинированных детей или вакцинированных более трех лет назад. В остальных случаях рекомендуется повторное исследование сыворотки или плазмы крови, взятой через 2 недели после первой.
Материалы и оборудование для серологического исследования методом иммуноблота
1) Наборы реагентов для определения антител (IgG, IgA) к антигенам Bordetella pertussis методом иммуноблота, разрешенные для применения в установленном порядке.
2) Деионизированная вода.
3) Вакуумный насос.
4) Микродозаторы на 20 и 1 000 мкл с одноразовыми наконечниками.
5) Пластиковые пинцеты.
6) Горизонтальный шейкер.
7) Вортекс.
8) Фильтровальная бумага, ГОСТ 12026.
9) Одноразовые перчатки.
10) Мерный градуированный цилиндр на 50 и 1 000 мл, ГОСТ 1770—74.
11) Одноразовые лотки для инкубации.
9. Нормативно-методические ссылки
1. СП 1.3.2322—08 «Безопасность работы с микроорганизмами III—IV групп патогенности (опасности) и возбудителями паразитарных болезней».
2. СП 1.2.036—95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I—IV групп патогенности».
3. СанПиН 2.1.7.2790—10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами».
4. МУК 4.2.2316—08 «Методы контроля бактериологических питательных сред».
5. СП 3.1.2.1320—03 «Профилактика коклюшной инфекции».
6. МУ 3.1.2.2160—07 «Эпидемиологический надзор за коклюшной инфекцией».
7. МУ 1.3.2569—09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I—IV групп патогенности».
8. МУ 3.1.2943—11 «Организация и проведение серологического мониторинга состояния коллективного иммунитета к инфекциям, управляемым средствами специфической профилактики (дифтерия, столбняк, коклюш, корь, краснуха, эпидемический паротит, полиомиелит, гепатит B)».
Приложение 1
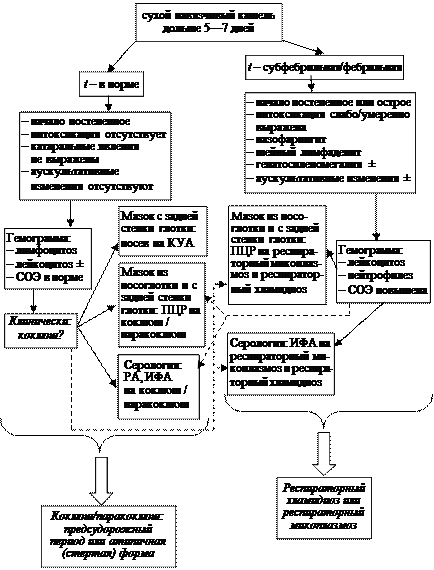
Алгоритм выбора метода лабораторной диагностики
Приложение 2
Приготовление и стерилизация тампонов
А. Сухие ватные тампоны: на один конец металлической легко сгибающейся проволоки плотно наматывают слой гигроскопической ваты. Длина намотки должна быть равной 4—5 см (во избежание аспирации ваты). Затем конец проволоки с намоткой ваты (1—2 см) изгибают под тупым углом 110—120°. Другой конец проволоки монтируют в корковую или ватную пробку. Изготовленный тампон помещают в пробирку и стерилизуют в автоклаве при 112 °С в течение 30 мин или в сушильном шкафу при температуре 140—150 °С в течение часа.
Б. Увлажненные тампоны: готовят из легкосгибающейся нержавеющей проволоки (лучше алюминиевой). Намотку ваты, сгибание и стерилизацию проводят так же, как указано для сухих тампонов. Стерильные тампоны перед употреблением смачивают в забуференной смеси путем двукратного погружения в пробирку с жидкостью. После смачивания тампона его помещают в пробирку, а затем используют для взятия материала. Хранить 3 дня в условиях холодильника.
Раствор для смачивания тампонов (по прописи Е.А. Кузнецова)
В конической колбе смешивают 90—95 мл предварительно приготовленного раствора Na2HPO4 (11,876 г на 1 л дистиллированной воды) и 5—10 мл раствора KH2PO4 (9,078 г на 1 л дистиллированной воды); к этой смеси добавляют 0,5 г агар-агара, стерилизуют при 1 атм. 20 мин. Затем в горячую смесь добавляют 0,2 г активированного угля (навеску угля стерилизуют отдельно). Смесь готовят впрок и хранят в холодильнике до 2 месяцев.
Приложение 3
Приготовление питательных сред с добавками
В качестве питательной среды для посева исследуемого материала применяют картофельно-глицериновый агар (среда Борде-Жангу) и казеиново-угольный агар (КУА). Среды могут быть приобретены и приготовлены согласно инструкции производителя. Для улучшения роста при необходимости в среду можно добавить до автоклавирования активированный уголь (0,5 %) и дрожжевой диализат или экстракт (50 мл на 1 л среды), предварительно нейтрализованный до pH 7,0 (по бромтимоловому синему до зеленого цвета), а также пролин или глютамин (0,03 г на 1 л среды).
Ростовые добавки вносятся в стерилизованную и остуженную до температуры 50 °С среду. Оптимально добавлять в среды дефибринированную лошадиную или баранью кровь: в среду Борде-Жангу – 20 %, в КУА – 10 %. Добавление человеческой крови или эритроцитарной массы дает худшие результаты, их можно частично (5 %) заменить сывороткой крупного рогатого скота (можно также добавить 1 % питательной среды № 199).
Для подавления посторонней микрофлоры при посеве исследуемого материала используют пенициллин или бициллин. Их применяют как при обработке поверхности питательной среды, разлитой в чашки Петри, так и при внесении антибиотика в среду. В мировой практике для этих целей используется цефалексин, который, в отличие от пенициллина, не подавляет рост B. pertussis и более эффективен в отношении сопутствующей флоры.
Пенициллин
Для обработки поверхности среды используют антибиотик из расчета 7,5 МЕ, нанося его на поверхность среды шпателем или внося его в КУА, растопленный и остуженный до температуры 50 °С, из расчета 30 МЕ на 100 мл среды.
Пенициллин разводят непосредственно перед взятием материала. Для этого во флакон с антибиотиком добавляют стерильный физиологический раствор для получения основного разведения пенициллина. При содержании во флаконе 500 000 МЕ в него добавляют 1 мл физиологического раствора, а при содержании 1 млн МЕ – 2 мл. Полученное основное разведение антибиотика во флаконе можно хранить в условиях холодильника при 4 °C не более недели. Для получения необходимых для работы концентраций антибиотика 0,1 мл основного разведения из флакона (50 000 МЕ) растворяют в 9,9 мл стерильного физиологического раствора; 1 мл такого раствора содержит 5 000 МЕ на 1 мл. Далее делают разведения до получения 75 МЕ в 1 мл физиологического раствора.
Схема разведения пенициллина или бициллина:
1 пробирка – физиологический раствор 9,9 мл + 0,1 мл основного разведения антибиотика = в 1 мл 5 000 МЕ;
2 пробирка – физиологический раствор 8,5 мл + 1,5 мл раствора из 1 пробирки = в 1 мл 750 МЕ;
3 пробирка – физиологический раствор 4,5 мл + 0,5 мл раствора из 2 пробирки = в 1 мл 75 МЕ.
Из третьей пробирки наносят 0,1 мл (7,5 МЕ) на поверхность питательной среды в каждой чашке, тщательно втирая шпателем.
Раствор из третьей пробирки можно использовать для внесения его внутрь среды. Для этого 4 мл (300 МЕ) антибиотика добавляют на 1 л среды (из расчета 30 МЕ на 100 мл среды). Это же разведение можно использовать для добавления к смачивающим жидкостям из расчета 0,1 мл на 10—12 мл жидкости. Рабочее разведение антибиотика (в последней пробирке) используют только в день приготовления.
Цефалексин используется в концентрации 40 мг/л среды. Он производится как селективная добавка для бордетелл (Bordetella selective supplement). Содержимое одного флакона (20 мг цефалексина) асептически растворяется в 2 мл стерильной дистиллированной воды и добавляется к 500 мл стерильной остуженной до температуры 50 °С питательной среды.
Приложение 4
Определение содержания аминного азота
Определение содержания аминного азота в питательных средах проводят методом формольного титрования. Принцип метода основан на блокировании формальдегидом при pH 7,0 свободных аминогрупп и титровании щелочью эквивалентного количества карбоксильных групп. Начало и конец титрования определяют потенциометрически.
Реактивы: 1) натрия гидроксид (0,1 моль/л) или раствор соляной кислоты (0,1 моль/л);
2) натрия гидроксид 10 %-й раствор;
3) раствор формалина (40 %-й раствор формальдегида) (ГОСТ 1625—75), перед каждым определением pH формалина доводят до pH 7,0 10 %-м раствором натрия гидроксида.
Ход определения
В стакан вместимостью 50 мл наливают необходимый объем (А) (подготовка проб см. примечания 1 и 2) анализируемого раствора препарата, содержащего 1,5—5,0 мг аминного азота, и доводят общий объем дистиллированной водой до 20 мл. Электроды потенциометра погружают в исследуемый раствор, pH которого доводят до значения 7,0 с помощью раствора натрия гидроксида (0,1 моль/л) или раствора соляной кислоты (0,1 моль/л). В ходе определения электроды должны все время оставаться погруженными в раствор. К нейтрализованному раствору добавляют 2 мл нейтрального формалина, перемешивают и, не вынимая электроды, титруют содержимое раствором натрия гидроксида (0,1 моль/л) до pH 9,1. При титровании следует использовать бюретку вместимостью 5 мл. Проводят два параллельных измерения. Содержание аминного азота в исследуемом препарате в процентах (X) вычисляют по следующим формулам.
1) Для сухого образца: X = V ´ K ´ 1,4 ´ 100 / C, где:
V – количество раствора натрия гидроксида (0,1 моль/л) в миллилитрах, пошедшее на титрование испытуемой пробы от pH 7,0 до 9,1;
К – поправка к титру раствора натрия гидроксида (0,1 моль/л);
1,4 – количество аминного азота в миллиграммах, эквивалентное 1,0 мл раствора натрия гидроксида (0,1 моль/л);
С – анализируемая навеска сухого препарата в миллиграммах, содержащаяся в титруемом объеме «А»;
100 – коэффициент пересчета миллиграммов в проценты.
2) Для жидкого образца: X = V ´ K ´ 1,4 ´ 100 / A ´ 1 000, где:
А – количество жидкого образца (мл), взятого на анализ;
100 – коэффициент пересчета миллиграммов в проценты;
1 000 – коэффициент пересчета миллиграммов в граммы.
Примечание 1.
Для сухих образцов (гидролизаты, экстракты, среды (1,5—4,0 % аминного азота) – «А» = 10 мл 1 %-го раствора (анализируемая навеска образца «С» составляет соответственно 100 мг).
Примечание 2.
Для жидких гидролизатов низкой степени расщепления (0,1—0,2 % аминного азота) «А» = 3 мл; для жидких гидролизатов средней степени расщепления (0,3—0,6 % аминного азота) «А» = 1 мл; для жидких гидролизатов высокой степени расщепления (0,7—1,3 % аминного азота) «А» = 0,5 мл; для жидких питательных сред (0,08—0,14 % аминного азота) «А» = 10 мл; для готовых плотных агаровых сред «А» = 3 мл препарата, расплавленного в кипящей водяной бане.
Приложение 5
Проверка качества казеиново-угольного агара
В связи с довольно сложным составом казеиново-угольной среды и большой чувствительностью ее к режиму стерилизации следует периодически проверять качество готовой среды. Для этой цели необходимо пользоваться свежевыделенными культурами коклюшного микроба. В стерильных пробирках делают 8 различных разведений взвеси
2—3-суточной культуры. Густота взвеси в первой пробирке должна соответствовать 5 млрд микробных тел в 1 мл по стандарту мутности для коклюшных микробов. Во 2—6-ю пробирки наливают по 4,5 мл стерильного физиологического раствора, в 7-ю наливают 2 мл и в 8-ю – 1 мл. Поверхность одной или двух чашек Петри с используемой средой делят на 2—4 или 8 секторов (в зависимости от питательной среды): 0,5 мл взвеси из 1-й пробирки переносят стерильной пипеткой во 2-ю пробирку и этой же пипеткой наносят 0,1 мл взвеси на сектор 1. Другой стерильной пипеткой перемешивают содержимое второй пробирки (вдуванием и выдуванием), переносят из нее 0,5 мл в 3-ю пробирку и 0,1 мл наносят на сектор 2 и т. д. Для каждого разведения следует употреблять отдельную стерильную пипетку, перемешивая ею содержимое пробирки. В 8-ю пробирку переносят из 7-й 1 мл взвеси, также перемешивая стерильной пипеткой, и наносят 0,1 мл на сектор 8. Чашку Петри осторожно, крышкой кверху (чтобы капли не слились) ставят в термостат и выдерживают в течение 3—5 суток. Если среда приготовлена правильно, то на первых трех секторах рост имеет вид сплошных бляшек, на секторах 4, 5 и 6 вырастают тесно расположенные колонии, а на секторах 7 и 8 – небольшое количество изолированных колоний. Если нет роста на последних 2 секторах, то средой пользоваться нельзя.
При использовании питательных сред с добавлением крови чашки Петри делят на 2 сектора, а при использовании сухих сред (КУА) с добавлением дрожжевого экстракта – на 4 сектора.
Схема приготовления разведений коклюшной культуры
для проверки качества КУА
| Номер пробирки | Количество физиологического раствора, мл | Объем вносимой взвеси из предыдущей пробирки, мл | Количество микробов в 1 мл |
| 1 | 2 | 3 | 4 |
| 1 | 1,0 | ´ (исходная взвесь) | 5 000 000 000 (5 ´ 109) |
| 2 | 4,5 | 0,5 | 500 000 000 (5 ´ 108) |
Продолжение табл.
| 1 | 2 | 3 | 4 |
| 3 | 4,5 | 0,5 | 50 000 000 (5 ´ 107) |
| 4 | 4,5 | 0,5 | 5 000 000 (5 ´ 106) |
| 5 | 4,5 | 0,5 | 500 000 (5 ´ 105) |
| 6 | 4,5 | 0,5 | 50 000 (5 ´ 104) |
| 7 | 2,0 | 0,5 | 10 000 (1 ´ 104) |
| 8 | 1,0 | 1,0 | 5 000 (5 ´ 103) |
В районных лабораториях ЦГиЭ можно использовать метод проверки качества питательной среды, предложенный Е. А. Кузнецовым. Посев колонии коклюшного микроба производят на 1/16 поверхности чашки со средой КУА, разлитой в чашки Петри. Всего проверяют 5—10 колоний. Учет роста культуры проводят через 48 ч. В случае роста культуры по всему сектору – среда хорошего качества; при росте на ½ сектора – замедленный рост коклюшного микроба; рост только на посевной площадке – среда плохая.
Приложение 6
Приготовление сред и реактивов для биохимической идентификации бордетелл
|
|
|


