 |
Расчет состава равновесных смесей
|
|
|
|
Метод, применяемый для расчета состава равновесных смесей и нахождения теоретического выхода продуктов реакции, рассмотрим на примере гомогенной газофазной реакции
А(г) + 2 В(г)↔ D(г),
протекающей при постоянном давлении р и для которой известна константа равновесия Кр
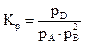 . (2.8)
. (2.8)
По закону Дальтона парциальное давление любого компонента газовой смеси
 , (2.9)
, (2.9)
где  − мольная доля i-того компонента в смеси.
− мольная доля i-того компонента в смеси.
Подстановка парциальных давлений в уравнение (2.8) дает выражение константы равновесия Кр и Кх:
 . (2.10)
. (2.10)
Таким образом  . (2.11)
. (2.11)
Если принять, что в рассматриваемой исходной смеси начальное число молей компонентов было  ;
;  ;
;  , а к моменту равновесия прореагировало у молей вещества А, то к моменту равновесия количество молей участников реакции будет равно:
, а к моменту равновесия прореагировало у молей вещества А, то к моменту равновесия количество молей участников реакции будет равно:  ;
;  ;
;  , суммарное число молей в равновесной смеси
, суммарное число молей в равновесной смеси 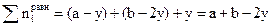 и мольные доли компонентов в системе
и мольные доли компонентов в системе
 ;
;  ;
; 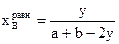 .
.
При расчете состава равновесной смеси удобно пользоваться таблицей, в которую заносится вся информация об исходном составе смеси, количестве прореагировавших веществ, а также о ее равновесном составе.
| Вещество | Исходный состав, моль | Прореагировало (образовалось) к моменту равновесия, моль | Равновесный состав, моль | 
|
| А | а | y | a-y | 
|
| В | b | 2y | b-2y | 
|
| D | y | y | 
|
Подстановка значений  в выражение для константы равновесия Кр приводит к квадратному уравнению с одним неизвестным у, решая которое, можно найти все искомые величины
в выражение для константы равновесия Кр приводит к квадратному уравнению с одним неизвестным у, решая которое, можно найти все искомые величины
 .
.
В ряде случаев могут получаться алгебраические уравнения дробных, четвертых или выше степеней, решать которые можно графически или методом последовательных приближений.
|
|
|
Адсорбционное равновесие
Процесс поглощения одного вещества поверхностью или объемом другого называется сорбцией. Сорбция, происходящая только на поверхности тела, называется адсорбцией. Величина адсорбции зависит от природы поглотителя (адсорбента) и поглощаемого вещества (адсорбата), от температуры и давления газа или концентрации растворов.
В качестве адсорбентов применяют вещества, обладающие большой удельной площадью поверхности. Высокодисперсными адсорбентами являются активированный уголь, силикагель, глина, целлюлоза и другие материалы.
Процесс отрыва частиц адсорбата от поверхности адсорбента, т.е. явление, обратное адсорбции, называют десорбцией. Если в системе «адсорбат – адсорбент» при заданных условиях скорость адсорбции равна скорости десорбции, состояние системы называют адсорбционным равновесием.
Количественно адсорбцию выражают в молях адсорбата на единицу площади поверхности адсорбента, моль/м2. Поверхность адсорбента, на которой могут размещаться молекулы адсорбата, ограничена. Поэтому величина адсорбции не может превышать предельного значения Г = Г∞ . Соотношение Г / Г∞ называют степенью заполнения поверхности адсорбента данным адсорбатом
 . (2.12)
. (2.12)
Соответственно (Ө = 1) будет означать полное заполнение площади поверхности адсорбента адсорбатом. Равновесие между веществом, находящимся в адсорбированном состоянии на поверхности, и этим же веществом в растворе, характеризуется константой адсорбционного равновесия
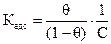 , (2.13)
, (2.13)
где Ө − степень заполнения поверхности адсорбированным веществом; с – равновесная концентрация.
С учетом соотношения (2.8) уравнение (2.9) может быть представлено в виде уравнения изотермы адсорбции Лэнгмюра
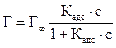 . (2.14)
. (2.14)
Графически изотерма адсорбции Лэнгмюра, построенная в координатах Г = f(С), представляет собой гиперболу (рис. 2.1).
|
|
|

В области малых концентраций происходит линейное увеличение адсорбции с увеличением концентрации; в области больших концентраций адсорбция достигает предельного значения, равного адсорбции при полном заполнении поверхности мономолекулярным слоем Г∞.
Значения Г∞ и Кадс можно определить графически по уравнению Лэнгмюра (2.10), преобразовав его в уравнение прямой линии
 .(2.15)
.(2.15)
Полученную численную зависимость представляют в виде графика в координатах  = f (с) (рис. 2.2).
= f (с) (рис. 2.2).
Экспериментальные точки должны укладываться на прямую с наклоном а = tgφ =  ,отсекающую на оси ординат отрезок
,отсекающую на оси ординат отрезок
b =  . Отсюда находят
. Отсюда находят
Г∞ =  ;
;  .
.
Вопросы и задачи к главе 2
1. Каковы условия термодинамического равновесия?
2. Что такое константа равновесия и от чего она зависит?
3. Как выражается зависимость константы равновесия от температуры?
4. Какие факторы влияют на смещение химического равновесия?
5. Что называется адсорбцией?
6. Что такое адсорбционное равновесие?
7. Как зависит адсорбция от концентрации при постоянной температуре?
8. Какую зависимость выражает уравнение Лэнгмюра?
|
|
|


