 |
Работа № 27. Измерение скорости гидратации уксусного ангидрида методом кондуктометрии
|
|
|
|
Цель работы – использование метода кондуктометрии в кинетических исследованиях. Определение средней константы скорости реакции и её энергии активации.
Гидратация уксусного ангидрида протекает по уравнению
(СH3СО)2O + Н2О →2CH3COOН.
Эта реакция бимолекулярная, но в разбавленных растворах, когда концентрация воды велика и практически не меняется, она протекает как реакция первого порядка.
Для измерения скорости этой реакции проводят измерение электропроводности раствора, которая пропорциональна концентрации уксусной кислоты и в ходе реакции значительно возрастает вследствие образования последней.
Измерения электропроводности проводят с помощью реохордного моста или кондуктометра. Правила пользования прилагаются к самим приборам.
Порядок выполнения работы
1. Налить в сосуд для измерения электропроводности 15 мл дистиллированной воды и 2-3 мл уксусного ангидрида. Осторожно, не задевая электродов, перемешать содержимое сосуда стеклянной палочкой, закрыть сосуд крышкой и поместить в термостат с заданной температурой.
2. Провести измерения либо электрического сопротивления раствора с помощью реохордного моста, либо электропроводности с помощью кондуктометра. Измерения начинать не позднее, чем через 1-1,5 мин. от начала реакции. За начало реакции принять момент смешения ангидрида с водой. Произвести два-три измерения через 30 с, три-четыре измерения через 1 мин., два-три измерения через 5 мин. и два измерения через 10 мин. Постоянство сопротивления раствора или электропроводности указывает на конец реакции.
3. Записать результаты измерений в таблицу:
| Номер измерения | Время от начала реакции τ, мин. | Сопротивление раствора Rτ,ом | 
| 
| 
| Константа скорости, k |
4. Построить график зависимости 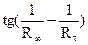 = f(τ),откладывая время в минутах на оси абсцисс. Для реакции первого порядка эта зависимость выражается прямой.
= f(τ),откладывая время в минутах на оси абсцисс. Для реакции первого порядка эта зависимость выражается прямой.
|
|
|
5. Рассчитать константу скорости для трех-четырех измерений времени τ при установившемся режиме (в середине процесса) по кинетическому уравнению первого порядка. Учитывая, что увеличение электропроводности во времени пропорционально увеличению концентрации уксусной кислоты, а количество кислоты пропорционально количеству введенного в раствор уксусного ангидрида, можно считать, что наибольшая электропроводность, а следовательно и наименьшее сопротивление будет пропорционально начальной концентрации уксусного ангидрида. Тогда
 ,
,
где R0 − сопротивление раствора в момент начала реакции; Rτ − сопротивление в момент времени τ от начала реакции; R∞ − сопротивление, соответствующее последнему измерению.
Величина R0 экспериментально не определяется, так как от начала реакции до первого измерения проходит некоторое время. Поэтому  находят экстраполяцией, продолжив полученную прямую на графике до значения τ = 0.
находят экстраполяцией, продолжив полученную прямую на графике до значения τ = 0.
6. Вычислить среднее значение константы скорости.
7. Определить константу скорости по графику как тангенс угла наклона прямой к оси абсцисс.
8. Сравнить константу, найденную графически с вычисленной.
9. Вычислить величину энергии активации данной реакции, зная, что при 0°C k = 0,027.
Работа № 28. ФОТОХИМИЧЕСКОЕ РАЗЛОЖЕНИЕ ПЕРЕКИСИ ВОДОРОДА
Цель работы − изучение кинетики цепной фотохимической реакции разложения Н2О2с применением газометрического метода и определение константы нарастания скорости реакции.
Оборудование
Схема установки представлена на рис. 3.4.

Порядок выполнения работы
1. Налить в кварцевую колбу (1) определенное (по указанию преподавателя) количество дистиллированной воды и перекиси водорода. Соединить колбу с обратным холодильником (5), установив ее против отверстия (6) в защитном щите (7).
|
|
|
2. Пустить воду в холодильник.
3. Открыть кран (8) и с помощью уравнительного сосуда (4) установить уровень жидкости в бюретке (3) на нулевом делении. Повернуть кран (6) таким образом, чтобы бюретка была соединена с холодильником. Проверить герметичность прибора.
4. После включения лаборантом ртутно-кварцевой лампы (2) через 1-2 мин. открыть заслонку (9) и одновременно включить секундомер.
5. Отметить время, за которое выделится 1мл кислорода. Последующие измерения делать через каждые 2 мин. Когда скорость выделения кислорода достигнет 2 мл в 2 мин., делать замеры ежеминутно. Опыт прекратить, когда выделится 75−80 мл кислорода.
6. Записать результаты измерений в таблицу:
| Номер измерения | Время от начала измерения τ, мин. | Объем выделившегося кислорода a, мл | Скорость реакции v, мл/мин. | tg v | lnv |
7. Вычислить скорость реакции в различные моменты времени c интервалом 2 мин. по формуле:

8. Построить график зависимости v = f(τ),откладывая время в минутах по оси абсцисс. По восходящей ветви построенной кривой взять значение vв различные моменты времени и построить график зависимости lnv = f(τ)
9. Определить константы Аиφпо уравнению (3.14), которое после логарифмирования принимает вид lnv = lnA + φτ.
Это уравнение является уравнением прямой в системе координат lnV−τОтрезок, отсекаемый прямой на оси ординат при значении τ = 0, дает величину ln A, а тангенс угла наклона прямой к оси τ определяет величину φ.
|
|
|


