 |
Строительные кирпичики для белков
|
|
|
|
ОГРОМНЫЕ МОЛЕКУЛЫ
В начале XIX века, когда химики только что узнали о существовании атомов, они работали с маленькими молекулами — «односложными словами», как мы называли их в предыдущей главе. Однако, перейдя к органическим веществам, нельзя было не натолкнуться на поистине огромные молекулы.
К счастью, каждый раз оказывалось, что эти огромные молекулы являются по сути своей множеством маленьких, соединенных друг с другом, как бисер на ниточке. Были найдены способы расцеплять их — сейчас обычно это делается путем нагревания большой молекулы в кислотном растворе.
Если большую молекулу в ее первозданном виде исследовать крайне сложно, то ее маленькие составляющие после высвобождения легко поддаются изучению. А из полученных знаний о структуре этих строительных кирпичиков зачастую можно сделать выводы и о структуре самой изначально взятой большой молекулы.
Если определить маленькие частички как «слова», а большую молекулу — как «предложение», то перед нами встанет та же задача, что перед любым человеком, пытающимся прочесть надпись на языке, о котором он имеет только поверхностное представление. Если его заставить с ходу перевести всю фразу целиком, он не сможет этого сделать. Но, разбирая ее постепенно, подглядывая, когда надо, в словарь, он с большой вероятностью сможет разгадать смысл предложения.
Первая большая молекула (макромолекула), подвергшаяся подобному изучению, оказалась неожиданно простой. Еще в 1814 году обнаружилось, что если молекулу крахмала достаточно долго нагревать в кислотном растворе, то она распадается на одинаковые частички. Эти частички оказались глюкозой — одной из разновидностей сахара, молекула которой в два раза меньше молекулы обычного столового сахара. Ее эмпирическая формула: —C6H12O6, значит, атомов в молекуле всего двадцать четыре. Однако для образования одной-единственной молекулы крахмала объединяются сотни и тысячи подобных элементов.
|
|
|
Вещество, содержащееся в древесине и придающее ей жесткость, целлюлоза, тоже, как выяснилось, распадается на остатки глюкозы — той же самой глюкозы, которая составляет и крахмал, — только в целлюлозе эти остатки глюкозы скреплены в другом порядке, нежели в крахмале.
Со временем выяснилось, что и другие макромолекулы состоят из длинных цепочек одинаковых элементов. Хорошим примером является резина, которая состоит из остатков изопрена, довольно простого углеводорода, содержащего всего пять атомов углерода.
В XX веке химики научились искусственно создавать не существующие в природе макромолекулы. Были изобретены способы объединения множества молекул того или иного вида (иногда — двух
разных видов) для создания искусственной резины, синтетических волокон и различных пластмасс.
Все эти макромолекулы, и природные, и искусственные, состояли из тысяч блоков. Но как бы велики они ни были, структура их оставалась довольно простой. Чтобы понять, что я имею в виду, представьте себе длинную нить бисера, одинакового по размеру и цвету, — сложной вы такую структуру никак не назовете. В нанизывании таких бус нет места творчеству, разве что одна бусина окажется покрупнее или помельче остальных.
Да, размер имеет значение. Вытянутые в длинные ряды при составлении целлюлозы элементы глюкозы производят твердые прочные нити, благодаря которым дерево прочно стоит посреди любой бури, да и мы не гнушаемся строить жилища из такого материала. А вот макромолекула крахмала является замечательным примером помещения энергетического содержания молекулы глюкозы в стабильную, нерастворимую форму до тех пор, пока она не понадобится. А тогда молекулы крахмала легко распадаются, и отделившиеся друг от друга остатки глюкозы выбрасываются в кровоток.
|
|
|
Однако макромолекулы, такие как крахмал или целлюлоза, не играют собственной активной роли в процессе жизнедеятельности. Это пассивные материалы, используемые «для своих целей» другими веществами.

Рис. 16. Глицин
А вот белки — другое дело. Здесь мы имеем дело с макромолекулами, которые не менее велики, чем молекулы крахмала иди целлюлозы, и тоже составлены из отдельных, фрагментов, скрепленных между собой, как бусины на ниточке. Но белки отличаются не только размером, но и сложностью. Осталось показать, как это происходит.
АМИНОКИСЛОТЫ
Примерно в 1820 году французский химик Браконно нагрел в кислоте белок желатин и выделил кристаллы сладковатого вещества. Оно получило название «глицин» — от греческого слова, означающего «сладкий».
Строение молекулы глицина оказалось простым. В ней всего 10 атомов, в два с лишним раза меньше, чем в молекуле глюкозы. Формула глицина приведена на рис. 16. Как видите, к центральному атому углерода с одной стороны прикреплена аминогруппа[9], а с другой — карбоксильная группа. Две оставшиеся валентности заняты атомами водорода. Сейчас любое вещество, содержащее одновременно и аминогруппу, и карбоксильную группу, принято называть аминокислотой. Так что глицин — это простейший пример аминокислоты.
Если бы на этом все и закончилось, то белок так и считали бы чем-то не сложнее крахмала или любой другой известной макромолекулы. Однако Браконно продвинулся дальше и нашел среди остатков, на которые распался белок, еще одну аминокислоту. Химик назвал ее лейцином, от греческого слова, означающего «белый», потому что цвет полученных им кристаллов действительно был белым.
Шли десятилетия, и другие ученые открывали новые аминокислоты. Совсем недавно, в 1935 году, среди продуктов распада белковых молекул была обнаружена еще одна важная аминокислота, о существовании которой раньше никто не догадывался. Получается, что именно аминокислоты и являются строительным материалом для белков.
Количество различных аминокислот, содержащихся в живой ткани, достаточно велико. Однако некоторые из них в белковых молекулах не встречаются, хотя и широко представлены в других. А есть и такие, которые в белковых молекулах находят только в одном-двух нестандартных случаях.
|
|
|
Если же мы ограничимся рассмотрением только тех аминокислот, которые находят в практически каждой молекуле белка, то обнаружим, что их совсем немного — 21. Добавим к ним еще одну, которую нашли в молекуле только одного белка (но очень важного), и получим цифру 22.
Это — один из параметров, по которым белки не имеют себе равных. Ни одна другая макромолекула — ни природная, ни искусственная — не строится из такого большого набора различных элементов (или даже вчетверо меньшего).
Значение этого факта становится очевидным, если вернуться к образу нити бус. Представьте себе, что вместо одинаковых бусин перед вами двадцать два различных их набора, и бусины из каждого отличаются от остальных размером, формой или цветом.
Имея такой материал, можно создавать множество удивительных узоров — неожиданных симметрий и радующих глаз переходов.
Вот так и творятся белковые молекулы.
Давайте поближе рассмотрим аминокислоты и разберемся, чем же именно они между собой различаются и какие свойства придают молекуле белка в этом практически бесконечном разнообразии сочетаний.
Чтобы изложение оставалось как можно понятнее, я хотел бы представить схематическую запись структурных формул, где геометрический принцип, применяемый при изображении колец атомов, будет распространяться и на атомы, не входящие в состав колец. Профессиональные химики до такого упрощения формул не доходят, но эта книга ведь не предназначена для профессионалов. Все, чего я хочу добиться, — это максимально просто и понятно объяснить химическую основу передачи наследственной информации, и если мне требуется для этого ввести нестандартные формы записи — я чувствую себя вполне вправе это сделать!
Относительно геометрических фигур, изображенных на рис. 15, я объяснял, что на каждой вершине многоугольника, где ничего не обозначено, находится атом углерода, а если не обозначено, с чем атом углерода связан, то, значит, связан он с атомом водорода. Теперь давайте расширим эту договоренность. Мы будем рисовать ломаную линию для тех цепочек атомов, которые не формируют кольца. Оставим для этих ломаных линий в силе утверждение о том, что на каждой лишенной дополнительных обозначений вершине (равно как и на лишенных дополнительных обозначений концах линии) расположен атом углерода; кроме того, распространим и на другие атомы, кроме углерода, правило о том, что любая не обозначенная дополнительно связь есть связь с атомом водорода.
|
|
|
В качестве примера: вот так будет выглядеть «ломаная формула» глицина — рис. 17. Можете сравнить с ее же изображением на рис. 16.

Рис. 17. Глицин (в виде ломаной)
Теперь мы должны показать, чем другие аминокислоты, составляющие молекулу белка, отличаются от глицина. В общем, можно сказать, что все они имеют «центральный» атом углерода, к которому крепятся, с одной стороны, аминогруппа, а с другой — карбоксильная группа. Разница же между ними в следующем: у глицина две остающиеся свободными от карбоксильной и аминогруппы валентности центрального углерода заняты атомами водорода. В других же аминокислотах водородом занята только одна из них, а последняя свободная валентность центрального атома занята связью с другим атомом углерода, который, в свою очередь, является частью более или менее сложной группы атомов, именуемой радикалом.
Ясно представить себе это поможет рис. 18, где в «ломаном» виде представлена формула общего строения аминокислот. Сравните ее с формулой для глицина на рис. 17.

Рис. 18. Аминокислота (в виде ломаной)
Каждой конкретной аминокислоте свойственен свой радикал, и именно в природе радикалов и следует искать причину различий между аминокислотами.
РАДИКАЛЫ
Давайте рассмотрим каждую из оставшихся аминокислот, числом 21 (глицин мы уже рассмотрели). Нас будут интересовать именно присущие им радикалы. Для начала я буду представлять эти макромолекулы целиком, отмечая каждый атом.

Рис. 19. Углеводородные радикалы
Начнем с того, что существуют четыре аминокислоты, в которых радикал — углеводородная группа. Это уже упоминавшийся лейцин, а также аланин, валин и изолейцин. Характеризующие их радикалы представлены на рис. 19.
Далее, имеются две аминокислоты, радикал которых — гидроксильная группа. Это серин и треонин, их радикалы показаны на рис. 20. Треонин — и есть та аминокислота, которая была открыта последней, в 1935 году. Химики практически уверены, что больше значимых аминокислот (по крайней мере, таких, которые присутствовали бы во всех или почти всех белках) открыто не будет.
|
|
|

Рис. 20. Гидроксил содержащие радикалы
Есть две аминокислоты, радикал которых — карбоксильная группа. Это аминоянтарная (аспарагиновая) и глютаминовая кислоты. Как по названию, так и по структуре с ними крайне схожи еще две — аспарагин и глютамин. Все их четыре радикала изображены на рис. 21.

Рис. 21. Радикалы, содержащие карбоксильные и амидные группы
Еще у двух аминокислот радикал — аминогруппа. Одна из них — лизин, а вторая — аргинин[10]. Их радикалы представлены на рис. 22.

Рис. 22. Аминосодержащие радикалы
У трех аминокислот в радикале присутствуют атомы серы. Одна из них — метионин, где единственный атом серы заключен между двумя атомами углерода (такую комбинацию называют простым тиоэфиром). Во второй, называемой цистеин, наличествует меркаптановая группа, а в третьей, цистине, — дисульфидная. Все три радикала представлены на рис. 23.
Обратите внимание, что радикал молекулы цистина имеет в ответвлении также аминокислоту. Если написать формулу молекулы полностью, то получится, что две молекулы цистеина вместе приклеились к дисульфидной группе. Цистин легко распадается на две молекулы цистеина, а две молекулы цистеина с такой же легкостью объединяются в молекулу цистина.

Рис. 23. Серосодержащие радикалы
Некоторым образом такая близость отражена и в названиях этих аминокислот — если по небрежности или нечеткости произношения опустить или, наоборот, вставить лишнюю букву «е», то можно эти два вещества легко перепутать.
Не менее четырех аминокислот имеют в своем составе атомные кольца. У двух — фенилаланина и тирозина — эти кольца бензольные, у триптофана — индольное, а у гистидина — имидазольное. Их радикалы изображены на рис. 24.

Рис. 24. Радикалы с кольцевой частью

Рис. 25. Пролин и гидроксипролин
И наконец, мы дошли до двух последних аминокислот. В них радикал ведет себя совершенно необычным образом. Он «заворачивается» и соединяется с аминогруппой, которая крепится к центральному атому углерода. Соответственно, формулы этих двух аминокислот я привожу на рис. 25 полностью. Обратите внимание, что подобное строение радикала приводит к формированию кольца, схожего с пиррольным, но без двойных связей. Собственно, само слово «пролин» происходит от «пиррол».
Гидроксипролин и есть та самая аминокислота, встречающаяся только в одном белке, которую я упоминал вначале. Этот белок — коллаген. Из него состоит большая часть соединительной ткани в организмах животных, в том числе — и в наших, разумеется. Он находится в коже, хрящах, связках и сухожилиях, костях, рогах и копытах. При интенсивном кипячении коллаген распадается на знакомый нам белок желатин, так что и в нем можно найти гидроксипролин.
Все, список закончен, и вот перед нами все двадцать две аминокислоты, двадцать два «слова», из которых составляются молекулы белка[11]. Пора подвести итоги, нарисовав все аминокислоты в «ломаном» представлении, как это сделано на рис. 26. По-моему, изображенное на этом рисунке ясно дает понять все различия между аминокислотами и вдобавок наглядно показывает их родственные отношения. Если вам надо, то с помощью правил, изложенных несколько страниц назад, вы вполне можете привести каждую из «ломаных» формул к стандартному виду.

Рис. 26. Двадцать две аминокислоты (в «ломаном» представлении)


ОТ СЛОВ - К ПРЕДЛОЖЕНИЯМ
Имея к своим услугам все «слова», давайте подумаем, как можно составлять из них «предложения». Этот вопрос оставался без ответа вплоть до конца XX века, когда немецкий ученый Эмиль Фишер впервые привел тому удовлетворительное объяснение. Он продемонстрировал, что две аминокислоты объединяются путем соединения карбоксильной группы одной из них с аминогруппой второй и что в процессе такого соединения теряется одна молекула воды. Если — возьмем простейший пример — это происходит с двумя молекулами глицина, то весь процесс протекает в точности так, как показано на рис. 27. Как видно, гидроксильная группа, составляющая часть карбоксильной группы, входит в соприкосновение с одним из атомов водорода аминогруппы — они соединяются в молекулу воды, которая отделяется. После исчезновения гидроксильной группы и атома водорода у каждой из молекул глицина высвобождается по одной валентности, и они тут же образуют друг с другом единую молекулу — глицил-глицин.
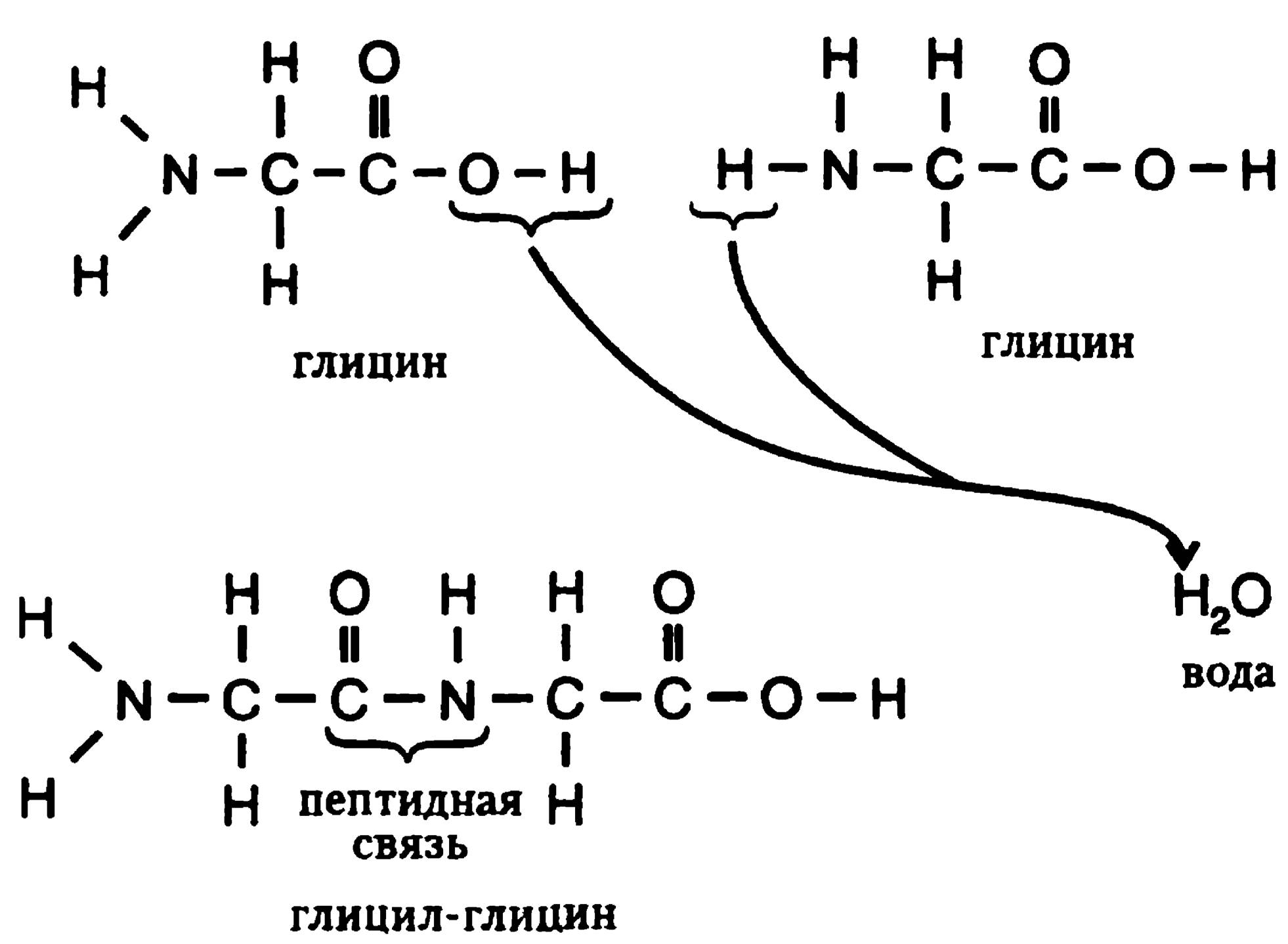
Рис. 27. Объединение аминокислот
Такие соединения аминокислот называются пептидами, от греческого «pepto» — варить, переваривать, потому что впервые они были получены из частично переваренного белка. Блок атомов, соединяющий аминокислоты (—CONH—), в котором можно увидеть остатки первоначальных карбоксильной и аминогруппы, называют пептидной связью.
Глицил-глицин — это пептид, состоящий из двух аминокислот. Такие пептиды называют, соответственно, дипептидами. У глицил-глицина также имеются с одной стороны карбоксильная группа, а с другой — аминогруппа, так что у него вполне сохраняется способность объединяться с другими аминокислотами — что с одного конца, что с другого, а то и с обоих. Таким образом могут получаться трипептиды, тетрапептиды, пентапептиды и так далее[12].
Пептидными связями может быть объединено сколь угодно много аминокислот. Пептид, составленный из неизвестного числа аминокислот, называется полипептидом, где приставка «поли-» происходит от греческого слова «много».
Предположим, что мы захотим нарисовать в «ломаном» виде множество соединенных между собой молекул глицина. Результат см. на рис. 28. Этот полипептид, состоящий только из остатков глицина, называется полиглицин. Молекула полиглицина в плане сложности и способности проявлять разносторонние свойства белка ничем не лучше любой другой макромолекулы, состоящей из одинаковых блоков. Примером природного полипептида, состоящего по большей части из глицина и аланина, является шелк, и простота его структуры очевидна. Единственное свойство, ради которого живые организмы производят шелк, — это его прочность. Можно сказать, что шелк является животным эквивалентом целлюлозы.
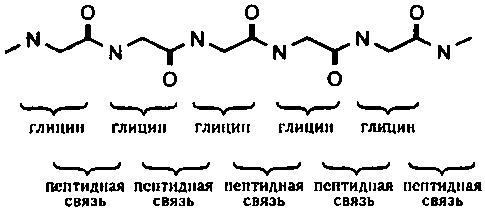
Рис. 28. Полиглицин
Еще один пример — искусственная ткань, нейлон. Он состоит из двух компонентов, один из которых — двухосновная карбоновая кислота (углеродная цепочка с двумя карбоксильными группами по краям), а другой — диамин (углеродная цепочка с двумя аминогруппами по краям). Компоненты эти соединяются с помощью пептидных связей, и у нейлона тоже самым ценным свойством является прочность.
Так что, говоря о многофункциональности, необходимо помнить, что на самом деле во встречающихся в природе полипептидных цепочках всегда имеются 22 различных блока. Такая полипептидная цепочка будет отличаться от полиглицина тем, что в ней через определенные промежутки будут встречаться дополнительные радикалы. Как видно из «ломаного» представления такой полипептидной цепочки на рис. 29, радикалы, обозначенные как X, торчат по очереди в разные стороны.

Рис. 29. Полипептидная цепочка в упрощенном отображении
Так получается, что полипептидная цепочка состоит из двух частей: 1) полиглициновая основа по всей длине цепочки; 2) множество радикалов, отходящих от этой основы. Поскольку нас интересуют именно те качества, которые делают белки столь многофункциональными, общую для всех часть мы будем игнорировать и сосредоточимся на радикалах. Строение полиглициновой основы нам уже известно и неинтересно, так что мы можем теперь представлять ее в виде простой прямой линии. В качестве дальнейшего упрощения радикалы мы будем рисовать торчащими все в одну сторону. Пример такого упрощения я включил в рис. 29.
Часто белковая молекула состоит только из одной полипептидной цепочки. Но иногда в нее входят две полипептидные цепочки и более, соединенные молекулами цистина. Посмотрите еще раз на строение молекулы цистина на рис. 23: вы увидите, что у него с обеих сторон имеется по аминокислой группе.

Рис. 30. Сочетание полипептидных цепочек
Это означает, что один аминокислый край может стать частью одной полипептидной цепочки, а второй край — частью другой, как это показано на рис. 30. Получается, что две полипептидные цепочки соединены дисульфидной связью. Эту дисульфидную связь легко разрушить с помощью химических реакций, не затрагивающих сами полипептидные цепочки, — и их тогда можно изучать отдельно. Когда Фишер установил природу полиглициновой основы и таким образом закрыл эту часть вопроса, химики сконцентрировали все свое внимание на радикалах — то же самое сейчас предстоит сделать и нам.
Глава 5
ФОРМА БЕЛКОВ
ЧИСЛО И ПОРЯДОК
Радикалы имеют широкий ряд свойств. Некоторые — например, радикалы тирозина и триптофана — большие и громоздкие, другие, как у аланина и серина, — маленькие. В одних радикалах имеется гидроксильная группа, как, например, у треонина, в других такой группы нет; одни, как радикалы аспарагиновой или глютаминовой кислот, несут отрицательный электрический заряд, другие, как у лизина и аргинина, — положительный, большинство же нейтральны.
В результате каждая белковая молекула имеет на всей своей протяженности массу различных отростков, одни из которых велики, другие — малы, в одних местах заряжены отрицательно, в других — положительно, и так далее.
С этой точки зрения становится понятен механизм работы антител. Антитело к конкретному агенту — это белок, форма радикалов которого в точности подстроена под форму радикалов чужеродного белка, или вируса, или ключевого участка на поверхности бактерии. Эта подстройка может заключаться в противопоставлении отрицательного заряда положительному, что приведет к взаимному притяжению радикалов антитела и чужеродной молекулы. Или массивный фрагмент одного белка будет соответствовать «провалу» в структуре другого. Так или иначе, антитело и его жертва тесно связываются, образуя единую безвредную для организма комбинацию. Разумеется, антитело, выработанное под конкретный белок, не будет работать в отношении другого, лишь только расхождение в их структуре достигнет определенного уровня.
Нетрудно также понять и как работает фермент. Он должен иметь такую форму радикалов, что оба вещества, реакцию которых ему суждено катализировать, займут соседствующее положение в образовавшихся нишах. Будучи, так сказать, официально представленными друг другу подобным образом, они вступят в нужную реакцию и покинут любезно предоставленную им площадку, освобождая ее для следующей пары. В результате реакция в целом будет протекать гораздо быстрее, чем в отсутствие фермента. И разумеется, фермент, подходящий для одних реагентов, не будет годиться для других.
Таким образом, становится ясно, что ключ к пониманию деятельности белков лежит в глубоком изучении рисунка их радикалов. Не то чтобы идеальное знание всех возможных сочетаний ответило бы прямо уж на все вопросы — наверное, нет, не ответило бы. Но отсутствие знаний об этих формах точно оставит без ответа любые вопросы. Так что изучение форм сочетаний радикалов является, как минимум, необходимым шагом.
«Атаку на формы» можно предпринять в три этапа. Раз уж я взялся проводить аналогию между молекулярной структурой и человеческим языком, то продолжу ее и для объяснения этих трех этапов.
На первом этапе следует разобраться, какие именно аминокислотные блоки присутствуют в молекуле конкретного белка. Это равносильно установлению списка слов в предложении. Замена одного-единственного слова может изменить смысл всего высказывания, вот вам пример:
Джон ударил Джима только в глаз.
Джон ударил Джима только в мечтах.
Одно слово изменено — а смысл меняется совершенно.
Когда набор составляющих белок аминокислот известен, на втором этапе необходимо установить, в каком порядке они следуют в полипептидной цепочке.
Это равносильно установлению порядка слов в предложении. Перестановка слов тоже способна достаточно сильно повлиять на общий смысл фразы. Вот смотрите:
Джон ударил Джима только в глаз.
Джон только ударил Джима в глаз.
Джон ударил в глаз только Джима.
Только Джон ударил Джима в глаз.
А ведь можно пойти в перестановках и дальше:
Джим ударил Джона только в глаз.
...И так далее.
И наконец, есть и третий вид изменений, который заслуживает краткого предисловия.
Полипептидная цепочка может немного изгибаться. В таком изогнутом положении ее удерживают слабые силы электрического напряжения, возникающие, когда атом водорода попадает между двух близко расположенных атомов азота или кислорода или между одним атомом азота и одним атомом кислорода. Такая связь называется водородной связью, поскольку центральную роль в ней играет атом водорода.
Пока атом водорода остается нетронутым, полипептидная цепочка сохраняет свой изгиб и радикалы образуют именно такую форму, которая нужна, чтобы белок обладал свойствами определенного антитела, фермента или другого функционального вещества.
Практически любое травматическое воздействие, даже легкий нагрев, способно разрушить хрупкие водородные связи. Когда это происходит, полипептидная цепочка теряет единственно верную форму; а когда рельеф радикалов изменяется, белковая молекула уже не может больше выполнять свои функции. Именно поэтому белки так легко денатурировать, и денатурация их оказывается необратимой.
Итак, третий этап изучения формы белка — это установление всех складок и изгибов, существующих в полипептидной цепочке. В рамках нашей аналогии со словами и предложениями это будет равносильно установлению контекста фразы. Так, утверждение о том, что
Джон только ударил Джима в глаз,
произведет совершенно разное впечатление в зависимости от того, идет ли речь о двух молодых боксерах на ринге или о двух пожилых профессорах на собрании.
После того как Фишер установил природу полипептидной основы, химики еще на протяжении целого поколения продолжали решать загадку формы белков без особого успеха. Только в 1935 году, как уже упоминалось, была открыта последняя аминокислота. Однако и когда все аминокислоты стали известны, даже первый из трех описанных нами этапов все равно оставался недоступным для осуществления. Разложить молекулу белка на все составляющие ее аминокислоты несложно, но вот аккуратно разобраться с выявленной смесью инструментарий химиков 1930-х годов не позволял. И в начале 1944 года с точностью еще нельзя было сказать, сколько тех или иных аминокислот входят в состав определенной белковой молекулы, а решения второго и третьего этапов загадки даже и не предвиделось.
Но в 1944 году на сцене появляется нововведение — фильтровальная бумага.
ФОРМА: КРАТКАЯ ВЕРСИЯ
Двое английских биохимиков, А. Мартин и Р. Синг, изобрели технологию, при которой смесь аминокислот, полученную в ходе распада определенной молекулы белка, наносили на пористую фильтровальную бумагу и высушивали после этого. Затем край бумаги опускали в органическую жидкость, которая, поднимаясь по капиллярам, медленно пропитывала весь лист снизу доверху. Опустите уголок промокашки в стакан с водой, и вы наглядно убедитесь в том, как действует капиллярность.
По мере того как жидкость поднимается через область с высохшим пятном смеси аминокислот, она протягивает с собой эти аминокислоты. Каждая аминокислота протягивается со свойственной только ей скоростью, и таким образом их все можно отделить друг от друга. Разработать методы идентификации аминокислот после того, как они займут каждая свое место на листе бумаги, оказалось уже делом несложным.
Технология эта получила название бумажная хроматография, и она впервые позволила с точностью определять все аминокислоты, входящие в состав того или иного белка. Таким образом завершился первый этап разгадки строения белка, и начиная с конца 40-х годов XX века был установлен аминокислотный состав многих белков[13].
Но это был только первый этап. Сразу же началась работа над вторым. Как только технология Мартина-Синга получила широкое распространение, английский биохимик Фредерик Сенгер решил и проблему второго этапа.
Он избрал метод частичного разложения белковой молекулы. Вместо того чтобы окончательно разбивать ее на аминокислоты, он прерывал процесс после получения коротких пептидов, по две-три аминокислоты в каждом. Эти маленькие пептиды химик подвергал методу бумажной хроматографии, разделял их на группы и работал дальше с каждой группой отдельно. Постепенно ему удалось установить порядок следования аминокислот в каждой из коротких пептидных цепочек (работа кропотливая, но выполнимая), а затем он методично вычислил, каким именно образом аминокислоты должны были быть составлены в цепочку, чтобы при распаде этой цепочки получились именно такие пептиды, и никаких других. Так к 1953 году Сенгер установил точный порядок следования аминокислот в молекуле белка инсулин[14].
Американский биохимик Винсент дю Виньо с помощью методики Сенгера определил точное строение еще двух белковых молекул — окситоцина и вазопрессина. Это оказались на удивление простые соединения, так что дю Виньо смог продвинуться на шаг дальше Сенгера — он занялся синтезом и составил аминокислоты вместе в том порядке, который установил в ходе своих экспериментов. В результате получились синтетические молекулы, обладавшие всеми свойствами и выполнявшие все функции природных белков. Это было самое лучшее доказательство всех теорий строения белка, которые выдвигались со времен Фишера[15].
Так был преодолен и второй этап решения проблемы, и теперь давайте остановимся и рассмотрим результаты. Начнем с вазопрессина, одного из двух белков, синтезированных дю Виньо.
Вазопрессин принадлежит к классу веществ, называемых гормонами. Он производится отдельным органом (задней долей гипофиза — железы, расположенной у основания головного мозга) и вбрасывается в кровоток. Как и все гормоны, он в небольших количествах серьезно влияет на всю биохимию организма, в частности — повышает кровяное давление и регулирует почечную деятельность, предотвращая обезвоживание. Если вазопрессин вырабатывается организмом в недостаточных количествах, то развивается заболевание, именуемое несахарным диабетом, при котором больной выделяет в чрезмерном количестве мочу и все время хочет пить.
Дю Виньо выяснил, что бычий вазопрессин состоит из восьми различных аминокислот. Вот их список: 1) аргинин, 2) аспарагин, 3) цистин, 4) глютамин, 5) глицин, 6) фенилаланин, 7) пролин и 8) тирозин.
В процессе установления порядка их следования химик обнаружил, что два аминокислых участка молекулы цистина находятся на разных участках полипептидной цепочки, так что цепочка эта на одном своем участке изгибается, создавая петлю, удерживаемую дисульфидной связью. Кроме того, выяснилось, что молекула глицина находится на незагнутом участке цепочки и что карбоксильная группа этой аминокислоты видоизменена до состояния амидной группы (такая модификация глицина носит название глицинамид). Упрощенная формула бычьего вазопрессина, на которой обозначены только радикалы, приведена на рис. 31.

Рис. 31. Бычий вазопрессин
Кроме вазопрессина, задняя доля гипофиза производит также окситоцин — второй синтезированный дю Виньо белок. Он тоже состоит из восьми аминокислот, и шесть из них — те же, что в вазопрессине, а различия состоят в том, что вместо фенилаланина в окситоцине присутствует изолейцин, а вместо аргинина — лейцин. Упрощенная формула окситоцина приведена на рис. 32.

Рис. 32. Бычий окситоцин
Если сравнить формулы на рис. 31 и 32, то видно, что различаются они только тем, что в молекуле окситоцина отсутствуют имеющиеся в вазопрессине бензольное кольцо и трехазотная гуанидиновая комбинация. Разница кажется незначительной, но влияние ее на функции этих белков огромно. Окситоцин не поднимает кровяного давления, как вазопрессин, и не оказывает такого спасительного действия на больных, страдающих несахарным диабетом. Зато он вызывает сокращение гладких мышц, особенно матки, так что может служить полезным инструментом для стимулирования родов.
Почему замена двух радикалов приводит к таким разительным функциональным отличиям — до сих пор неясно. Однако замена двух радикалов из восьми — вполне масштабная в процентном соотношении. Менее весомые изменения не вызывают потерь функциональности. Так, например, в вазопрессине свиньи семь из восьми аминокислот идентичны тем, что обнаруживаются в бычьем, и расположены в том же порядке. Единственное различие: в бычьем вазопрессине есть аргинин, в свином — лизин.

Рис. 33. Свиной вазопрессин: «хвостовой» участок
Чтобы продемонстрировать эту разницу, изобразим «хвост» молекулы — участок вне цистиновой петли (рис. 33). Как видите, различие гораздо меньше, чем между вазопрессином и окситоцином. В свином вазопрессине сохраняется бензольное кольцо, которого недостает в окситоцине. Кроме того, он не утратил всех трех атомов азота, которые имеются в бычьем вазопрессине, но отсутствуют в окситоцине. При замене аргининового радикала на лизиновый один атом азота в радикале все равно сохраняется. В итоге разница не настолько велика, чтобы повлиять на функциональность белка. Как свиной, так и бычий вазопрессин в равной степени способны облегчать страдания больных несахарным диабетом.
Можно провести аналогию между тремя маленькими молекулами гормонов и тремя восьмисловными предложениями:
1. Джон Джоунс больно ударил Мэри Смит в глаз.
2. Джон Джоунс нежно поцеловал Мэри Смит в глаз.
3. Джон Джоунс нежно поцеловал Мэри Смит в глаза.
Во втором предложении я изменил два слова из первого, и смысл его полностью изменился. Джон Джоунс превратился из грубияна в героя-любовника, и реакция Мэри Смит в этих случаях наверняка была разной. Такой же представляется и разница между вазопрессином и окситоцином.
Третье предложение одним словом — «глаза» — отличается от второго. Тем не менее, смысл третьего и второго предложения практически одинаков. Такова же и разница между бычьим и свиным вазопрессином.
Однако некоторая разница между вторым и третьим предложениями все же имеется, хоть ее и недостаточно для общего изменения смысла. Третье предложение подразумевает, как минимум, два поцелуя и тем самым говорит о более теплых чувствах или более близких отношениях. В той же мере можно сказать, что если химические механизмы, действующие в гипофизе свиньи, производят продукт, отличающийся от продукта гипофиза коровы, то, значит, механизмы эти должны чем-то различаться, пусть даже функции этих продуктов и совпадают.
ФОРМА: ПОЛНАЯ ВЕРСИЯ
Разницу в структуре игнорировать нельзя, даже несмотря на отсутствие при этом разницы функциональной. Почему — я сейчас объясню на примере инсулина, первого белка, в отношении которого был осуществлен второй этап установления структуры.
Инсулин — это гормон, вырабатываемый определенными клетками поджелудочной железы. Его присутствие необходимо на одном из участков химической цепи расщепления организмом сахара с целью получения энергии. Если в организме недостаточно инсулина, распад сахара замедляется и развивается тяжелое заболевание, известное как сахарный диабет.
Молекула инсулина устроена чуть посложнее, чем окситоцин или вазопрессин. Она содержит пару полипептидных цепочек, скрепленных между собой дисульфидными связями. Их называют «цепь А» и «цепь В». Цепь А состоит из 26 аминокислот, а цепь В — из 30. Часть цепи А формирует петлю благодаря дисульфидной связи молекулы цистина, как это происходит в вазопрессине и окситоцине. В эту петлю входят, помимо самой молекулы цистина, еще три аминокислоты.
Исследованию п
|
|
|


