 |
Тема №1. Строение и свойства металлов.
|
|
|
|
Лекции по дисциплине
«Электротехническое и конструкционное материаловедение»
Тема №1. Строение материалов.
Основными элементарными частицами, из которых строятся все вещества, являются протоны, нейтроны и электроны. Протоны имеют положительный заряд, электроны – отрицательный, нейтроны являются нейтральными частицами, не имеющими заряда. Согласно упрощенной модели Нильса Бора атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны, компенсируя положительный заряд ядра. Ядро состоит из протонов и нейтронов. Электроны располагаются вокруг ядра несколькими слоями – оболочками.
Газы, жидкие и твердые тела состоят из атомов, молекул или ионов. Молекулами называют электрически нейтральные частицы, образованные из двух или более связанных ковалентными связями атомов (часто к молекулам причисляют также и свободные атомы). Ион – это электрически заряженная частица (атом или молекула), получаемая в процессе ионизации.
В зависимости от строения внешних электронных оболочек атомов в молекулах могут образовываться различные виды связей.
Ковалентная связь возникает при обобществлении электронов двумя соседними атомами. Иными словами происходит образование общей пары электронов, которые ранее принадлежали отдельным атомам. При образовании общей одной пары электронов от каждого объединяемого атома вносится по одному валентному электрону. Например: 
Молекулы, в которых центры положительных и отрицательных зарядов совпадают, являются неполярными. Если же в отдельных молекулах центры противоположных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то такие молекулы называются полярными или дипольными.
|
|
|
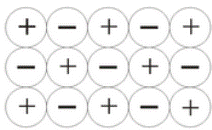 Ионная связь определяется силами притяжения между положительными и отрицательными ионами.
Ионная связь определяется силами притяжения между положительными и отрицательными ионами.
 Металлическая связь. Металлы можно рассматривать как системы, построенные из расположенных в узлах решетки положительно заряженных ионов, находящихся в среде свободных электронов
Металлическая связь. Металлы можно рассматривать как системы, построенные из расположенных в узлах решетки положительно заряженных ионов, находящихся в среде свободных электронов
Молекулярная связь (связь Вандер-Вальса). Такая связь существует в некоторых веществах между молекулами с ковалентными внутримолекулярными связями. Межмолекулярное притяжение в этом случае обусловливается согла  сованным движением валентных электронов в соседних молекулах. В любой момент времени электроны максимально удалены друг от друга и максимально приближены к положительным зарядам. При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказывается сильнее сил взаимного отталкивания электронов внешних орбит.
сованным движением валентных электронов в соседних молекулах. В любой момент времени электроны максимально удалены друг от друга и максимально приближены к положительным зарядам. При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказывается сильнее сил взаимного отталкивания электронов внешних орбит.
Раздела 1. Конструкционные материалы.
Тема №1. Строение и свойства металлов.
Металлы обычно имеют кристаллическое строение. В узлах кристаллической решетки металлов расположены положительно заряженные ионы, а часть валентных электронов, отщепившихся от атомов, становятся свободными. Свободные электроны обобществляются, образуя электронный газ, который взаимодействует с положительными ионами металла и связывает их в прочную систему.
Наиболее распространенными являются три типа кристаллической решетки: кубическая объемноцентрированная (о.ц.к.), кубическая гранецентрированная (г.ц.к.) и гексагональная плотноупакованная (г.п.у.)


 Чистые металлы обладают низкой прочностью, поэтому в технике используют редко. Наиболее широко применяют в технике в качестве конструкционных материалов металлические сплавы.
Чистые металлы обладают низкой прочностью, поэтому в технике используют редко. Наиболее широко применяют в технике в качестве конструкционных материалов металлические сплавы.
Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Большинство сплавов, кроме сплавов с неорганической растворимостью компонентов в твердом состоянии, можно представить как систему, состоящую из нескольких фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении). Фазой называют однородную по химическому составу и строению часть системы, отделенную от другой части системы поверхностью раздела, при переходе через которую изменяются состав, строение и свойства сплава.
|
|
|
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы:
1. Механические смеси (гетерогенная структура) – образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Каждая фаза имеет кристаллическую решетку, соответствующую данному компоненту.
2. Химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными.
3. Твердые растворы – это сплавы, в которых кристаллическая решетка построена из атомов двух или большего числа компонентов, при этом один из них является растворителем, а другой – растворимым. Твердый раствор имеет сильно деформированную кристаллическую решетку, тип которой соответствует типу решетки одному из образующих компонентов.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом. Различные кристаллические формы одного вещества называются полиморфными модификациями. Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ.
|
|
|
Железо с углеродом образует сплавы: твердые растворы внедрения и химические соединения, которые, в свою очередь, образуют сплавы гетерогенной структуры. В зависимости от содержания углерода С в Fe получают стали (содержание С до 2,14%) или чугуны (С от 2,14% и более).
В углеродистых сталях эти компоненты взаимодействуют, образуя, в зависимости от их количественного соотношения и температуры, разные фазы, представляющие собой однородные части сплава. Это взаимодействие заключается том, что углерод может растворяться как в жидком (расплавленном) железе, так и в различных его модификациях в твердом состоянии.
Кроме того, он может образовывать с железом химическое соединение. Таким образом, в углеродистых сталях различают следующие фазы:
Феррит – твердый раствор углерода и других примесей в α-железе (кристаллическая решетка – о.ц.к.). Предельная растворимость углерода – 0,02% в низкотемпературном феррите и 0,1% в высокотемпературном. Имеет невысокую прочность и твердость (НВ=800 МПа; σ = 250 МПа) и высокую пластичность.
Аустенит – твердый раствор углерода и других примесей в γ-железе (кристаллическая решетка – г.ц.к.). Предельная растворимость углерода – 2,14%. Механические свойства: НВ=1600-2000 МПа; σ = 500-800 МПа; δ = 40-50%.
Цементит – химическое соединение железа с углеродом – карбид железа Fe3C2, содержащий 6,67% углерода. Имеет очень высокую твердость (НВ=8000 Мпа) и очень малую пластичность.
Перлит – эвтектоидная механическая смесь двух фаз: феррита и цементита, которая образуется из аустенита с содержанием С 0,8 % при постоянной температуре t = 727оС.
Как следует из приведенных выше характеристик, главной составляющей стали, определяющей ее свойства, является углерод. С увеличением содержания углерода возрастают прочность и твердость стали, снижаются показатели пластичности (относительное удлинение и относительное сужение), а также ударная вязкость. При 0,8 % углерода прочность стали достигает максимального значения, после чего она начинает снижаться.

ACD – линия ликвидуса. Показывает температуру начала затвердевания сталей и чугунов.
AECF – линия солидуса. Показывает температуру конца затвердевания сплавов.
При охлаждении твердых сплавов в них происходят фазовые и структурные изменения, связанные с аллотропическими превращениями Fe и изменением растворимости в нем углерода. Эти изменения (фазовые превращения) в сплавах Fe-С характеризуют линии GSE, PSK, GPQ.
|
|
|


