 |
Внутривенная общая анестезия
|
|
|
|
Внутривенная общая анестезия достигается путем введения общего анестетика в венозное кровяное русло, откуда происходят проникновение его в ЦНС и распределение по органам и тканям с последующим развитием характерных для каждого фармакологического агента центральных и периферических проявлений общей анестезии. Используемые для внутривенной анестезии средства многочисленны и принадлежат к различным фармакологическим группам.
В современной анестезиологии практически не существует ситуаций, когда какое-либо средство общей анестезии (в том числе внутривенной) применялось бы в чистом виде (моноанестезия). В большинстве случаев для достижения полноценной внутривенной анестезии применяется комбинация различных общих анестетиков (чаще всего гипнотик и анальгетик), однако даже там, где для общей анестезии применяется единственный агент, например пропанидид при кратковременных хирургических или эндоскопических манипуляциях, вряд ли правомочно говорить о моноанестезии, так как ей обязательно предшествует премедикация, при которой как минимум используют анальгетик (промедол) и ваголитик (атропин), а нередко и психотропные и ангигистаминные препараты. Премедикация, включающая нейротропные вещества, оказывает существенное влияние на основной и побочные эффекты общего анестетика (см. ниже) и потому фактически является компонентом общей анестезии, учет которого необходим при оценке эффекта вводимого на этом фоне общего анестетика.
В этом разделе приводится характеристика внутривенных наркотических средств, общей характерной чертой которых является глобальное дезорганизующее действие на ЦНС с развитием потери сознания и снижения реакций на внешние раздражители. Другие средства внутривенной общей анестезии с избирательным диапазоном центрального действия (наркотические анальгетики, транквилизаторы, нейролептики) рассматриваются в разделе, посвященном специальным методам комбинированной общей анестезии.
|
|
|
Впервые мысль о введении лекарственных веществ непосредственно в кровяное русло была высказана еще в XVII в. Ч. Вреном, который вводил внутривенно собакам раствор опия. Однако началом эпохи внутривенной анестезии следует, по-видимому, считать 1857 г., когда Н.И. Пирогов впервые внутривенно ввел человеку эфир с целью достижения наркоза. В последующие десятилетия этот способ анестезии был забыт из-за отсутствия безопасных и эффективных фармакологических средств.
Внедрение внутривенной анестезии в клинику в начале 1900-х годов связано с именем Н.П. Кравкова, использовавшего для этой цели гедонал. Главным рубежом, повлиявшим на весь ход развития анестезиологии, явились 30-е годы XX в.: был синтезирован и впервые применен для внутривенной анестезии барбитуровый препарат короткого действия эвипан-натрий [Weese H., Scharpff W., 1932]. С тех пор внутривенный наркоз получил широкое распространение в анестезиологии. Примерно в течение двух десятилетий барбитураты считались единственным средством внутривенной анестезии. Клиническая фармакология барбитуратов подробно освещена как в зарубежной, так и в отечественной литературе.
В силу своих преимуществ (простота и удобство применения, доступность, легкая управляемость анестезией) барбитураты, как и 40 лет назад, широко используются, но по мере накопления опыта выявились серьезные недостатки, ограничивающие их применение у многих больных и послужившие стимулом к изысканию новых, более совершенных небарбитуровых средств внутривенной анестезии. За полвека, прошедшие со времени открытия барбитуратов, анестезиология обогатилась многими средствами внутривенной общей анестезии разнообразной химической природы и с разным спектром свойств. Среди них препараты короткого и длительного действия, разной степени токсичности и выраженности анестетического эффекта.
|
|
|
Несмотря на разнообразие свойств, средства внутривенной анестезии, как и ингаляционной, объединены одной общей закономерностью: главным и непременным проявлением их действия служит выключение сознания, в основе которого лежит обратимая функциональная блокада диффузной активирующей системы — ретикулярной формации среднего мозга, а подавление реакции на внешние раздражители, т.е. развитие общей анестезии как таковой происходит вторично, нередко на фоне глубокой общей наркотической депресси ЦНС. Исключением из этого ряда является кетамин, мощное анальгетическое действие которого проявляется при частично или полностью сохраненном сознании. Нейрофизиологические механизмы действия этого общего местетика своеобразны (см. ниже) и не позволяют поставить его в один ряд с другими препаратами.
Многие из некогда популярных внутривенных общих анестетиков в настоящ ее время утратили свое практическое значение и вытеснены новыми, более совершенными. Это относится, например, к наркотическим препаратам так называемого метаболического ряда (т.е. близким по химической структуре некоторым веществам человеческого организма): геминеврину, имеющему слишком слабые анестетические свойства, и виадрилу, применение которого было ограничено вследствие раздражающего влияния его на сосудистую стенку и нередкого развития посленаркозных флебитов. Другие существующие два-три десятилетия внутривенные общие анестетики, прошедшие этап интенсивного клинического изучения, имеют ограниченные показания к применению (пропанидид, натрия оксибутират). Наконец, ряд препаратов последнего поколения (альтезин, кетамин, этомидат) находятся в стадии широкого клинического применения и клинико-экспериментальных исследований. Поиск новых препаратов этого типа продолжается, но не столь интенсивно, как прежде, поскольку в последние 20 лет усилия химиков, фармакологов и клиницистов в значительной степени переключены на создание и внедрение в практику внутривенных анестетиков с селективными свойствами (анальгетики, транквилизаторы, нейролептики). Вместе с тем внутривенные наркотические препараты по-прежнему имеют широкое применение в анестезиологии как для вводной анестезии, так и для самостоятельного обезболивания при ряде оперативных вмешательств и диагностических исследований.
|
|
|
Общая анестезия барбитуратами. Среди существующих средств общей анестезии барбитураты наиболее прочно сохраняют свое место в практической анестезиологии на протяжении вот уже полувека, являясь типичными представителями наркотических веществ. Несмотря на создание за этот период многих сотен производных барбитуровой кислоты, не выявлено их существенных преимуществ перед старыми, классическими представителями этого ряда — тиопентал-натрием и гексеналом, которые продолжают широко применяться как в отечественной, так и в зарубежной анестезиологии.
Физико-химические свойства и фармакокинетика. Гексенал (натрия эвипан) представляет собой натриевую соль барбитуровой кислоты, а тиопентал-натрий (пентотал) — натриевую соль тиобарбитуровой кислоты. Оба препарата легко образуют нестойкие водные растворы с резко щелочной реакцией (рН более 10,0), которые должны быть использованы в течение 1 ч с момента приготовления. Целесообразно медленное введение слабо концентрированных (1—2%) растворов обоих препаратов для получения менее выраженного наркотического действия, без нарушения жизненно важных функций. Начальная доза барбитуратов колеблется от 3 до 10 мг/кг в зависимости от физического состояния, возраста больного и характера преднаркозной подготовки. Длительность наркотического сна не превышает 20 мин. В связи с небольшой широтой терапевтического действия и значительной кумулятивной способностью барбитуратов разовая доза их не должна превышать 1 г.
В развитии эффекта барбитуратов, особенно тиопентал-натрия, большое значение имеет фактор связывания их с белками плазмы, так как только свободная (несвязанная) часть препарата оказывает активное действие, включаясь в распределение между жидкими средами организма, в том числе мозга. Состояние белкового обмена, в частности уровень белка в крови, может непосредственно влиять на глубину и длительность барбитуровой общей анестезии, увеличивающиеся в условиях гипопротеинемии. Связь барбитуратов с белками уменьшается и, следовательно, действие их усиливается в условиях ацидоза и ослабляется при алкалозе (гипервентиляция). Следующей фазой распределения барбитуратов в организме является накопление их в жировых депо, происходящее в течение нескольких часов с момента введения однократной дозы. Из жировых депо они постепенно поступают в кровь, а затем в печень для инактивации. Таким образом, процессы распределения и дезактивации барбитуратов в организме продолжаются много часов после окончания общей анестезии. Опасность кумуляции при введении повторных доз сохраняется более суток даже при полноценной функции печени. Расщепление барбитуратов в печеночных микросомах идет с торможением «печеночного дыхания». Этот процесс нарушается при снижении интенсивности углеводного обмена в печени. Улучшению его способствует преднаркозное введение растворов глюкозы. Продукты расщепления барбитуратов выводятся почками.
|
|
|
Методика общей анестезии. Барбитураты применяются главным образом для вводной и кратковременной анестезии при инструментальных эндоскопических исследованиях. Для длительной общей анестезии их применение не показано и даже опасно из-за слабых анестетических свойств и описанных выше фармакокинетических особенностей. Для премедикации перед барбитуровой анестезией целесообразно использовать комбинацию транквилизатора (для устранения эмоционального стресса), ваголитика (для смягчения присущего барбитуратам, особенно тиопентал-натрию, холинергического действия) и анальгетика (для усиления недостаточного анальгетического эффекта барбитуратов). Доступной и действенной является премедикация диазепамом (0,14 мг/кг), промедолом (0,3 мг/кг) и атропином (0,01 мг/кг) за 40 мин до начала анестезии. Включение в премедикацию нейролептика дроперидола может способствовать усугублению депрессии кровообращения в период индукции барбитуратами. Все компоненты указанной выше премедикации обладают потенцирующими свойствами в отношении наркотических веществ и облегчают введение больного в состояние общей анестезии. Индукционная доза барбитуратов, как правило, не превышает 5 мг/кг, у больных старческого возраста — 3 мг/кг, что снижает вероятность депрессии кровообращения. Свежеприготовленный 1—2% раствор тиопентал-натрия или гексенала медленно вводят в вену (каждые 100 мг в течение 30—60 с) под контролем состояния больного. Клиническая и электроэнцефалографическая картина общей анестезии. Первые клинические проявления наступают спустя 1—2 мин от начала введения наркотика и характеризуются снятием психического напряжения, легким головокружением, ощущением опьянения, иногда эйфорией и речевым возбуждением, которые в сочетании с расширением зрачков и появлением на ЭЭГ высокоамплитудной быстрой активности (рис. 14.1) отражают начало стадии возбуждения ЦНС. При медленном введении наркотика на фоне премедикации в этой стадии никогда не возникает двигательных проявлений. Спустя еще минуту наступает помутнение, а затем потеря сознания, которой на ЭЭГ соответствует стадия высокоамплитудных смешанных волн (4—20 Гц), нередко с группами так называемых барбитуровых веретен (14 Гц). Выключение сознания не означает развития стабильной общей анестезии. В этот момент отмечаются чрезмерно живые роговичные и зрачковые рефлексы, децентрация глазных яблок и усиление двигательной реакции на болевые раздражители.
|
|
|
Клиническая симптоматика гиперрефлексии в сочетании с повышением интенсивности биоэлектрических процессов головного мозга и увеличением амплитуды неспецифического компонента вызванных потенциалов на все виды раздражителей соответствуют кульминации стадии возбуждения, во время которой нельзя начинать какие-либо манипуляции, в частности интубацию трахеи, так как могут возникнуть патологические рефлексы: артериальная гипертензия, тахикардия, аритмии сердца, ларинго- и бронхоспазм. Дальнейшее введение анестетика приводит к стабилизации общей анестезии со снижением выраженности указанных выше рефлексов, сужением зрачков, центральным расположением глазных яблок на фоне замедления ритмов ЭЭГ до 2—3 Гц. Только после достижения этого этапа можно прекратить введение общего анестетика и перейти к выполнению интубации трахеи или других манипуляций.
Bместе с тем даже при соблюдении данною условия выполнение интубации трахеи после предварительного введения миорелаксанта неизбежно сопровождается симпатомиметической реакцией кровообращения: повышением артериального давления и частоты сердечных сокращений, иногда нарушениями ритма сердца. Такая реакция сохраняется и при углублении барбитуровой анестезии до IV—V стадии изменений ЭЭГ, характеризующихся постепенным падением амплитуды биопотенциалов вплоть до изоэлектрической линии и сопряженных с нарастающей депрессией кровообращения и дыхания. Это указывает на слабый уровень анестезии и арефлексии при использовании барбитуратов в чистом виде, что подтверждают данные экспериментальных исследований: барбитураты не только не уменьшают специфические ответы (соматосенсорные вызванные потенциалы) в ответ на внешние раздражители, но способствуют их выявлению на фоне общего подавления спонтанной электрической активности мозга при глубокой анестезии. Многие авторы относят барбитураты к разряду не наркотиков, а «гипнотиков», вызывающих только состояние глубокого сна, в основе которого лежит депрессия коры и ретикулярной формации среднего мозга [Дарбинян Т.М., Головчинский В.В., 1972).
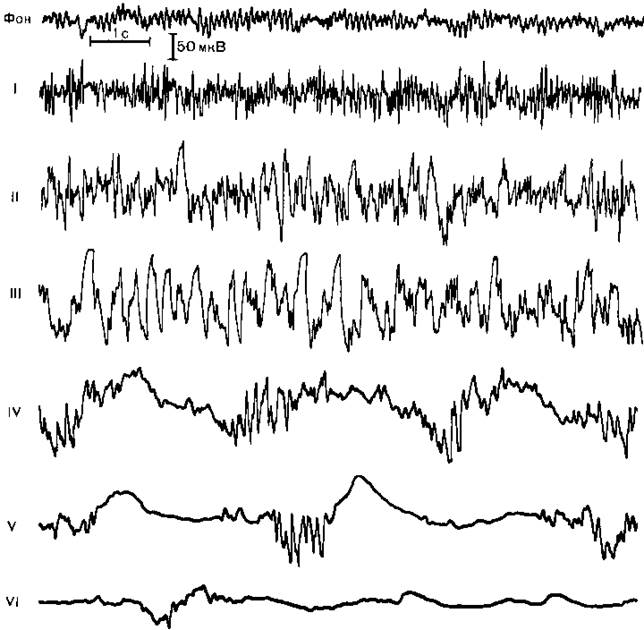
Рис. 14.1. Электроэнцефалографические стадии барбитурового наркоза.
I стадия электрической гиперам явности, II стадия высокоамплитудных смешанных волн, III стадия преобладания высокоамплитудной (150—200 мкВ) А активности частотой 3 Гц, IV стадия чередования участков падения амплитуды ЭЭГ длительностью 1—2 с и вспышек волн, имеющих частоту Ь К) Гц и амплитуду 50 100 мкВ, V и VI стадии прогрессирующею падения амплитуды биопотенциалов до 50 и 20 мкВ и увеличения периодов «немых зон» более чем до 5 и 10 с.
В связи с этим применение барбитуратов в чистом виде, особенно у больных с сердечно-сосудистой патологией, нецелесообразно. Эффективность анестезии и арефлексии может быть достигнута при сочетании барбитуратов с фентанилом 2—5 мкг/кг. Необходимую для индукции дозу анестетика при этом уменьшают примерно вдвое [Parker E.О., Ross A.L., 1982].
Изучение нейрофизиологических и нейрохимических механизмов барбитуровой общей анестезии, несмотря на полувековой период существования барбитуратов, не закончено. Есть предположение, что в ЦНС существуют специфические рецепторы связывания барбитуратов (так же, как в отношении анальгетиков и других нейротропных средств), ответственные за реализацию их седативного, гипнотического и анестетического действия [Mark L.С. et al., 1982].
Влияние на организм. В действии барбитуратов на ЦНС важное клиническое значение имеют депрессия дыхательного и сосудодвигательного центров, а также повышение активности центров парасимпатической нервной системы. Барбитураты приводят к значительному снижению активности обменных процессов в клетках мозга и вследствие этого к уменьшению мозгового кровотока, что используется как лечебный фактор при постреанимационной патологии мозга. Действие барбитуратов на функцию дыхания определяется центральной депрессией дыхания, пропорциональной глубине общей анестезии и повышением тонуса бронхиальной мускулатуры, имеющим ваготоническую природу. Последнее редко выявляется клинически, но при недостаточной атропинизации и глубине анестезии у ваготоников и больных бронхиальной астмой может способствовать развитию бронхоспазма при введении интубационной трубки или эндоскопа в дыхательные пути. Действие на кровообращение заключается в значительно выраженной депрессии миокарда [Гологорский В.А. и др., 1979] и умеренной вазодилатации центрального происхождения, результатом которых являются снижение артериального давления, ударного объема сердца и компенсаторное увеличение частоты сердечных сокращений.
По данным Т.М. Дарбиняна (1984), у больных ишемической болезнью сердца кардиодепрессорный эффект барбитуратов (даже в 1% растворе) резко выражен. Он сопровождается падением ударного индекса с последующей постинтубационной гипердинамической реакцией кровообращения, что свидетельствует о непригодности барбитуратов для этого контингента больных.
Действие барбитуратов на непораженные печень и почки носит характер преходящего функционального ограничения. Однако, учитывая, что эти паренхиматозные органы осуществляют дезактивацию и экскрецию барбитуратов, применять последние при исходно нарушенной функции печени или почек нецелесообразно.
Показания. Барбитураты используют для вводной и общей анестезии, при эндоскопических исследованиях, как компонент постреанимационной реабилитации функций ЦНС.
Противопоказания: сердечно-сосудистая, печеночная, почечная недостаточность, тяжелая бронхиальная астма. Абсолютным противопоказанием является острая интермиттирующая порфирия, так как барбитураты повышают синтез порфиринов, что может повлечь за собой смертельный исход.
Общая анестезия пропанидидом. Пропанидид (эпонтол фирмы «Baier», ФРГ; сомбревин фирмы «Гедеон Рихтер», ВНР) небарбитуровый анесстетик ультракороткого действия. Применяется в анестезиологии с 1964 г.
Физико-химические свойства и фармакокинетикa. Пропанидид представляет собой пропиловый эфир фенолуксусной кислоты. Выпускается в ампулах по 10 мл и представляет собой вязкий маслянистый раствор желтовато-белого цвета, приготовленный с использованием специального растворителя кремофора, так как в воде субстанция препарата нерастворима. В ампуле содержится 500 мг препарата. Пропанидид занимает особое место среди наркотических агентов благодаря своему ультракороткому эффекту (3—6 мин). В печени и крови быстро происходит его ферментативное расщепление до наркотически неактивных метаболитов. Через 25 мин с момента введения препарат перестает определяться в крови. Как и барбитураты, пропанидид частично связывается белками плазмы, наркотическое же действие оказывает свободная часть препарата, поэтому необходимая наркотическая доза его снижается при гипопротеинемии. Продукты ферментативного расщепления пропанидида выделяются с мочой в течение 2 ч.
Методика общей анестезии. Для премедикации за 30—40 мин до общей анестезии чаще всего используют промедол и атропин в общепринятых дозах в сочетании с антигистаминным средством (димедрол или дипразин в дозе 0,7—0,8 мг/кг) для профилактики реакций, связанных с высвобождением эндогенного гистамина (см. ниже). Для индукции или кратковременной анестезии при эндоскопических исследованиях или хирургических вмешательствах (вскрытие абсцессов, выскабливание полости матки и др.) пропанидид применяют в дозе 6—10 мг/кг, у пожилых и ослабленных больных — 3—4 мг/кг. Для более плавного развития общей анестезии и смягчения присущих препарату побочных эффектов время введения должно составлять не менее 30 с. При этом продолжительность общей анестезии равна 3—5 мин. Увеличения ее можно достичь повторным применением наркотика либо комбинацией его с другими общими анестетиками.
Удобна методика введения в одном шприце хорошо совместимых растворов пропанидида и натрия оксибутирата. Вводят по 1 ампуле каждого препарата. При этом доза первого из них составляет 8—10 мг/кг, второго — 20—40 мг/кг. Это позволяет увеличить продолжительность общей анестезии до 6—8 мин и смягчить побочные вегетативные эффекты пропанидида.
Широкое применение для целей вводной анестезии имеет метод Дарбиняна. Первоначально вводят фентанил в дозе 4—5 мкг/кг (0,1 мл/кг), а затем пропанидид (5 мг/кг) в сочетании с 10 мл 10% раствора кальция хлорида или кальция глюконата. Вводная анестезия по этой методике характеризуется отсутствием свойственных пропанидиду в чистом виде тахикардии, гипервентиляции, а также реакции сердечно-сосудистой системы в ответ на интубацию трахеи, но сопровождается резко выраженной депрессией дыхания, часто апноэ. При вводной анестезии это не опасно, так как совпадает с периодом введения мышечного релаксанта и последующим выполнением интубации трахеи. В случаях проведения общей анестезии при кратковременных амбулаторных вмешательствах с самостоятельным дыханием больных этот метод использовать нецелесообразно, так как почти всегда необходима ИВЛ.
Существуют методы длительного поддержания общей анестезии на основе капельной инфузии пропанидида в сочетании с ингаляцией закиси азота [Dixneuf В. et al., 1973] и малыми дозами фентанила [Полюхов С М. и др., 1981]. При операциях длительностью несколько часов общий расход пропанидида может достигать 20 г. Применение этих методов связано со многими побочными явлениями (тахикардия, гипотензия, судороги, посленаркозное возбуждение, кожные аллергические реакции и др) и потому мало оправдано.
Клиническая и электроэнцефалографическая картина общей анестезии. Общая анестезия пропанидидом отличается стремительностью развития При использовании доз 6—10 мг/кг и средней скорости введения спустя 15—30 с от начала введении наркотика внезапно наступает (он Выключение сознания сочетается с возникновением характерного комплекса вегетативных реакций: резкого увеличения частоты дыхания и сердечных сокращений, расширения зрачков до 3—4 мм в диаметре. Этот специфический для общей анестезии пропанидидом вегетативный криз сопровождается более быстрым, чем при использовании барбитуратов, нарастанием на ЭЭГ высокоамплитудной медленной активности (3—6 Гц) и является клиническим выражением фазы возбуждения определенных подкорковых структур, вероятнее всего гипоталамуса — центра вегетативной регуляции [Осипова Н.А и др., 1981].
В последующие несколько секунд происходит стабилизация анестезии: зрачки суживаются, частота сердечных сокращений приобретает тенденцию к нормализации, легочная гипервентиляция прекращается и сменяется гиповентиляцией или апноэ продолжительностью 10—30 с; артериальное давление умеренно понижается (у пациентов старческого возраста возможна значительная гипотензия). Этой клинической симптоматике соответствует картина ЭЭГ, аналогичная IV стадии барбитуровой анестезии (см. рис. 14.1), отражающая дальнейшее замедление биопотенциалов с периодическим снижением их амплитуды. В этой фазе общей анестезии целесообразно приступить к выполнению вмешательств и манипуляций.
При использовании препарата в дозе выше 10 мг/кг анестезия может быть доведена до более глубоких уровней, которые в сравнении с барбитуровой анестезией характеризуются не только нарастанием депрессии кровообращения (гипотензия), дыхания и биоэлектрической активности мозга с появлением зон электрического «молчания», но и нередко симптомами мышечной гиперактивности (судорожные подергивания мышц конечностей, диафрагмы по типу икоты или кашля, горизонтальный нистагм). При этом в отличие от барбитуровой анестезии V—VI стадии на ЭЭГ на фоне участков изоэлектрического «молчания» периодически возникают короткие пароксизмы остроконечной активности, пиковые разряды и судорожные комплексы пик—волна, свидетельствующие о распространении на кору судорожного возбуждения из подкорковых структур.
Судорожные симптомы при общей анестезии пропанидидом описаны многими авторами, R. Von Sutterlin (1982) подтвердил эпилептоидные свойства этого препарата специальными электроэнцефалографическими исследованиями. По его данным, у больных эпилепсией пропанидид особенно часто провоцировал судорожное возбуждение ЦНС, приводя к появлению судорожной активности на ЭЭГ в виде спайков, острых волн и комплексов пик—волна в сочетании с клинически выраженными судорогами.
Оценивая анестетические свойства пропанидида, следует исходить из двухфазности нейрофизиологического механизма его действия. Тотчас после выключения сознания усиливаются реакции на внешние раздражители. При клинико-экспериментальных исследованиях в это время установлено снижение порогов вызванных ответов в проекционной зоне коры и ядрах таламуса, ответственных за передачу болевой импульсации [Дарбинян Т.М., Головчинский В.Б., 1972]. Только при наступлении стабильной фазы общей анестезии развивается торможение передачи болевой импульсации по таламокортикальным путям. Пропанидид принято считать более эффективным общим анестетиком, чем барбитураты. Однако в чистом виде пропанидид не способен защитить организм от мощных болевых и рефлекторных воздействий. Результаты специальных гемодинамических исследований показывают, что только при сочетании его с фентанилом (5 мкг/кг) можно предотвратить артериальную гипертензию и тахикардию, возникающие в ответ на интубацию трахеи [Дарбинян Т.М., Хашман Т.А., 1982]
Необходимо подчеркнуть, что главными чертами общей анестезии пропанидидом являются ее кратковременность и быстрое постнаркозное восстановление всех функций ЦНС. Данные специальных исследований [Бажанов Н.Н., Ганина С.С., 1979; Татарский М.Л., Плотников В.В., 1979; Камышов Я.М., 1981, 1985, и др.] свидетельствуют о быстром, в течение нескольких минут, восстановлении психомоторных функций и биоэлектрической активности мозга, что делает пропанидид незаменимым для обезболивания в амбулаторной практике. По мнению большинства исследователей, срок пребывания больного в лечебном учреждении после общей анестезии может быть ограничен 1 ч, а затем без всякого риска его можно отпустить домой.
Действие на организм. Описанные выше быстро преходящие, но значительные изменения дыхания и кровообращения, возникающие под влиянием пропанидида, обусловлены начальным подкорковым активирующим действием препарата и сменяются последующей умеренной депрессией этих функций. Практическое значение кратковременной гипервентиляции и последующей гиповентиляции невелико, так как они не отражаются на состоянии газообмена. Действие пропанидида на кровообращение складывается из кратковременной центральной стимуляции частоты сердечных сокращений с одновременным снижением среднего артериального давления и сердечного индекса за счет кардиодепрессивного действия препарата. Многочисленными исследованиями показано, что гиподинамическая реакция кровообращения при вводной анестезии пропанидидом, как и при других видах внутривенной моноанестезии, сменяется резкой гипердинамической реакцией (артериальная гипертензия, тахикардия, повышение сердечного индекса) в ответ на выполнение интубации трахеи [Дарбинян Т.М., Хашман Т.А., 1982; Бунятян А.А. и др., 1983].
Как отмечено выше, смягчения нежелательных центральных эффектов пропанидида можно достичь путем сочетания его с препаратами противоположного центрального действия (фентанил, натрия оксибутират). При вводной анестезии особенно целесообразна комбинация пропанидида с фентанилом, позволяющая избежать центральных вегетативных реакций, кардиодепрессии, а также постинтубационной реакции кровообращения даже у больных гипертонической болезнью. Пропанидид вызывает быстро наступающее и значительное (на 45%) снижение мозгового кровотока с последующим восстановлением его к 10-й минуте после введения наркотика. Это создает ограничения к его применению у больных пожилого возраста с явлениями церебрального склероза.
По данным экспериментальных и клинико-биохимических исследований, действие пропанидида на печень незначительно и при использовании обычных наркотических доз биохимически не проявляется. В больших дозах препарат может вызывать преходящие функциональные сдвиги (увеличение концентрации билирубина в крови, угнетение окислительного и углеводного обмена печени). Существенного влияния на функцию почек пропанидид не оказывает.
В инструкциях по использованию пропанидида указаны его гемолитические свойства и противопоказания к применению при гемолитической анемии.
Способность пропанидида высвобождать эндогенный гистамин может быть причиной тяжелых осложнений по типу гистаминового шока с развитием трудно купируемых артериальной гипотензии, тахикардии, бронхоспазма. Описаны случаи смертельного исхода. В связи с этим целесообразно включать в премедикацию антигистаминные средства.
Показания к применению пропанидида обусловлены спецификой его наркотического эффекта. Его используют при кратковременных, в том числе амбулаторных, вмешательствах, инструментальных диагностических исследованиях, а также при вводной анестезии. Особые преимущества этого препарата в амбулатрной практике общеизвестны. Пропанидид не имеет себе равных по быстроте посленаркозного восстановления всех функции организма.
Противопоказания: указания в анамнезе на аллергические явления, бронхиальная астма, эпилепсия, гемолитическая анемия, недостаточность кровообращения. Большой осторожности требует применение пропанидида у пациентов старческого возраста.
Стероидная общая анестезия. Первым препаратом стероидного ряда, нашедшим применение в анестезиологии, был гидроксидион (виадрил, пресурен, предион), близкий по химической структуре к гормонам коры надпочечников, но лишенный гормональной активности. После синтеза в 1955 г. виадрил широко применялся в США, а затем в Европе и в нашей стране на протяжении около 20 лет. Являясь препаратом метаболического ряда, он отличается минимальной токсичностью и большой терапевтической широтой действия благодаря сходству с естественными метаболитами человеческого организма. Это обусловливает особые преимущества применения его у больных с нарушением функции паренхиматозных органов, при анестезии в родах и при длительной терапии некоторых патологических состояний (столбняк, алкогольный психоз). Однако важным недостатком является местное раздражающее воздействие препарата на ткани, нередко приводящее к развитию флебитов. Это послужило причиной постепенного ограничения клинического использования виадрила. В настоящее время этот вид общей анестезии представляет в основном исторический интерес, несмотря на то что в нашей стране виадрил воссоздан в 1961 г. в лабораториях ВНИХФИ под названием «предион». Медицинской промышленностью он не производится.
Альтезин (альфатезин, СТ-1341) — новый представитель наркотических агентов стероидного ряда, синтезированный в Великобритании в начале 70-х годов.
Физико-химические свойства и фармакокинетика. Альтезин представляет собой смесь двух прегнандионовых дериватов: стероида I — альфаксолона и стероида II — альфадолона, растворенных в кремофоре — 20% растворе полиоксиэтилированного касторового масла в воде. Стандартный раствор содержит 9 мг стероида I и 3 мг стероида II; рН его близок к нейтральному. Учитывая неоднородный состав препарата, его принято дозировать не в миллиграммах, а в миллилитрах на 1 кг массы тела. Препарат не обладает гормональной активностью. В отличие от виадрила раздражающего влияния на эндотелий сосудов, даже артериальных, не оказывает.
По данным фирмы «Glaxo» (Великобритания), альтезин оказывает широкое терапевтическое действие. Его терапевтический индекс в 4,5 раза выше, чем тиопентал-натрия. Он удаляется из кровотока и инактивируется печенью, не перераспределяясь в тканях, чем объясняются кратковременность его действия и отсутствие кумуляции.
Методика анестезии. Анестезию целесообразно начинать на фоне эффективной премедикации с использованием транквилизатора (нейролептика), анальгетика и ваголитика. Вводная доза составляет 0,07—0,15 мл/кг, время введения 1—2 мин. Для анестезии во время операций и диагностических манипуляций можно вводить альтезин капельно.
Клиническая и электроэнцефалографическая картина общей анестезии. Выключение сознания наступает через 15—30 с от начала введения анестетика при картине высокоамплитудного гиперсинхронного 6-ритма 2,5—3 Гц, аналогичного III стадии изменений ЭЭГ при барбитуровой анестезии (см. рис. 14.1). Предшествующие две стадии — электрической гиперактивности и смешанных волн чрезвычайно кратковременны и клинически не проявляются. Спустя 20—30 с после выключения сознания наступает стабилизация анестезии: фиксация глазных яблок в центральном положении, резкое ослабление роговичного рефлекса, релаксация языкоглоточной мускулатуры, снижение артериальною давления на 10—20 мм рт. Ст.г (при стабильной частоте сердечных сокращений) и депрессия дыхания (поверхностное учащенное дыхание, нередко апноэ, реже периодическое дыхание типа Чейна—Стокса). На ЭЭГ при этом регистрируются медленные 6-волны частотой 1—3 Гц, чередующиеся с участками смешанных ритмов малой амплитуды: IV стадия альтезиновой общей анестезии, аналогичная барбитуровой.
При дозе альтезина свыше 0,1 мл/кг общая анестезия достигает более глубоких уровней, характеризующихся резкой депрессией дыхания, часто апноэ, некоторым увеличением частоты сердечных сокращений, нарастанием артериальной гипотензии и релаксации языкоглоточной мускулатуры, углублением депрессии биоэлектрической активности мозга до V—VI стадии. При такой глубине анестезии возможна интубация трахеи без применения мышечных релаксантов. Примерно у трети больных наступление альтезиновой анестезии сопровождается судорожными подергиваниями отдельных групп скелетных мышц, редко – значительным двигательным возбуждением.
Продолжительность действия альнмина при использовании средних доз (0,07—0,1 мл/кг) не превышает 10 мин. Предварительное применение диазепама 0,12- 0,14 мг/кг удлиняет амнемезию до 15 -18 мин.
Таким образом, по кратковременности действия альтезин больше всего приближается к пропанидиду. По данным N North и соавт. (1973), психомоторные функции после общей анестезии альтензином у 82% больных восстанавливаются в среднем через 33 мин, у остальных позже. Все же в быстоте восстановления функциональной активности ЦНС альтезин уступает пропанидиду [Cailiard В., 1980).
Альтезин, как и барбитураты, является слабым анестетиком, мало подавляющим болевые и рефлекторные реакции в ответ на интубацию трахеи и хирургические манипуляции, поэтому большинство исследователей указывают на необходимость сочетания его при вводной анестезии с наркотическими анальгетиками или местной анестезией дыхательных путей, а при оперативных вмешательствах – с наркотическими анальгетиками и и ингаляционными анестетиками: закисью азота, галотаном, энтраном и др. [Lanza V. et al., 1979; Caiilarcl В., 1980. и др.].
Действие на организм. Для общей анестезии альтезином наиболее типичны нарушения дыхания центрального типа гиповенгилнция, апноэ, расстройства ритма, хотя частота и степень их значительно уменьшаются при медленном (более 1 мин) введении препарата. Во время индукции нарушения дыхания существенного значения не имеют, так как сразу после выключения сознания следуют введение миорелахсанта, интубация трахеи и ИВЛ. При альтезиновой же анестезии с самостоятельным дыханием больных во время диагностических исследований и манипуляций необходимо быть готовым к обеспечению вспомогательной или искусственной вентиляции легких.
Гемодинамические эффекты альтезина весьма умеренны и проявляются небольшой периферической вазодилатацией, снижением артериального давления и увеличением частоты сердечных сокращений на 10—20% [Бунятян А.А. и др, 1976] в отсутствие изменений ЭКГ и сердечного выброса. Наряду с этим значительно снижается мозговой кровоток. Гипотензивный эффект в сочетании с уменьшением мозгового кровотока является ограничением к применению препарата у больных пожилого возраста с атеросклерозом сосудов головного мозга и при гипертонической болезни.
В терапевтических дозах альтезин не оказывает токсическою воздействия на печень и почки.
Анафилактические реакции у человека при применении альтезина не описаны, хотя, как и пр
|
|
|


