 |
Основные формулы для расчета термодинамических процессов идеальных газов
|
|
|
|
| Название процесса | Показа-тель поли-тропы n | Тепло-емкость, Сх | Уравнение процесса | Зависимость между параметрами | Изменение внутренней энергии, ΔU | Работа расширения, l | Теплота, q | Измене- ние энтальпии, Δh | Измене-ние энтропии, Δ S |
| Изохор-ный | ±∞ | Cυ | υ= const | 
| 
|  
| 
| 
| |
| Изобар-ный | Cp | P= const |  υ1 / υ2 = T1 / T2 υ1 / υ2 = T1 / T2
| 
| 

|  
| 
| 
| |
| Изотерми-ческий | ∞ | Pυ= const | P1 / P2 = υ2 / υ1 | 

|  
| 

| |||
| Адиа-батный | k | Pυk= const | P1 / P2 = (υ2/υ1)k T1/T2 = (υ2/υ1)k-1 T1/T2=(P1/P2)(k-1)/k |  ΔU = l
ΔU = l
| 
 
| 
| 
| ||
| Поли-троп-ный | + ∞ ÷ - ∞ | 
| Pυn= const | P2/P1 = (υ1/υ2)k T2/T1 = (υ1/υ2)k-1 T2/T1=(P2/P1)(k-1)/k | 
| 

|  
| 
| 
|
Примеры решения задач
Пример 1.1. Избыточное давление в паровом котле, измеренное пружинным манометром Ри = 2500 кПа. Барометрическое давление 765 мм.рт.ст. Определить абсолютное давление в котле.
Решение. Абсолютное давление в котле определяется по формуле 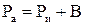 ;
;
1 мм.рт.ст. создает давление 133,32 Па, а 766 мм.рт.ст. соответствует давлению 101991,33 Па ≈102 кПа. Следовательно, абсолютное давление в котле:
 кПа = 2,6 МПа.
кПа = 2,6 МПа.
Пример 1.2. В резервуаре объемом 10 литров находится воздух при температуре 17 0С, и в избыточном давлении 0,1 ат. Сколько воздуха нужно откачать из резервуара, чтобы в нем создать вакуум 540 мм.рт.ст. Барометрическое давление 754 мм.рт.ст.
Решение. Масса удаленного воздуха находится как разность масс воздуха в баллоне до и после откачивания 
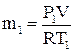 ;
;  ,
,
Р1 и Р2 – абсолютное давление в резервуаре до и после удаления воздуха.
 Па
Па
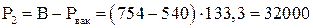 Па
Па
 Дж/кг∙К
Дж/кг∙К
V = 0,01м3; Т1 = 17 + 273 = 290 К; Т2 = 27 + 273 = 300 К.
 кг.
кг.
Пример 1.3. Объемные доли компонентов смеси идеальных газов: 20% СО2, 20% N2, 60% Н2. Давление смеси 2 МПа, температура 400 0С. Найти парциальные давления компонентов, их массовые доли, молярную массу и плотность смеси при нормальных условиях и условиях, указанных в задаче. Найти количество теплоты, которое необходимо отвести от 1 кг смеси, чтобы охладить ее до 0 0С при постоянном давлении.
|
|
|
Решение. Парциальное давление компонентов:
 МПа = 400 кПа;
МПа = 400 кПа;
 ;
;
 .
.
Молярная масса смеси:
 .
.
Массовые доли компонентов:
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 - средняя в интервале температур 0 – 400 0C массовая теплоемкость газовой смеси при постоянном давлении
- средняя в интервале температур 0 – 400 0C массовая теплоемкость газовой смеси при постоянном давлении

Средние массовые теплоемкости компонентов находим используя таблицу 2
 кДж/(кг∙К)
кДж/(кг∙К)
 кДж/(кг∙К)
кДж/(кг∙К)
 кДж/(кг∙К)
кДж/(кг∙К)
 кДж/(кг∙К)
кДж/(кг∙К)
q = 2,093∙(-400) = - 837 кДж/(кг∙К)
Знак «-» показывает, что теплота отводится от газовой смеси.
Пример 1.4. В закрытом сосуде объемом 0,8 м3 находится двуокись углерода при
Р1 = 2,2 МПа и t1 = 20 0C. Газу сообщается 4600 кДж теплоты.
Определить температуру и давление двуокиси углерода в конце процесса.
Примечание. Теплоемкость считать не зависящей от температуры.
Решение: Количество теплоты, выраженное через теплоемкость и разность температур, равно:
 ,
,
отсюда
 .
.
Масса газа
 ,
,
где  .
.
Массовую теплоемкость СО2 при постоянном объеме вычислим из мольной теплоемкости  v (табл.) для многоатомных газов
v (табл.) для многоатомных газов

Давление в конечном состоянии
 .
.
Пример 1.5. Кислород, имеющий массу 10 кг и температуру 27 0С при нагревании при постоянном давлении Р = 0,3 МПа увеличивает объем в 1,5 раза. Определить конечную температуру газа, работу и количество теплоты, изменение внутренней энергии и энтропии в этом процессе. Теплоемкость принять постоянной.
Решение:
Вычисляем конечную температуру:
T2 = T1(υ2 / υ1) = (27 + 273)1,5 = 450 0C
или
t2 = T2 - 273 = 177 0C
Находим работу расширения
L = m ∙ l = m ∙ R(T2 – T1) = 10 ∙ 8314 / 32(450 - 300) = 390 кДж.
Количество теплоты
Qp = m ∙ q = m ∙ Cp(t2 – t1) = m ∙ μCp / M(t2 – t1) = 10 ∙ (29,3 / 32)150 = 1373 кДж,
где мольная теплоемкость двухатомного газа μCp = 29,3 кДж/(моль∙ К).
|
|
|
Изменение внутренней энергии
ΔU = Qp – L = 1373 – 390 = 983 кДж.
Изменение энтропии
ΔS = m ∙ΔS = m ∙ Cp ∙ln(T2 / T1) = 10 ∙(29,3 / 32)ln(450 / 300) = 31 кДж/К.
Пример 1.6. 25 кг воздуха при 27 0С изотермически сжимаются до тех пор, пока давление не становится равным 4,15 МПа. На сжатие затрачивается работа L = -8,0 МДж. Найти начальные давления и объем, конечный объем и теплоту, отведенную от воздуха.
Решение: Работа сжатия воздуха равна:
L = m ∙ RTln(P1 / P2)
отсюда:
lnP1 = lnP2 + L / (m∙R∙T); P1 = exp(lnP2 = L / m ∙RT)
подставим значения величин и вычислим

P1 = 0,101 МПа.
Начальный объем найдем из уравнения состояния
V1 = m∙RT / P1 = 25 ∙ (287 ∙ 300) / 0,101 ∙ 106 = 21,3 м3.
Конечный объем найдем из соотношения между параметрами в изотермическом процессе.
V2 = P1 ∙ V1 / P2 = (0,101 ∙ 21,3) / 4,15 = 0,62 м3.
В изотермическом процессе теплота равна работе расширения
Q = L = -8 МДж.
Пример 1.7. В компрессор газотурбинной установки входят 5 кг воздуха с начальными параметрами: Р1 = 100 кПа и t1 = 27 0С. Воздух адиабатно сжимается до давления 400 кПа. Определить начальный и конечный объем, конечную температуру, работу сжатия и изменение внутренней энергии.
Решение: Начальный объем находим из уравнения состояния
V1 = m∙RT1 / P1 = 5∙287∙800/(1∙105) = 4,3 м3.
Конечный объем определяем из уравнения адиабаты
V2 = V1(P1 / P2)1/k = 4,3∙(100/4000)1/1,4 = 0,262 м3.
k – показатель адиабаты для двухатомного газа, k = 1,4.
Конечную температуру определили или из уравнения адиабаты или из уравнения состояния
T2 = P2∙V2 / (m∙R) = 4∙106 ∙ 0,262 / (5∙287) = 720.
Находим работу сжатия L = (P1V1 – P2V2)/(k - 1) = (0,1∙106∙4,3 –
- 4∙106∙0,262) ∙103/(1,4 - 1) = - 1550 кДж..
Изменение внутренней энергии вычисляем из 1-го закона термодинамики для адиабатного процесса
ΔU = - L = 1550 кДж.
Пример 1.8. 2 кг воздуха с начальной температурой t1 = 17 0C и давлением Р1 = 0,2 МПа сжимаются по политропе с уменьшением объема в 5раз. Давление в конце сжатия Р2 = 1,62 МПа. Определить работу и теплоту в процессе, изменение внутренней энергии и энтропии. Изобразить процесс в PV- и TS- диаграммах состояния. Теплоемкость считать постоянной.
Решение: Найдем показатель политропы сжатия
|
|
|

Температуру воздуха в конце сжатия определим, исходя из зависимости между параметрами состояния в политропном процессе
T2 = T1 (υ1 / υ2)n-1 = 290 ∙ 5(1,3 - 1) = 470 К.
Работа сжатия
L = mR(T1 – T2)/(n - 1 ) = 2 ∙0,287(290 - 470)/(1,3-1) = - 344 кДж.
Количество теплоты
Q = mCn (T2 – T1) =2(-0,24)(470 - 290) = -84 кДж.
Cn – теплоемкость в политропном процессе
Cn = Cυ(n - k)/(n - 1)=μCυ(n - k)/M(n - 1) = 20,95(1,3 – 1,4)/29(1,3 - 1) =
= -0,24кДж/кг∙К.
Изменение внутренней энергии
ΔU = Cυ(T2 – T1) = 20,95(470 - 290) = 130 кДж/кг.
Изменение энтропии
ΔS = Cnln(T2/T1) = -0,24ln(470/290) = -0,116 кДж/(кг∙К).
Примерный вид процесса в PV- и TS- координатах показан на рис.3.

Рис.3. Изображение политропного процесса (пример 1.8) в Рυ –и TS – диаграммах, 1-2 – политропный процесс с n = 1,3; 1-2΄ - адиабата; 1-2˝ - изотерма.
Пример расчета цикла
Задан цикл, состоящий из следующих процессов: 1-2 Р = const; 2-3 S=const; 3-4 υ= const; 4-1 n = 1,3; P1 = 0,1 МПа; Т1 = 338 К; Т2 = 273 К; Т3 = 433 К.
Дадим примерный вид цикла в Pυ- и TS- диаграммах (рис. 4). В Pυ – координатах построение начнем с процесса 1-2. Это изобарный процесс, идущий с уменьшением температуры, а следовательно, и с уменьшением объема. Т2 располагается левее точки 1.

Рис. 4. Примерное изображение цикла в Pυ – и TS – диаграммах.
2-3 – адиабатный процесс, идущий с увеличением температуры, а следовательно, с уменьшением объема (PdS = CvdT). Точка 3 располагается выше и левее т.2. 3-4 изохорный процесс, сопровождающийся ростом температуры. Точка 4 располагается выше т.3. Замыкает процесс политропа 4-1.
В TS диаграмме т.2 расположена ниже и левее точки 1, адиабата 2-3 изображается вертикальным отрезком, причем точка 3 будет расположена выше точки 1 (Т3 > Т1). Изохора 3-4 направлена от точки 3 вверх и вправо, но т. 4 должна располагаться левее точки 1, т.к. показатель 4-1 меньше показателя адиабаты. Определяем параметры состояния всех точек цикла. Из уравнения состояния найдем удельный объем воздуха в точке 1.
 м3/кг.
м3/кг.
Удельный объем V2 равен:
 м3/кг.
м3/кг.
Используя соотношение между параметрами состояния для адиабатного процесса, определим удельный объем v 3:
|
|
|
 ;
;  .
.
Давление Р3 равно:
 Па.
Па.
Температуру Т4 найдем из соотношения между параметрами в политропном процессе:
 ;
;  (3-4 изохора)
(3-4 изохора)
 К.
К.
Давление Р4 равно:
 Па.
Па.
Параметры состояния сводим в таблицу 4.
Таблица 4
| Точка | Р, МПа | м3/кг | Т, К |
| 0,1 | 0,97 | ||
| 0,1 | 0,78 | ||
| 0,52 | 0,24 | ||
| 0,62 | 0,24 |
Процесс 1-2 n= 0; C = Cp = 1,025;
q = Cp ∙ (T2 – T1) = 1,025 ∙ (273 - 338) = -67 кДж/кг;
ΔU = Cυ ∙ (T2 – T1) = (Cp - R)∙(T2 – T1) = (1,025 – 0,287)∙(273 - 338) = -48 кДж/кг;
C υ = Cp ∙ R = 1,025 – 0,287 = 0,738 кДж/(кг∙К);
l = P∙(υ2 – υ1) = 0,1∙105 (0,78 – 0,97) = -19000 Дж/кг = -19 кДж/кг;
ΔS = Cpln(T2 / T1) = 1,025∙ln(273 / 335) = 0,22 кДж/(кг∙К);
Δh = q = -67 кДж/кг.
Процесс 2-3 n = k, C = 0.
q = 0;
ΔU = C υ (T3 – T2) = 0,738∙(433 - 273) = 119 кДж/(кг∙К);
L = -ΔU = -119 кДж/(кг∙К);
ΔS = 0;
Δh = Cp ∙ (T3 – T2) = 1,025 ∙ (433 - 273) = 166 кДж/кг;
Процесс 3-4; n = ∞; C = C υ = 0,738 кДж/(кг∙К)
q = ΔU = C υ (T4 – T3) = 0,738∙(514 - 433) = 61 кДж/кг;
l = C;
ΔS = C υ ln(T4 / T3) = 0,738 ∙ ln (514 / 433) = 0,13 кДж / (кг∙К).
Процесс 4-1; n = 1,3; C = C υ [(n - k) / (n - 1)] = 0,738 [(1,3 – 1,4) / (1 – 1,4)] =
= - 0,22 кДж/(кг∙К);
q = C(T1 – T4) = -0,22∙(338 - 514) = 39 кДж/кг;
ΔU = C υ (T1 – T4) = 0,738 ∙ (338 - 514) = -132 кДж/кг;
l = (P4∙υ4 – P1∙ υ 1) / (n - 1) = (0,62∙0,24) –(0,1∙0,97)∙103 / (1,3 - 1) = 170 кДж/кг;
ΔS = C∙ln (T1 / T4) = -0,22 ln(338 / 514) = 0,09 кДж/(кг∙К);
Δh = Cp (T1 – T4) = 1,025 (338 - 514) = 183 кДж/кг.
Полученные значения сводим в таблицу 5
Таблица 5
| Процессы | n | C, кДж/(кг∙К) | ΔU, кДж/кг | Δh, кДж/кг | ΔS, кДж/(кг∙К) | q, кДж/кг | l, кДж/кг |
| 1-2 | 1,025 | -48 | -67 | -0,22 | -67 | -19 | |
| 2-3 | К | -118 | |||||
| 3-4 | 0,738 | 0,13 | |||||
| 4-1 | 1,3 | -0,22 | -132 | -183 | 0,09 | ||
| Сумма |
Подведенное количество теплоты 100 кДж/кг.
Отведенное количество теплоты 67 кДж/кг.
Работа цикла 33 кДж/кг.
Термический КПД ή = l / qп = 33 / 100 = 0,33.
Изобразим цикл в PV – и TS – координатах с учетом масштаба.
В PV – диаграмме для адиабаты 2-3 и политропы 4-1 найдем координаты дополнительных точек.
m a; υa = 0,6; Pa = P2(υ2 / υa)k = 0,1(0,78 /0,6)1,4 = 0,144 МПа,
m b; υb = 0,4; Pb = 0,1(0,78 /0,4)1,4 = 0,255 МПа,
m c; υc = 0,3; Pc = 0,1(0,78 / 0,3)1,4 = 0,38 МПа,
m d; υd = 0,3 Pd = 0,1(0,97 / 0,3)1,3 = 0,46 МПа,
m e; υe = 0,4; Pe = 0,1(0,97 / 0,4)1,3 = 0,32 МПа,
m f; υf = 0,6; Pf = 0,1(0,97 / 0,6)1,3 = 0,19 МПа,
m g; υg = 0,8; Pg = 0,1(0,97 / 0,8)1,3 = 0,13 МПа.
Построим цикл в TS – диаграмме. Примем за точку отсчета энтропии нормальные условия:
T = 0 0C и Р = 1,013∙105 Па, т.к. в точке 2 Т = 273 К, Р = 1∙105 Па,
то S2 ≈ 0; S3 = S2 = 0; S4 = S3 + ΔS1-4 = 0 + 0,13 = 0,13 кДж/(кг∙К);
S4 = S3 + ΔS4-1 = 0,13 + 0,9 = 0,22 кДж/(кг∙К).
Найдем энтропию в промежуточных точках.
m a; Тa = 325 К; Sa = Cp ∙ln(T1 / Tа) = 1,025ln(325 / 273) = 0,18 кДж/(кг∙К),
m b; Тb = 300K; Sb = 1,025ln(300 / 273) = 0,1 кДж/(кг∙К),
m c; Тc = 450K; Sc = Cυ ln(Tс / T3) = 0,738ln(450 / 433) = 0,03 кДж/(кг∙К),
|
|
|
m d; Тd = 475K; Sd = 0,738ln(475 / 433) = 0,07 кДж/(кг∙К),
m e; Тe = 450K; Se = S +Cпол ln(Tе / T4) = 0,13+ (-0,22 ln(450 / 514)) =0,16 кДж/(кг∙К),
m f; Тf = 400K; Sf = 0,13+(-0,22ln(400 / 514)) = 0,185 кДж/(кг∙К).
Контрольные задачи
Задача 1.1. Определить, какое количество кислорода было израсходовано из баллона емкостью 40 л, если манометрическое давление в нем снизилось со 196 ат до 49 ат, а температура возросла с 27 до 37 0С. Барометрическое давление 740 мм. рт. ст.
Задача 1.2. Компрессор подает сжатый воздух в резервуар, причем за время работы компрессора давление в резервуаре повышается с атмосферного до 7 бар, а температура от 20 до 25 0С. Объем резервуара 56 м3. Барометрическое давление 745 мм.рт.ст. Определить массу воздуха, поданного компрессором в резервуар.
Задача 1.3. Поршневой компрессор всасывает в минуту 3 м3 воздуха при температуре 17 0С и барометрическом давлении В = 750 мм.рт.ст. и нагнетает его в резервуар, объем которого 8,5м3. За сколько минут компрессор поднимает давление в резервуаре до 700 кПа, если температура в нем будет оставаться постоянной? Начальное давление воздуха в резервуаре составляло 750 мм.рт.ст. при 17 0С.
Задача 1.4. В баллоне емкостью 40л находится аргон под давлением Р = 10 МПа при t = 27 0С. Определить, какое количество аргона было израсходовано из баллона, если давление в нем снизилось до 7 МПа при той же температуре? До какой температуры надо нагреть газ, чтобы при оставшемся количестве аргона восстановить начальное давление 10 МПа?
Задача 1.5. В сосуде объемом 0,5м3 находится воздух при барометрическом давлении 100 кПа и температуре 300 0С. Воздух откачивается до тех пор, пока в сосуде не образуется вакуум 600 мм.рт.ст. Температура воздуха после откачивания остается прежней. Сколько воздуха (в кг) откачано? Чему будет равно давление в сосуде, если оставшийся в нем воздух охладить до 20 0С.
Задача 1.6. При автогенное резке металлов расходуется кислород и водород. Кислород берется из баллона объемом 50 л. Давление кислорода падает с 12 МПа до 8 МПа, а температура с 30 до 17 0С. Водород расходуется из баллона объемом 40 л. Начальные его параметры Р1 = 10 МПа, t1 = 27 0С, конечные Р2 = 10 МПа, t2 = 17 0С. Определить расход кислорода на 1кг водорода.
Задача 7. Газгольдер имеет емкость V = 30 м3. Сколько килограммов водорода нужно подать в газгольдер, чтобы при t = 20 0С в нем было давление Р = 1,6 МПа (по манометру). Начальное показание манометра Р = 0,25 МПа при температуре 10 0С. Барометрическое давление 750 мм.рт.ст.
Задача 1.8. Аудитория имеет размеры 6x8x5 м. Какое количество воздуха удалится из нее при повышении температуры с t1 = 15 0C до t2 = 2 0C, если атмосферное давление В0 = 775 мм.рт.ст.
Задача 1.9. Газгольдер, объемом V = 50 м3, заполнен хлором до давления 0,8 МПа по манометру при температуре 30 0С. На технологические нужды израсходовали 200 м3 газа (объем приведен к нормальным условиям). Какое давление покажет манометр на газгольдере, если температура понизилась до 17 0 С. Барометрическое давление 0,1 МПа.
Задача 1.10. В резервуар объемом 3м3 компрессором нагнетается углекислый газ. Начальное показание манометра Р1 = 0,3ати, конечное 3 ати. Температура повышается от t1 = 45 0C до t2 = 70 0С. Определить вес подкаченного углекислого газа. Барометрическое давление 735,5 мм.рт.ст.
Задача 1.11. Какое количество воздуха в кг было израсходовано на пуск двигателя, если известно, что объем пускового баллона 200л, температура воздуха в нем перед пуском и после пуска 20 0С,давление снизилось с 23 до 19 ат.
Задача 1.12. Резервуар объемом 12 м3 заполняется углекислым газом до давления 8 ати при t = 20 0С с помощью компрессора. Компрессор засасывает в минуту 6 м3 углекислого газа при барометрическом давлении 740 мм.рт.ст. и температуре 20 0С. Найти время, в течение которого компрессор заполнит резервуар углекислотой до необходимого давления, если перед пуском компрессора в резервуаре находился углекислый газ при давлении и температуре среды.
Задача 1.13. Воздух, заключенный в баллоне емкостью 0,9 м3, выпускается в атмосферу. Температура его равна 27 0С. Определить вес израсходованного воздуха, если до его выпуска давление в баллоне составляло 9,5 МПа, после выпуска 4,2 МПа, а температура воздуха снизилась до 17 0С.
Задача 1.14. Масса газа в баллоне m = 2,9кг, давление в баллоне по манометру 4 МПа. После того, как часть газа израсходовали, давление понизилось до 1,5 МПа, температура до 10 0С. Определить массу израсходованного газа, если барометрическое давление 755 мм.рт.ст., а начальная температура газа 30 0С. R = 290 Дж/(кг∙К).
Задача 1.15. Поршневой компрессор подает 2,4м3 воздуха в минуту (объем приведен к нормальным условиям). За какое время данный компрессор сможет поднять давление воздуха в ресивере от Р1 = 0,2 МПа до Р2 = 0,8 МПа. Объем ресивера 5м3, температура воздуха 20 0С.
Задача 1.16. Для смеси газов определить: кажущуюся молекулярную массу, газовую постоянную, плотность и парциальные давления компонентов, если давление смеси Рсм, температура tсм. Состав смеси взять по первой цифре варианта, давление и температуру по второй (таблиц 6, 7)
Задача 1.17. Определить среднюю массовую и объемную теплоемкости при Р = const и V = const для смеси газов в пределах температур t1 и t2, приняв зависимость теплоемкости от температуры линейной. Вычислить показатель адиабаты для смеси (К = Ср / Сv). Состав газа принять по первой цифре варианта (таблица), температуры t1 и t2 по второй (таблиц 6, 8)
Таблица 6
Состав газа к задачам 1.16 и 1.17
| Первая цифра варианта | СО2 | Н2 | СО | О2 | N2 | H2O | Примечание |
| - | - | Массовые проценты | |||||
| - | - | Массовые проценты | |||||
| - | - | Массовые проценты | |||||
| - | - | Массовые проценты | |||||
| - | - | Массовые проценты | |||||
| - | - | Объемные проценты | |||||
| - | - | Объемные проценты | |||||
| - | - | Объемные проценты | |||||
| - | - | Объемные проценты | |||||
| - | - | Объемные проценты |
Таблица 7
Параметры к задаче 1.16
| Вторая цифра варианта | ||||||||||
| Ром, МПа | 0,12 | 0,14 | 0,16 | 0,18 | 0,2 | 0,22 | 0,24 | 0,26 | 0,28 | 0,3 |
| Tсм 0С |
Таблица 8
|
|
|


