 |
Для специальности 060301 «Фармация»
|
|
|
|
Учебная дисциплина
«Фармацевтическая технология»
(базовый уровень высшего профессионального образования )
Студентка
Фамилия Павленко
Имя Светлана
Отчество Сергеевна
Группа 490
Место прохождения практики Южно-Уральский государственный медицинский университет, ул. Воровского, 64, кафедра фармации
Сроки прохождения: 23.01.2015 - 31.01.2015
Руководитель практики: ст. преподаватель Н.П. Куприянова
Челябинск, 2015
1. Нормативные документы, регламентирующие изготовление лекарств в условиях аптеки.
· Приказ Минздрава РФ № 308 от 21.10.1997 "Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм."
Инструкция была утверждена приказом Министерства Здравоохранения Российской Федерации от 21 октября 1997г. №308. Действие данной Инструкции распространяется на все аптеки, находящиеся на территории России, независимо от форм собственности и ведомственной принадлежности. Инструкция содержит основные методы и правила изготовления в аптеках жидких лекарственных форм для внутреннего и наружного применения, качество которых должно соответствовать требованиям, регламентированным действующей Государственной фармакопеей (ГФ), нормативными документами, приказами и инструкциями Министерства здравоохранения Российской Федерации.
· Приказ Минздрава РФ от 16.07.1997 № 214 "О контроле качества лекарственных средств, изготовляемых в аптеках".
Инструкция была утверждена приказом Министерства Здравоохранения Российской Федерации от 16 июля 1997г. №214. Действие данной Инструкции распространяется на все аптеки, находящиеся на территории России, независимо от форм собственности и ведомственной принадлежности. Инструкция предусматривает мероприятия, обеспечивающие изготовление в аптеках лекарственных средств, качество которых соответствует требованиям, регламентированным Государственной Фармакопеей, действующими нормативными документами Минздрава России. Также инструкция содержит особые требования к изготовлению и контролю качества стерильных лекарственных средств, режим стерилизации, сроки годности лекарственных форм и условия хранения.
|
|
|
· Приказ Минздрава РФ от 21 октября 1997г. №309 "Об утверждении инструкции по санитарному режиму аптечных организаций (аптек)."
Инструкция была утверждена приказом Министерства Здравоохранения Российской Федерации от 21 октября 1997г. №309. Действие Инструкции распространяется на все аптеки независимо от их организационно-правовых форм и ведомственной подчиненности, находящиеся на территории Российской Федерации. Инструкция содержит: термины и определения, методы и режимы стерилизации, сроки годности и условия хранения ЛС, средства и режимы дезинфекции различных объектов, основные требования, предъявляемые к санитарному режиму аптечного производства и личной гигиене работников аптек, к составу помещений аптек, обслуживающих население и стационарных больных, санитарные требования к помещениям и оборудованию асептического блока, подготовку персонала к работе в асептическом блоке.
· Методические указания по изготовлению стерильных растворов в аптеках.
Методические указания были утверждены Минздравмедпромом РФ 24 августа 1994 г. Действие Методических указаний распространяется на все аптеки независимо от их организационно-правовых форм и ведомственной подчиненности, находящиеся на территории Российской Федерации. Методические указания содержат: термины и определения, стерильные растворы и исходные компоненты и требования к ним, санитарные требования при изготовлении стерильных ЛС, требования к подготовке и проведению технологического процесса, персоналу, осуществляющему этот процесс, и качеству стерильной продукции. В МУ включены сроки годности, режимы стерилизации и особенности технологии на ряд индивидуальных прописей стерильных растворов.
|
|
|
2. Описание технологии изготовления по алгоритму
| Рецепт (на латинском языке), проверка доз и норм отпуска, расчеты, ППК. | Латинское и русское название ингредиента. Описание. Растворимость. Принадлежность к спискам (А и Б). Дозы по НД. | Технология с теоретическим обоснованием (определение лекарственной формы по ГФ XI, дисперсологическая характеристика, особенности изготовления, описание технологии со ссылками на НД. Упаковка к отпуску по НД). | Оценка качества, срок годности по НД. |
1.11
Rp: Acidi salicylici 0,1 Bismuthi
subnitratis 0,3 Basis 10,0 Misce. Da. Signa: Мазь для рук.
Фармэкспертиза рецепта
· ЛВ соответствуют бланку 107-1/у (пр. 1175н)
· Ингридиенты прописи совместимы
· Дозы не проверяем
Оборот ППК
m(ЛФ)=0,1+0,3+10,0=10,4
%НВ=  1,0 - 5 капель 0,1 - х капель х=1 капля
ППК 1. Acidi salicylici 0,1 2. Spiritus aethylici
95% gtts І 3. Bismuthi subnitratis 0,3 4. Olei Vaselini qs 5. Vaselini 10,0 m(ЛФ)=10,4 m(T)= 1,0 - 5 капель 0,1 - х капель х=1 капля
ППК 1. Acidi salicylici 0,1 2. Spiritus aethylici
95% gtts І 3. Bismuthi subnitratis 0,3 4. Olei Vaselini qs 5. Vaselini 10,0 m(ЛФ)=10,4 m(T)=
| Acidum salicylicum Кислота салициловая Описание. Белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха. Летуч с водяным паром. При осторожном нагревании возгоняется. Растворимость. Мало растворим в воде, растворим в кипящей воде, легко растворим в спирте, эфире, трудно растворим в хлороформе. Хранение. В хорошо укупоренной таре, предохраняющей от действия света. Антисептическое, кератолитическое средство. (ГФ Х ст. 21) Bismuthi subnitras Висмута нитрат основной Описание. Белый аморфный или микрокристаллический порошок. Препарат, смоченный водой, окрашивает синюю лакмусовую бумагу в красный цвет. Растворимость. Практически нерастворим в воде и спирте, легко растворим в азотной и соляной кислотах. Хранение. В хорошо укупоренной таре, предохраняющей от действия света. Вяжущее средство. (ГФ Х ст. 107) VaselinumВазелин Описание.Однородная, тянущаяся нитями мазеобразная масса без запаха, от белого до желтого цвета. При намазывании на стеклянную пластинку дает ровную, несползающую пленку. При расплавлении дает прозрачную жидкость со слабым запахом парафина или нефти. Хранение. В защищенном от света месте, при температуре не выше 15 °C.(Справочник лекарств РЛС) | Характеристика прописи - выписана мягкая ЛФ - мазь, сложная, дерматологическая, гетерогенная (суспензионная), на гидрофобной основе. Определение (ГФ ХI) - Мазь это мягкая лекарственная форма, предназначенная для нанесения на кожу, раны или слизистые оболочки. Дисперсологическая характеристика - свободная всесторонне дисперсная система с пластично-упруго-вязкой дисперсионной средой и твердой дисперсной фазой. Особенности технологии: 1. Бланк 107-1/у (т.к. вещества не на ПКУ пр. 1175н). 2. Дозы не проверяем (т.к. наружное). 3. Способ приготовления - по массе. 4. Упаковка - Широкогорлые баночки из стекла или полистирола и навинчивающимися крышками из полимерных материалов. (пр. 706н) 5. Оформление: Основная этикетка с оранжевой сигнальной полосой: «Наружное», дополнительные: «Беречь от детей», «Хранить в прохладном, защищенном от света месте». (М/У) 6. Срок годности - 10 суток (пр. 214) 7. Рабочее место в соответствии с требованиями. (пр. 309) Технология Подготовительные мероприятия: готовим ЛВ, ФС, посуду, ВР- 1, весы Мора, упаковочные материалы, тарируем склянку, оформляем этикетку, проводим расчеты. 1. В ступку на ВР-1 отвешиваем кислоты салициловой 0,1, добавляем спирта этилового 95% 1 каплю растираем. 2. В ступку на ВР-1 отвешиваем висмута нитрата основного 0,3, добавляем несколько капель масла вазелинового, диспергируем. 3. На весах Мора на капсуле отвешиваем вазелина 10,0, переносим в ступку, диспергируем. 4. Готовую мазь переносим в широкогорлую банку, закрываем, оформляем к отпуску. | (пр. 214, пр.305) Обязательные виды контроля: 1. Письменный ППК заполнен верно 2. Органолептический светло-желтая, вязкая, внешне однородная масса 3. При отпуске № на рецепте соответствует № на этикетке, баночки герметично закрыты Выборочные виды контроля: 1. Физический (пр. 305) 10.4 - 100% х - 8% х = 0,83 НДО[9,57 - 11,23] 2. Химический 3. Опросный Срок годности - 10 суток (пр. 214). |
2.24
Rp: Sulfadimezini 0,8 Analgini 0,5 Basis qs ut fiat suppositoriа №4
Da. Signa. По 1 свече 2 раза в день.
Фармэкспертиза рецепта
· ЛВ соответствуют бланку 107-1/у (пр. 1175н)
· Ингридиенты прописи совместимы
· Дозы проверяем
Проверка доз. Сульфадимезин
РД=0,8 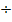 4=0,2 СД=0,2 4=0,2 СД=0,2 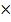 2=0,4 Анальгин РД=0,5 2=0,4 Анальгин РД=0,5 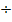 4=0,125 СД=0,125 4=0,125 СД=0,125 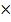 2=0,25
Дозы не завышены Оборот ППК mосновы=3,0 2=0,25
Дозы не завышены Оборот ППК mосновы=3,0 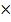 4=12,0 СЛВ= 4=12,0 СЛВ=  10,8% mосновы=12.0-0,8-0,5=10,7
ППК 1. Sulfadimezini 0,8 2.Vitepsoli q.s. 3. Analgini 0,5 4. Aqae purificatae q.s. 5. Vitepsoli ad 10,7
m(ЛФ)=12,0 Р=3,0 10,8% mосновы=12.0-0,8-0,5=10,7
ППК 1. Sulfadimezini 0,8 2.Vitepsoli q.s. 3. Analgini 0,5 4. Aqae purificatae q.s. 5. Vitepsoli ad 10,7
m(ЛФ)=12,0 Р=3,0
| SulfadimezinumСульфадимезин Описание. Белый или слегка желтоватый порошок без запаха. Растворимость. Практически нерастворим в воде, эфире и хлороформе, мало растворим в 95% спирте, легко растворим в разведенных минеральных кислотах и щелочах. Хранение. Список Б. В хорошо укупоренной таре, предохраняющей от действия света.Высшая разовая доза внутрь 2,0 г.Высшая суточная доза внутрь 7,0 г.Антибактериальное средство.(ГФ Х ст. 642) Analginum Анальгин Описание.Белый или белый с едва заметным желтоватым оттенком крупноигольчатый, кристаллический порошок без запаха, горьковатого вкуса. В присутствии влаги быстро разлагается. Водные растворы при стоянии желтеют. Растворимость. Растворим в 1,5 ч. воды, 160 ч. 95% спирта, практически нерастворим в эфире, хлороформе и ацетоне. Хранение. Список Б. В хорошо укупоренных банках оранжевого-стекла, в защищенном от света месте. Высшая разовая доза внутрь 1,0 г. Высшая суточная доза внутрь 3,0 г. Высшая разовая доза под кожу, внутримышечно, в вену 0,5 г. Высшая суточная доза под кожу, внутримышечно, в вену 1,5 г. Болеутоляющее, жаропонижающее, противовоспалительное средство. (ГФ Х ст. 57) | Характеристика прописи - выписана мягкая ЛФ - ректальные суппозитории, на дифильной основе, выписанные разделительным способом, без указания количества основы, изготовленные методом выливания, содержащие сильнодействующие вещества. Определение (ГФ ХI) - Суппозитории - это твердые при комнатной температуре и расплавляющиеся или растворяющиеся при температуре тела дозируемые ЛФ Дисперсологическая характеристика - свободная всесторонне дисперсная система с пластичной дисперсионной средой и дисперсной фазой в виде Особенности технологии: 1. Бланк 107-1/у (т.к. вещества не на ПКУ пр. 1175н) 2. Дозы проверяем, дозы не завышены. 3. Способ приготовления - метод выливания. 4. Упаковка - Каждая суппозитория завернута в парафинированную или пергаментную бумагу и помещены в картонную коробку (пр. 706н). 5. Оформление: Основная этикетка с оранжевой сигнальной полосой: «Наружное», дополнительные: «Беречь от детей», «Хранить в прохладном, защищенном от света месте». (М/У) 6. Срок годности - 10 суток (пр. 214). 7. Рабочее место в соответствии с требованиями. (пр. 309) Технология Подготовительные мероприятия: готовим ЛВ, ФС, посуду, ВР- 1, весы Мора, форму для суппозиториев, упаковочные материалы,, оформляем этикетку, проводим расчеты. 1. В ступку на ВР-1 отвешиваем сульфадимезина 0,8. 2. На весах Мора на капсуле отвешиваем витепсола 10,7, переносим в фарфоровую чашку и расплавляем основу на водяной бане. 3. Сульфадимезин диспергируем в ступке с частью расплавленной основы, отодвигаем на край ступки. 4. На ВР-1 отвешиваем анальгина 0,5, переносим в ступку, растворяем в минимальном количестве воды, и диспергируем со смесью сульфадимезина и основы до крепитации. 5. Добавляем оставшуюся часть расплавленной основы, перемешиваем. 6. Полученную суппозиторную массу выливаем в форму, предварительно смазанную мыльно-спиртовым раствором, охлаждаем. 7. Готовые суппозитории извлекают из формы, упаковывают. | (пр. 214, пр.305) Обязательные виды контроля: 1. Письменный ППК заполнен верно 2. Органолептический Суппозитории беловато-желтоватого цвета, внешне однородные, без запаха. 3. При отпуске № на рецепте соответствует № на этикетке, суппозитории упакованы Выборочные виды контроля: 1. Физический (пр. 305) 3,0 - 100% х - 5% х = 0,15 НДО[3,85- 4,15] 2. Химический 3. Опросный Срок годности - 10 суток (пр. 214). |
3.7.
Rp: Solutionis Kalii chloridi 5%-50ml Sterilisetur! Da.Signa. Вводить в вену капельно в 500 мл изотонического раствора натрия хлорида.
Фармэкспертиза рецепта
· ЛВ соответствуют бланку 107-1/у (пр. 1175н)
· Ингридиенты прописи совместимы
· Дозы не проверяем
Оборот ППК Раствор калия хлорида 5% (пр. 214)
По НД
Калия хлорида - 50,0
Воды для инъекций до 1 л
50,0 - 1000
Х - 50
Х=2,5
Cmax=5 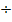 0,37=13,5%
Сфакт=5%
Cmax 0,37=13,5%
Сфакт=5%
Cmax  Сфакт Сфакт  КУО не учитываем
V(ЛФ)=50ml
ППК
1.Aquae pro injectionibus 50 ml
2.Kalii chloridi 2,5
Sterilisetur 120oC-8 min
V(ЛФ)=50ml КУО не учитываем
V(ЛФ)=50ml
ППК
1.Aquae pro injectionibus 50 ml
2.Kalii chloridi 2,5
Sterilisetur 120oC-8 min
V(ЛФ)=50ml
| Kaliichloridum Калия хлорид Описание. Бесцветные кристаллы или белый кристаллический порошок. без запаха, соленого вкуса. Растворимость. Растворим в 3 ч. воды, практически нерастворим в 95%. спирте. Хранение. В хорошо укупоренной таре. Источник ионов калия (применяют при гипокалиемии); антиаритмическое средство. (ГФ Х ст.362) Aqua pro injectionibus Вода для инъекций Описание.Бесцветная прозрачная жидкость без запаха. (ФС 42-0325-09) | Характеристика прописи - выписана жидкая ЛФ для парентерального применения, требующая асептических условий изготовления, истинный водный раствор вещества общего списка.
Определение (ГФ ХI) - Иньекционные ЛФ- группа ЛФ, вводимых в организм с нарушением целостности кожных покровов и слизистых с помощью полой иглы и шприца или безыгольным методом под высоким давлением.
Дисперсологическая характеристика - гомогенная свободная всесторонне дисперсная система с жидкой дисперсионной средой и дисперсной фазой в виде ионов и молекул. Особенности технологии:
1. Бланк 107-1/у (т.к. вещества не на ПКУ пр. 1175н) 2. Дозы не проверяем (вещества общего списка)
3. Условия изготовления - асептические (пр. 308, 214, М/У) 4. Способ приготовления - массо-объемный(Cmax  Сфакт Сфакт  КУО не учитываем) (пр. 308). 5. Упаковка - Флакон нейтрального стекла, резиновая пробка, металлический колпачок под обкатку.(пр. 706н) 6. Оформление: Основная этикетка с синей сигнальной полосой: «Для инъекций», дополнительные: «Беречь от детей», «Хранить в прохладном, защищенном от света месте». (М/У) 7. Срок годности - 30 суток. (пр. 214) 8. Используют воду для инъекций, ЛВ марок ХЧ, ЧДА, годен для инъекций
9. Используют фильтрование.
10. Полный химический контроль. (пр. 214)
11. Пропись регламентирована НД. (пр. 214)
12. Стерилизация при 120 град. С 8 минут. (пр.214)
13. Рабочее место в соответствии с требованиями. (пр. 309)
Технология Подготовительные мероприятия: готовим ЛВ, ФС, посуду, ВР- 5, таро-укупорочный материал, фильтрующий материал, оформляем этикетку, проводим расчеты.
1. В стерильную подставку в асептических условиях отмериваем 50 мл воды для инъекций.
2. На ВР-5 отвешиваем калия хлорида 2,5, переносим в подставку, растворяем.
3. Раствор подвергаем полному химическому контролю.
4. Раствор фильтруем через стеклянный фильтр, в стерильный флакон нейтрального стекла.
5. Проводим первичный контроль на отсутствие механических включений.
6. Флакон укупориваем стерильной резиновой пробкой "под обкатку"
7. Раствор стерилизуем при температуре 120oC - 8 минут.
8. Проводим вторичный контроль на отсутствие механических включений, полный химический контроль.
9. Оформляем флакон к отпуску. КУО не учитываем) (пр. 308). 5. Упаковка - Флакон нейтрального стекла, резиновая пробка, металлический колпачок под обкатку.(пр. 706н) 6. Оформление: Основная этикетка с синей сигнальной полосой: «Для инъекций», дополнительные: «Беречь от детей», «Хранить в прохладном, защищенном от света месте». (М/У) 7. Срок годности - 30 суток. (пр. 214) 8. Используют воду для инъекций, ЛВ марок ХЧ, ЧДА, годен для инъекций
9. Используют фильтрование.
10. Полный химический контроль. (пр. 214)
11. Пропись регламентирована НД. (пр. 214)
12. Стерилизация при 120 град. С 8 минут. (пр.214)
13. Рабочее место в соответствии с требованиями. (пр. 309)
Технология Подготовительные мероприятия: готовим ЛВ, ФС, посуду, ВР- 5, таро-укупорочный материал, фильтрующий материал, оформляем этикетку, проводим расчеты.
1. В стерильную подставку в асептических условиях отмериваем 50 мл воды для инъекций.
2. На ВР-5 отвешиваем калия хлорида 2,5, переносим в подставку, растворяем.
3. Раствор подвергаем полному химическому контролю.
4. Раствор фильтруем через стеклянный фильтр, в стерильный флакон нейтрального стекла.
5. Проводим первичный контроль на отсутствие механических включений.
6. Флакон укупориваем стерильной резиновой пробкой "под обкатку"
7. Раствор стерилизуем при температуре 120oC - 8 минут.
8. Проводим вторичный контроль на отсутствие механических включений, полный химический контроль.
9. Оформляем флакон к отпуску.
| (пр. 214, пр.305) Обязательные виды контроля: 1. Письменный ППК заполнен верно 2. Органолептический бесцветная, прозрачная жидкость без запаха 3. При отпуске № на рецепте соответствует № на этикетке, флаконы герметично закрыты. 4. Физический (пр. 305) 50ml - 100% х - 5% х = 2,5 НДО[47,5-52,5] 5. Химический 6. Опросный Срок годности - 30 суток (пр. 214). |
3.37
Rp: Solutionis Hexamethylentetramini10%- 50ml Sterilisetur!
Da. Signa. Вводить в вену по 5 мл 1 раз в сутки.
Фармэкспертиза рецепта
· ЛВ соответствуют бланку 107-1/у (пр. 1175н)
· Ингридиенты прописи совместимы
· Дозы не проверяем
Оборот ППК
10,0 - 100
Х - 50
Х=5
Cmax=5 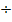 0,78=6,4
Сфакт=10%
Cmax 0,78=6,4
Сфакт=10%
Cmax  Сфакт Сфакт  КУО учитываем
V(H2O)=50 -5,0 КУО учитываем
V(H2O)=50 -5,0 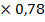 =46,1
1ml - 20 капель
0,1 - х капель
х=2 капли
V(ЛФ)=50ml
ППК
1.Aquae pro injectionibus 46 ml gtts II
2. Hexamethylentetramini5,0
V(ЛФ)=50ml =46,1
1ml - 20 капель
0,1 - х капель
х=2 капли
V(ЛФ)=50ml
ППК
1.Aquae pro injectionibus 46 ml gtts II
2. Hexamethylentetramini5,0
V(ЛФ)=50ml
| HexamethylentetraminumГексаметилентетрамин Описание. Бесцветные кристаллы или белый кристаллический порошок, без запаха, жгучего и сладкого, а затем горьковатого вкуса. При нагревании улетучивается, не плавясь. Растворимость. Легко растворим в воде и спирте, растворим в хлороформе, очень мало растворим в эфире. Хранение. В хорошо укупоренной таре. Антисептическое средство, применяется внутрь и внутривенно. (ГФ Х ст.328) Aqua pro injectionibus Вода для инъекций Описание. Бесцветная прозрачная жидкость без запаха. (ФС 42-0325-09) | Характеристика прописи - выписана жидкая ЛФ для парентерального применения, требующая асептических условий изготовления, истинный водный раствор вещества общего списка.
Определение (ГФ ХI) - Иньекционные ЛФ- группа ЛФ, вводимых в организм с нарушением целостности кожных покровов и слизистых с помощью полой иглы и шприца или безыгольным методом под высоким давлением.
Дисперсологическая характеристика - гомогенная свободная всесторонне дисперсная система с жидкой дисперсионной средой и дисперсной фазой в виде ионов и молекул. Особенности технологии:
1. Бланк 107-1/у (т.к. вещества не на ПКУ пр. 1175н). 2. Дозы не проверяем (вещества общего списка).
3. Условия изготовления - асептические (пр. 308, 214, М/У). 4. Способ приготовления - массо-объемный(Cmax  Сфакт Сфакт  КУО учитываем) (пр. 308). 5. Упаковка - Флакон нейтрального стекла, резиновая пробка, металлический колпачок под обкатку.(пр. 706н) 6. Оформление: Основная этикетка с синей сигнальной полосой: «Для инъекций», дополнительные: «Беречь от детей», «Хранить в прохладном, защищенном от света месте», «Приготовлено асептически». (М/У). 7. Срок годности - 2 суток (пр. 214). 8. Используют воду для инъекций, ЛВ марок ХЧ, ЧДА, годен для инъекций.
9. Используют фильтрование.
10. Полный химический контроль (пр. 214).
11. Пропись не регламентирована НД.
12. Рабочее место в соответствии с требованиями(пр. 309).
Технология Подготовительные мероприятия: готовим ЛВ, ФС, посуду, ВР- 20, таро-укупорочный материал, фильтрующий материал, оформляем этикетку, проводим расчеты.
1. В стерильную подставку в асептических условиях отмериваем 46 мл и 2 капли воды для инъекций.
2. На ВР-20 отвешиваем гексаметилентетрамина 5,0, переносим в подставку, растворяем.
3. Раствор подвергаем полному химическому контролю.
4. Раствор фильтруем через стеклянный фильтр, в стерильный флакон нейтрального стекла.
5. Проводим первичный контроль на отсутствие механических включений.
6. Флакон укупориваем стерильной резиновой пробкой "под обкатку"
7. Проводим вторичный контроль на отсутствие механических включений, полный химический контроль.
8. Оформляем флакон к отпуску. КУО учитываем) (пр. 308). 5. Упаковка - Флакон нейтрального стекла, резиновая пробка, металлический колпачок под обкатку.(пр. 706н) 6. Оформление: Основная этикетка с синей сигнальной полосой: «Для инъекций», дополнительные: «Беречь от детей», «Хранить в прохладном, защищенном от света месте», «Приготовлено асептически». (М/У). 7. Срок годности - 2 суток (пр. 214). 8. Используют воду для инъекций, ЛВ марок ХЧ, ЧДА, годен для инъекций.
9. Используют фильтрование.
10. Полный химический контроль (пр. 214).
11. Пропись не регламентирована НД.
12. Рабочее место в соответствии с требованиями(пр. 309).
Технология Подготовительные мероприятия: готовим ЛВ, ФС, посуду, ВР- 20, таро-укупорочный материал, фильтрующий материал, оформляем этикетку, проводим расчеты.
1. В стерильную подставку в асептических условиях отмериваем 46 мл и 2 капли воды для инъекций.
2. На ВР-20 отвешиваем гексаметилентетрамина 5,0, переносим в подставку, растворяем.
3. Раствор подвергаем полному химическому контролю.
4. Раствор фильтруем через стеклянный фильтр, в стерильный флакон нейтрального стекла.
5. Проводим первичный контроль на отсутствие механических включений.
6. Флакон укупориваем стерильной резиновой пробкой "под обкатку"
7. Проводим вторичный контроль на отсутствие механических включений, полный химический контроль.
8. Оформляем флакон к отпуску.
| пр. 214, пр.305) Обязательные виды контроля: 1. Письменный ППК заполнен верно 2. Органолептический бесцветная, прозрачная жидкость без запаха 3. При отпуске № на рецепте соответствует № на этикетке, флаконы герметично закрыты 4. Физический (пр. 305) 50ml - 100% х - 5% х = 2,5 НДО[47,5-52,5] 5. Химический 6. Опросный Срок годности - 2 суток (пр. 214). |
4.7.
Rp: Solutionis Dicaini 0,5% - 10 ml
Da. Signa. По 2 капли 2 раза в день для анестезии
Фармэкспертиза рецепта
· ЛВ соответствуют бланку 107-1/у (пр. 1175н)
· Ингридиенты прописи совместимы
· Дозы не проверяем
Оборот ППК
Раствор Дикаина 0,5 % (пр. 214)
Состав по НД:
Дикаина 0,05
Воды очищенной до 10 мл
Cmax=10 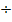 0,86=11,6
Сфакт=0<5%
Cmax 0,86=11,6
Сфакт=0<5%
Cmax  Сфакт Сфакт  КУО не учитываем
V(ЛФ)=10ml
Проверка изотоничности: Изотонический коэффициент дикаина = 0,18 1,0 - 0.18 0,05 - х х=0,009 (раствор гипотоничный)
ППК
1.Aquae purificatae 5 ml
2. Dicaini 0,05
3.Aquae purificatae ad 10 ml
Sterilisetur 120oC - 8 min
V(ЛФ)=10ml КУО не учитываем
V(ЛФ)=10ml
Проверка изотоничности: Изотонический коэффициент дикаина = 0,18 1,0 - 0.18 0,05 - х х=0,009 (раствор гипотоничный)
ППК
1.Aquae purificatae 5 ml
2. Dicaini 0,05
3.Aquae purificatae ad 10 ml
Sterilisetur 120oC - 8 min
V(ЛФ)=10ml
| DicainumДикаин Описание. Белый кристаллический порошок без запаха. Растворимость. Легко растворим в воде и спирте, трудно растворим в хлороформе, практически нерастворим в эфире. Хранение. Список А. В хорошо укупоренной таре. Высшая разовая доза для анестезии верхних дыхательных путей 0,09 г, или 3 мл 3% раствора (однократно). Высшая разовая доза для перидуральной анестезии 0,075 г, или 25 мл 0,3% раствора (однократно). Местноанестезирующее средство. ГФ Х ст.214) Aqua purificata Вода очищенная Описание. Бесцветная прозрачная жидкость без запаха. (ФС 42-0324-09) | Характеристика прописи - выписана жидкая ЛФ- глазные капли, требующая асептических условий изготовления, истинный водный раствор сильнодействующего вещества.
Определение (ГФ ХI) - Глазные капли - водные или масляные растворы или тончайшие суспензии ЛВ.
Дисперсологическая характеристика - гомогенная свободная всесторонне дисперсная система с жидкой дисперсионной средой и дисперсной фазой в виде ионов и молекул. Особенности технологии:
1. Бланк 107-1/у (т.к. вещества не на ПКУ пр. 1175н). 2. Дозы не проверяем (т.к. наружное).
3. Условия изготовления - асептические (пр. 308, 214, М/У). 4. Способ приготовления - массо-объемный(Cmax  Сфакт Сфакт  КУО не учитываем) (пр. 308). 5. Упаковка - Флакон нейтрального стекла на 10-20 мл, резиновая пробка, металлический колпачок под обкатку.(пр. 706н) 6. Оформление: Основная этикетка с оранжевой сигнальной полосой: «Глазные капли», дополнительные: «Беречь от детей», «Хранить в прохладном, защищенном от света месте», «Стерильно», (М/У). 7. Срок годности - 120 суток (пр.214).
8. Используют фильтрование.
9. Стерилизация при 120оС 8 минут(пр.214).
10. Двойной контроль на отсутствие механических включений (пр. 214).
11. Пропись регламентирована НД (пр.214).
12. Рабочее место в соответствии с требованиями(пр. 309).
Технология Подготовительные мероприятия: готовим ЛВ, ФС, посуду, ВР- 1, таро-укупорочный материал, фильтрующий материал, оформляем этикетку, проводим расчеты.
1. В асептических условиях отмериваем 10 мл воды очищенной, 5 мл переносим в подставку.
2. На ВР-1 отвешиваем дикаина 0,05, переносим в подставку, растворяем.
3. Фильтруем полученный раствор через предварительно промытый бумажный фильтр с комочком ваты. Затем через этот фильтр доводим объем до 10 мл оставшимся растворителем.
4. Проводим первичный контроль на отсутствие механических включений.
5. Флакон укупориваем стерильной резиновой пробкой "под обкатку".
6. Раствор стерилизуем при 120оС 8 минут.
7. Проводим вторичный контроль на отсутствие механических включений.
8. Оформляем флакон к отпуску. КУО не учитываем) (пр. 308). 5. Упаковка - Флакон нейтрального стекла на 10-20 мл, резиновая пробка, металлический колпачок под обкатку.(пр. 706н) 6. Оформление: Основная этикетка с оранжевой сигнальной полосой: «Глазные капли», дополнительные: «Беречь от детей», «Хранить в прохладном, защищенном от света месте», «Стерильно», (М/У). 7. Срок годности - 120 суток (пр.214).
8. Используют фильтрование.
9. Стерилизация при 120оС 8 минут(пр.214).
10. Двойной контроль на отсутствие механических включений (пр. 214).
11. Пропись регламентирована НД (пр.214).
12. Рабочее место в соответствии с требованиями(пр. 309).
Технология Подготовительные мероприятия: готовим ЛВ, ФС, посуду, ВР- 1, таро-укупорочный материал, фильтрующий материал, оформляем этикетку, проводим расчеты.
1. В асептических условиях отмериваем 10 мл воды очищенной, 5 мл переносим в подставку.
2. На ВР-1 отвешиваем дикаина 0,05, переносим в подставку, растворяем.
3. Фильтруем полученный раствор через предварительно промытый бумажный фильтр с комочком ваты. Затем через этот фильтр доводим объем до 10 мл оставшимся растворителем.
4. Проводим первичный контроль на отсутствие механических включений.
5. Флакон укупориваем стерильной резиновой пробкой "под обкатку".
6. Раствор стерилизуем при 120оС 8 минут.
7. Проводим вторичный контроль на отсутствие механических включений.
8. Оформляем флакон к отпуску.
| пр. 214, пр.305) Обязательные виды контроля: 1. Письменный ППК заполнен верно 2. Органолептический бесцветная, прозрачная жидкость без запаха 3. При отпуске № на рецепте соответствует № на этикетке, флаконы герметично закрыты Выборочные виды контроля: 1. Физический (пр. 305) 10ml - 100% х - 10% х = 1ml НДО[9 - 11]ml 2. Химический 3. Опросный Срок годности - 120 суток (пр.214). |
|
|
|
|
|
|
|
|
|
3. Нормативно-техническая документация в промышленном производстве. Конспект понятий.
· Фармакопейная статья - нормативно-технический документ, устанавливающий требования к лекарству, его упаковке, условиям и сроку хранения и методам контроля качества.
Утверждается на лекарственный препарат или лекарственное растительное сырье серийного производства, и имеет силу государственных стандартов. Срок действия - не более 5 лет.
· Временная фармакопейная статья - нормативно-технический документ, утвержденный на ограниченный срок, устанавливающий требования к качеству лекарственного препарата или лекарственного растительного сырья и носящий характер государственного стандарта.
Утверждается на первые промышленные серии новых лекарственных препаратов. Утверждается на ограниченный срок - не более 3 лет.
· Стандарт - нормативный документ, в котором установлены для общего и многократного использования правила, требования, общие принципы или характеристики, касающиеся разных видов деятельности или их результатов для достижения оптимальной степени упорядочения в определенной области.
· Технические условия - нормативный документ, устанавливающий требования к конкретной продукции, услугам и регулирующий отношения между поставщиком и потребителем продукции.
· Технологический регламент - это нормативный документ, в котором изложены технологические методы, технические средства, нормы и нормативы изготовления лекарственного средства.
· Руководящий нормативный документ -это документ, в котором четко описана техническая сторона производственной деятельности.
4. Нормативная документация, регламентирующая производство и качество лекарств.
· Федеральный закон РФ от 12.04.2010г.№61-ФЗ «Об обращении лекарственных средств»
Закон был принят Государственной Думой 24 марта 2010 года и одобрен Советом Федерации 31 марта 2010 года. Он содержит 16 глав и 71 статью.
Настоящий Федеральный закон применяется к отношениям, возникающим при обращении лекарственных средств на территории Российской Федерации.
Благодаря этому закону на всей территории России действует единый порядок обращения лекарственных средств.
Закон регламентирует: полномочия федеральных органов исполнительной власти при обращении лекарственных средств, разработку и издание государственной фармакопеи, размещение данных о ней, лицензирование ЛС, государственный контроль в сфере обращения ЛС, разработку ЛС, клинические и доклинические испытания ЛС для медицинского и ветеринарного применения, государственную регистрацию лекарственных препаратов, экспертизу, производство, маркировку, хранение, рекламу и уничтожение ЛС, перевозку, ввоз и вывоз из Российской Федерации, фармацевтическую деятельность, порядок розничной и оптовой торговли ЛП, а также устанавливает ответственность за нарушение законодательства Российской Федерации при обращении лекарственных средств.
· ГОСТ Р 52249 – 2009 «Правила производства и контроля качества ЛС».
Утвержден Приказом Федерального агентства по техническому регулированию и метрологии от 20 мая 2009г. № 159-ст. Дата введения 1 января 2010г.
Настоящий стандарт является идентичным переводом правил GMP Европейского Союза (GMP ЕС) "Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use" по состоянию на 31 января 2009 г. Настоящий стандарт устанавливает требования к производству и контролю качества лекарственных средств для человека и животных. Стандарт распространяется на все виды лекарственных средств и устанавливает общие требования к их производству и контролю качества(общие термины и определения, устанавливает требования к производству, контролю качества, к персоналу, помещениям и оборудованию, оформлению документов, устанавливает перечень обязательной документации, обозначает обязанности персонала, требования к гигиене и обучению персонала) а также специальные требования к производству активных фармацевтических субстанций, используемых в качестве исходных материалов (часть II) и отдельных видов лекарственных средств (Приложения 1 - 19).
· Национальный стандарт РФ ГОСТ Р 52537 "Производство лекарственных средств. Система обеспечения качества. Общие требования".
Утвержден приказом Федерального агентства по техническому регулированию и метрологии от 21 апреля 2006 г.№ 73-ст. Дата введения 1 января 2007г.
Настоящий стандарт устанавливает требования к системе обеспечения качества при производстве лекарственных средств с целью их гарантированного соответствия техническим регламентам, национальным и межгосударственным стандартам, Государственной Фармакопее, другим нормативным документам, стандартам предприятий и специальным требованиям, задаваемым при регистрации лекарственных средств. Настоящий стандарт включает в себя: термины и определения, назначение, структуру, принципы и порядок внедрения системы обеспечения качества, рекомендации по проведению аудита и инспекций, перечень контрольных вопросов при аудите, прием, анализ, транспортирование и хранение исходных и упаковочных материалов, перечень сведений в информации о предприятии, контроль качества и выпуск готовой продукции, а также схему работы с персоналом, требования, подготовку, обязанности и аттестацию персонала.
· Стандарты ИСО. Ведение документации.
Терминологию в области документации устанавливает состоящий из нескольких частей стандарт ИСО 5127 серии "Документация и информация" (Часть 1: Основные понятия; Часть 2: Традиционные документы; Часть 3: Иконографические документы; Часть 3-а: Комплектование, идентификация, анализ документов и данных; Часть 6: Документальные языки; Часть 11: Аудио-визуальные документы).
Стандартами ИСО определены общие правила создания документов, в том числе:
- форматы бумаги для документов и методы выражения их размеров (ИСО 216:1975. Бумага писчая и некоторые виды печатной продукции. Потребительские форматы рядов А и В; ИСО 353:1975. Бумага писчая и некоторые виды печатной продукции. Метод выражения размеров);
- межстрочные интервалы и шаг письма (ИСО 4882:1979. Офисные машины и оборудование для обработки данных. Интервалы между строками и знаками);
- формуляр-образец и конструкционная сетка для создания бланков и форм документов (ИСО 3535:1977. Листы для разработки форм и схемы размещения);
- основные требования к бланкам документов (ИСО 8439:1990. Конструкция бланков - Основная схема расположения);
- принципы компоновки торговых документов (ИСО 6422:1985. Основной принцип компоновки торговых документов).
· ГОСТ Р 52550-2006 " Производство лекарственных средств. Организационно-технологическая документация".
Утвержден Приказом Федерального агентства по техническому регулированию и метрологии от 2 июня 2006г. № 105-ст. Введен в действие 1 января 2007 года.
Настоящий стандарт устанавливает основные требования к организационно-технологической документации, необходимой для производства лекарственных средств по ГОСТ Р 52249, ее содержанию и порядку ведения. Стандарт не устанавливает конкретные формы документов, требования к их разработке, согласованию, утверждению, хранению и пр., которые определяются самим предприятием - производителем лекарственных средств (ЛС). Приведенные в приложениях образцы документов носят справочный характер. Стандарт не распространяется на организационно-распорядительную документацию (приказы, распоряжения, должностные инструкции и пр.). Стандарт содержит: термины и определения, основные требования к документации, структуру организационно-технологической документации, порядок ведения документации, виды технологических регламентов по производству лекарственных средств, технологические инструкции и инструкции по фасовке и упаковке, перечень инструкций, методик и стандартов предприятия, а также примеры форм документов, инструкций, этикеток.
· Отраслевой стандарт ОСТ 91500.05.001-00 "Стандарты качества лекарственных средств. Основные положения"
Утвержден приказом Минздрава РФ от 1 ноября 2001 г. № 388. Настоящий ОСТ устанавливает порядок разработки, оформления, экспертизы, согласования, утверждения, присвоения обозначения, регистрации государственных стандартов качества лекарственных средств и внесения в них изменений. ОСТ содержит термины и определения ,порядок подготовки государственных стандартов качества лекарственных средств, порядок построения и изложения государственных стандартов качества лекарственных средств, порядок представления государственных стандартов качества лекарственных средств на экспертизу, согласование и утверждение, порядок присвоения обозначений и регистрации государственных стандартов качества лекарственных средств, порядок внесения изменений в государственные стандарты качества лекарственных средств, перечень разделов фармакопейной статьи на лекарственные средства, и формы титульных листов для фармакопейных статей.
· Межгосударственный стандарт ГОСТ ИСО 14644-1-2002 "Чистые помещения и связанные с ними контролируемые среды. Часть 1. Классификация чистоты воздуха".
Постановлением Государственного комитета Российской Федерации по стандартизации и метрологии от 10 июня 2003 г. № 190-ст межгосударственный стандарт ГОСТ ИСО 14644-1-2002 введен в действие с 1 апреля 2004 г. Настоящий стандарт идентичен международному стандарту ИСО 14644-1-99 «Чистые помещения и связанные с ними контролируемые среды. Часть 1: Классификация чистоты воздуха» (Cleanrooms and associated controlled environments - Part 1: Classification of air cleanliness). Настоящий стандарт устанавливает классы чистоты воздуха по концентрации взвешенных частиц (аэрозолей) в чистых помещениях и чистых зонах. Для целей классификации рассматриваются только аэродисперсные множества частиц с кумулятивным распределением концентрации частиц с размерами частиц в диапазоне 0,1-5,0 мкм. Настоящий стандарт не дает классификацию аэродисперсных множеств, размеры частиц которых находятся вне установленного диапазона (0,1-5,0 мкм). Концентрации ультрамелких частиц (менее 0,1 мкм) и макрочастиц (более 5,0 мкм) могут использоваться для количественного описания таких аэродисперсных систем с помощью U -дескрипторов и М -дескрипторов соответственно. Стандарт содержит: термины и определения, устанавливает классы чистоты, проверку соответствия воздуха заданным требованиям, методики определения классов чистоты, методы отбора проб, статистическую обработку данных, примеры определения классов чистоты, а также особенности счета и оценки размеров частиц, находящихся вне диапазона размеров, используемого для классификации.
· Производство стерильных лекарственных средств. Основы технологии чистоты. Классификация чистых помещений.
В соответствии с ГОСТ Р 52249 – 2009 «Правила производства и контроля качества ЛС».
" Чистые помещения (зоны) для производства стерильной продукции классифицируются в соответствии с требованиями к окружающей среде. Каждая производственная операция требует определенного уровня чистоты окружающей среды в эксплуатируемом помещении (зоне) с целью сведения к минимуму риска загрязнения продукта или материалов частицами или микроорганизмами.
Для обеспечения соответствия чистых помещений (чистых зон) требованиям, предъявляемым к эксплуатируемому состоянию, проектом должно предусматриваться соответствие заданным классам чистоты воздуха в оснащенном состоянии.
Оснащенное состояние - состояние, в котором чистое помещение построено и функционирует, технологическое оборудование полностью укомплектовано, но персонал отсутствует.
Эксплуатируемое состояние - состояние чистого помещения, в котором технологическое оборудование функционирует в требуемом режиме с заданным числом работающего персонала.
Требования к оснащенному и эксплуатируемому состоянию должны быть установлены для каждого чистого помещения или комплекса чистых помещений.
Чистые зоны при производстве стерильных лекарственных средств подразделяются на четыре типа:
A - локальная зона для проведения операций, представляющих высокий риск для качества продукции, например, зоны наполнения, укупорки; зоны, где ампулы и флаконы находятся в открытом состоянии и выполняются соединения частей оборудования в асептических условиях. Как правило, в таких зонах используют однонаправленный (ламинарный
|
|
|


