 |
Методика приготовления золя диоксида марганца
|
|
|
|
Золь диоксида марганца получают методом химической конденсации по реакции восстановления перманганата калия тиосульфатом натрия:
8КМnO4 + 3 Na2S2O3 + Н2O ® 8 MnO2 + Na2SO4 + 3K2SO4 + 2KOH
Для получения золя диоксида марганца в мерной колбе готовят 250 мл раствора перманганата калия, разбавляя 100 мл 0,01 М КМnО4 водой до метки. Переливают раствор КМnО4 в стакан и туда медленно вводят 15 мл 0,125%-ного раствора тиосульфата натрия. При этом образуется золь диоксида марганца темно-вишневого цвета.
Ход работы:
Для проведения работы готовят 2 серии по 10 пробирок, нумеруют их. В 10 пробирок первой серии наливают по 5 мл золя диоксида марганца. В 10 пробирках второй серии готовят растворы электролита разной концентрации последовательным разбавлением. Для этого в первую пробирку наливают 4 мл исходного раствора электролита, из нее отбирают 2 мл в следующую пробирку и туда же добавляют 2 мл дистиллированной воды. Из второй пробирки также отбирают 2 мл раствора в следующую, третью, пробирку, в которую затем добавляют 2 мл дистиллированной воды и т. д. Таким же образом готовят 10 растворов электролита по 2 мл.
После приготовления растворов электролита отмечают время и добавляют эти растворы в пробирки с золем. Полученные смеси встряхивают и оставляют на 15 минут. При добавлении растворов электролитов в пробирки с золем необходимо точно соблюдать последовательность расположения пробирок по возрастанию концентрации добавленного электролита!
Через 15 минут в некоторых пробирках произойдет коагуляция, о которой можно судить по помутнению золя или по выпадению осадка. Результаты наблюдений за изменениями в пробирках с золем и электролитом записывают в таблицу 6.3. В графе "Вид системы" указывают образование осадка, помутнение, прозрачность.
|
|
|
Таблица 6.3 - Результаты наблюдений за изменениями в пробирках с золем и электролитом
Электролит............................................ (название, концентрация)
| Пробирка | Объем золя, мл | Объем электролита, мл | Разведение | Вид системы |
| 1:2 | ||||
| 1:4 | ||||
| 1:8 | ||||
| 1:16 | ||||
| 1:32 | ||||
| 1:64 | ||||
| 1:128 | ||||
| 1:256 | ||||
| 1:512 |
Порог коагуляции определяют по концентрации электролита между пробирками с прозрачным золем и помутневшим.
Предположим, что через 15 минут после добавления раствора электролита в 5-ой пробирке золь прозрачный, а в 6-ой – мутный. Вычисляют концентрации растворов электролита в этих пробирках по соотношению:
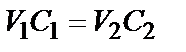 ,
,
где V 1 и C 1 - объем и концентрация исходного раствора электролита, а V 2 и C 2 -его концентрация после добавления к золю.
Например, для 0,4 М раствора ВаСl2, если порог коагуляции лежит между концентрациями растворов электролита в 5-ой и 6-ой пробирках:
С5 = (0,04×2)/(16×7) = 7,14×10-4 моль / л;
С6 = (0,04×2)/(32×7) = 3,57×10-4 моль / л. Порог коагуляции С к=(С 5 + С 6)/ 2 =5,355×10-4 моль / л. Аналогичные опыты проводят с каждым из электролитов. По полученным концентрациям С кпроверяют правило Шульце-Гарди.
7. Седиментационный анализ суспензий и эмульсий
В практике бурения скважин и их эксплуатации широко используют различные промывочные жидкости и цементные растворы, нефтяные эмульсии, пены и ряд других микрогетерогенных систем. Одной из наиболее важных характеристик таких систем является их полидисперсность, поэтому для теории и практики важно знать фракционный состав таких систем, то есть количественное распределение частиц по их размерам (радиусам).
Несмотря на относительно малое содержание частиц с коллоидными размерами в указанных выше системах, их присутствие во многом определяет физико-механические и реологические свойства таких систем. Это объясняется тем, что на фракцию частиц с коллоидными размерами приходится большая часть общей межфазной поверхности.
|
|
|
Учет и исследование этого фактора имеет большое значение при приготовлении и регулировании свойств дисперсных систем, применяемых в нефтепромысловом деле, а также при расчете и конструировании электродегидраторов, отстойных и очистных устройств. Знание характеристик дисперсности необходимо также для расчета запасов нефти в нефтяных коллекторах (определение свободного межпорового пространства).
Одним из важнейших методов исследования полидисперсных систем является седиментационный анализ, дающий возможность находить так называемую “функцию распределения”, то есть, определять относительное содержание частиц в системе с найденными размерами (радиусами).
Принцип седиментационного анализа состоит в измерении скорости оседания частиц дисперсной фазы в какой-либо дисперсионной среде. В основе седиментационного анализа лежит закон Стокса, по которому сила трения  , возникающая при движении сферической частицы радиусом r со скоростью uв среде с вязкостью h выражается уравнением:
, возникающая при движении сферической частицы радиусом r со скоростью uв среде с вязкостью h выражается уравнением:
 . (7.1)
. (7.1)
Если частица движется под действием силы тяжести, и сила трения уравновешивает силу тяжести, действующую на частицу, и выталкивающую силу Архимеда, то она движется равномерно:
 . (7.2)
. (7.2)
где D и d – плотность дисперсной фазы и дисперсионной среды, соответственно; g – ускорение силы тяжести (9,81 м / c 2). Из уравнения (7.2) получим:
 . (7.3)
. (7.3)
Закон Стокса выведен для равномерного движения сферических частиц в вязкой среде и применим к частицам, диаметр которых меньше 100 мкм, но больше 0,1 мкм, так как частицы, диаметр которых меньше 0,1 мкм, обладают заметным броуновским движением, а частицы с диаметром, большим 100 мкм, движутся равномерно ускоренно.
Таким образом, закон Стокса применим к системам с низкой степенью дисперсности - суспензиям и эмульсиям.
Для данной дисперсной фазы и дисперсионной среда величины h, D и d постоянны. Тогда
 и
и  .
.
Так как скорость оседания суспензии  , то есть, равна пройденному частицами расстоянию Н, деленному на время t, то расчетной формулой для определения радиусов частиц будет
, то есть, равна пройденному частицами расстоянию Н, деленному на время t, то расчетной формулой для определения радиусов частиц будет
|
|
|
 . (7.4)
. (7.4)
Следует обратить внимание, что константа К имеет размерность м 1/2 с 1/2, если все величины под корнем в формуле (7.4) выражены в системе СИ:
 . .
| (7.5) |
Радиус частицы, рассчитанный по формуле (7.4) с учетом размерности H (м) и t (с) будет выражен в м.
Так как радиус частицы, выраженный в м, величина очень маленькая, то ее удобно выражать в микрометрах (мкм): 1 м = 106 мкм.
Лабораторная работа №7.
|
|
|


