 |
Лекция №3.Адгезия связующего и заполнителя.
|
|
|
|
Для композиционных материалов сила и качество сцепления наполнителя и связующего является зачастую решающим фактором определяющим и прочность и долговечность материала. В самом деле, как мы уже видели из теории Гриффитса, при плохой связи связующего и наполнителя любая гранула наполнителя будет играть роль концентратора напряжений. В этом случае разрушения материала путём растрескивания будет идти по границам зёрен (волокон) заполнителя. При хорошем сцеплении связующего и заполнителя граница раздела наоборот станет стопором для трещин. Если у нас заполнитель лёгкий, но не прочный, мы всё равно можем создать композит по прочности превосходящий заполнитель. Остаётся решить задачу увеличения прочности сцепления связующего и заполнителя. Для различных связующих и заполнителей эта задача решается по разному. Главным признаком хорошего сцепления связующего и заполнителя является смачивание поверхности заполнителя связующим.
Любая жидкость имеет свободную поверхность. Молекулы в пограничном слое жидкости, в отличие от молекул в ее глубине, окружены другими молекулами той же жидкости не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости со стороны соседних молекул, в среднем взаимно скомпенсированы. Любая молекула в пограничном слое притягивается молекулами, находящимися внутри жидкости. В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Поверхностные молекулы силами межмолекулярного притяжения втягиваются внутрь жидкости. Но все молекулы, в том числе и молекулы пограничного слоя, должны находиться в состоянии равновесия. Это равновесие достигается за счет некоторого уменьшения расстояния между молекулами поверхностного слоя и их ближайшими соседями внутри жидкости, поэтому они обладают дополнительным запасом потенциальной энергии по сравнению с внутренними молекулами. Если молекула переместится с поверхности внутрь жидкости, силы межмолекулярного взаимодействия совершат положительную работу. Наоборот, чтобы вытащить некоторое количество молекул из глубины жидкости на поверхность (т. е. увеличить площадь поверхности жидкости), внешние силы должны совершить положительную работу Δ A внеш, пропорциональную изменению Δ S площади поверхности:
|
|
|
| Δ A внеш = σΔ S. |
Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Таким образом, коэффициент поверхностного натяжения равен работе, необходимой для увеличения площади поверхности жидкости при постоянной температуре на единицу. В СИ коэффициент поверхностного натяжения измеряется в джоулях на метр квадратный (Дж/м2) или в ньютонах на метр (1 Н/м = 1 Дж/м2). Следовательно, молекулы поверхностного слоя жидкости обладают избыточной по сравнению с молекулами внутри жидкости потенциальной энергией. Потенциальная энергия E р поверхности жидкости пропорциональна ее площади:
|
Из механики известно, что равновесным состояниям системы соответствует минимальное значение ее потенциальной энергии. Отсюда следует, что свободная поверхность жидкости стремится сократить свою площадь. По этой причине свободная капля жидкости принимает шарообразную форму. Жидкость ведет себя так, как будто по касательной к ее поверхности действуют силы, сокращающие (стягивающие) эту поверхность. Эти силы называются силами поверхностного натяжения. Всем хорошо известные мыльные пузыри имеют правильную сферическую форму – в этом тоже проявляется действие сил поверхностного натяжения. Если в мыльный раствор опустить проволочную рамку, одна из сторон которой подвижна, то вся она затянется пленкой жидкости (рис. 1).
|
|
|

|
| Рисунок 1. Подвижная сторона проволочной рамки в равновесии под действием внешней силы и результирующей сил поверхностного натяжения |
Силы поверхностного натяжения стремятся сократить поверхность пленки. Для равновесия подвиж-ной стороны рамки к ней нужно приложить внешнюю силу Fвн= - Fн. Если под действием силы Fвн перекладина переместится на Δ x, то будет произведена работа Δ A вн = F внΔ x = Δ Ep = σΔ S, где Δ S = 2 L Δ x – приращение площади поверхности обеих сторон мыльной пленки. Так как модули сил Fвн и Fн одинаковы, можно записать:
|
Таким образом, коэффициент поверхностного натяжения σ может быть определен как модуль силы поверхностного натяжения, действующей на единицу длины линии, ограничивающей поверхность.
Из-за действия сил поверхностного натяжения в каплях жидкости и внутри мыльных пузырей возни-кает избыточное давление Δ p. Если мысленно разрезать сферическую каплю радиуса R на две поло-винки, то каждая из них должна находиться в равновесии под действием сил поверхностного натяже-ния, приложенных к границе разреза длиной 2π R и сил избыточного давления, действующих на пло-щадь π R 2 сечения (рис. 2). Условие равновесия записывается в виде
| σ2π R = Δ p π R 2. |
Отсюда избыточное давление внутри капли равно
|

|
| Рисунок 2. Сечение сферической капли жидкости |
Избыточное давление внутри мыльного пузыря в два раза больше, так как пленка имеет две поверхности:
|
Вблизи границы между жидкостью, твердым телом и газом форма свободной поверхности жидкости зависит от сил взаимодействия молекул жидкости с молекулами твердого тела. Если эти силы больше сил взаимодействия между молекулами самой жидкости, то жидкость смачивает поверхность твердого тела. В этом случае жидкость подходит к поверхности твердого тела под некоторым острым углом θ, характерным для данной пары жидкость – твердое тело. Угол θ называется краевым углом. Если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела, то краевой угол θ оказывается тупым (рис. 3). В этом случае говорят, что жидкость не смачивает поверхность твердого тела. При полном смачивании θ = 0, при полном несмачивании θ = 180°.
|
|
|

|
| Рисунок 3. Краевые углы смачивающей (1) и несмачивающей (2) жидкостей |
Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. На рис. 4 изображена капиллярная трубка некоторого радиуса r, опущенная нижним концом в смачи-вающую жидкость плотности ρ. Верхний конец капилляра открыт. Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести Fnz; действующая на столб жидкости в капилляре, не станет равной по модулю результирующей F н сил поверхностного натяжения, действующих вдоль границы соприкосновения жидкости с поверхностью капилляра: F т = F н, где F т = mg = ρ h π r 2 g, F н = σ2π r cos θ. Отсюда следует:
|

|
| Рисунок 4. Подъем смачивающей жидкости в капилляре |
При полном смачивании θ = 0, cos θ = 1. В этом случае
|
При полном несмачивании θ = 180°, cos θ = –1 и, следовательно, h < 0. Уровень несмачивающей жид-кости в капилляре опускается ниже уровня жидкости в сосуде, в которую опущен капилляр. Вода практически полностью смачивает чистую поверхность стекла. Наоборот, ртуть полностью не смачи-вает стеклянную поверхность. Поэтому уровень ртути в стеклянном капилляре опускается ниже уровня в сосуде.
Рассмотрим условия смачивания и несмачивания на границе жидкости с твердым телом. Следует отметить, что поверхностным натяжением обладают не только жидкости, но и твердые тела. Наличие в твердых телах строго периодической кристаллической структуры свидетельствует о наличии в них сил притяжения между молекулами. Благодаря наличию этих сил поверхностное натяжение возникает и в твердых телах.
 Рис. 5 Рис. 5
|
Пусть капля жидкости 2 помещена на поверхность твердого тела 1 (рис. 5). На рисунке указаны силы поверхностного натяжения, действующие на границе жидкость-твердое тело ( ), жидкость-газ (
), жидкость-газ ( ) и твердое тело-газ (
) и твердое тело-газ ( ). Ясно, что поведение капли на поверхности твердого тела зависит от величины этих сил. Рассмотрим два случая. Если
). Ясно, что поведение капли на поверхности твердого тела зависит от величины этих сил. Рассмотрим два случая. Если
|
|
|

то жидкость 2 растекается по поверхности тела 1 до образования очень тонкой пленки вплоть до образования мономолекулярного слоя. При выполнении этого условия наступает полное смачивание жидкостью поверхности твердого тела. Угол θ при этом равен 0. Если при некотором соотношении между  , а также значении
, а также значении  оказывается справедливым равенство
оказывается справедливым равенство

то имеет место, так называемое неполное смачивание. Жидкость 2 растекается по поверхности твердого тела до тех пор, пока не выполнится это равенство.
 Рис. 6 Рис. 6
|
Угол θ при этом является острым (рис. 6). Некоторые жидкости на поверхности твердого тела образуют капли, равновесная форма которых определяется неравенством

При этом угол θ является тупым углом (рис. 6). Силы  и
и  стремятся придать капле сферическую форму, чему препятствует действующая на каплю сила тяжести. В этом случае имеет место частичное несмачивание. В реальной ситуации при взаимодействии жидкости с твердым телом реализуются, как правило, две возможности – либо частичное смачивание
стремятся придать капле сферическую форму, чему препятствует действующая на каплю сила тяжести. В этом случае имеет место частичное несмачивание. В реальной ситуации при взаимодействии жидкости с твердым телом реализуются, как правило, две возможности – либо частичное смачивание 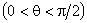 , либо частичное несмачивание
, либо частичное несмачивание  . Различные поверхностно активные вещества и адгезионные добавки предназначены для уменьшения поверхностного натяжения на границе твёрдое тело-жидкость либо уменьшения поверхностного натяжения на границе жидкость – газ. Механизм действия этих добавок заключается в нейтрализации дипольных моментов на границах раздела. В заключение необходимо отметить, особенно это актуально для полимерных расплавов, связующее должно быть максимально жидким иначе теория смачивания не работает.
. Различные поверхностно активные вещества и адгезионные добавки предназначены для уменьшения поверхностного натяжения на границе твёрдое тело-жидкость либо уменьшения поверхностного натяжения на границе жидкость – газ. Механизм действия этих добавок заключается в нейтрализации дипольных моментов на границах раздела. В заключение необходимо отметить, особенно это актуально для полимерных расплавов, связующее должно быть максимально жидким иначе теория смачивания не работает.
Антикоррозионные и лакокрасочные покрытия на металлах.
Металлическая поверхность в большинстве случаев не имеет пор и трещин, но покрыта окислами металла и может быть загрязнена различными жидкостями. Металлы хорошо смачиваются большинством органических и неорганических жидкостей. Тонкие плёнки этих жидкостей являются препятствием для хорошего сцепления непосредственно краски и металла. Поэтому первая обязательная операция удаление жидких загрязнений путём протирки органическими растворителями и сушка изделия. Вторая операция – это удаление оксидного слоя, хотя у некоторых металлов оксидный слой очень крепко держится на металле и его удаление практически нецелесообразно. Удаление оксидного слоя может производиться механическим путём (различные абразивные воздействия) либо химическим травлением. Например, процесс фосфатирования приводит к удалению оксидного слоя и образованию солей фосфорной кислоты, которые имеют очень хорошее сцепление с металлом и к фосфатному слою в свою очередь хорошо прилипают адгезивы содержащиеся в лакокрасочном материале. В качестве адгезивов выступают смолы или поверхностно-активные добавки. Кроме того, лакокрасочные материалы содержат пигменты (мелкодисперсные неорганические порошки) которые выполняют несколько функций: придание цвета покрытию, выравнивание поверхности, защита от световых лучей, дополнительная защита от коррозии и даже улучшение адгезии материала к металлу. Смолы и ПАВы могут быть или водорастворимыми (при использовании вододисперсионных красок) или растворимыми в каком-либо органическом растворителе. Смолы, помимо улучшения адгезии, могут выполнять роль плёнкообразующих веществ. Если необходимо сделать покрытие максимально водо и воздухо-непроницаемым в состав гидроизоляционного и лакокрасочного материала добавляют коалесценты. Коалесценты необходимы для покрытий на основе полимеров. Дело в том, что полимерные молекулы малоподвижны и без дополнительных ухищрений образуют рыхлое покрытие после высыхания. Коалесценты размягчают полимер и увеличивают подвижность его молекул.
|
|
|
Гидроизоляционные покрытия на цементобетоне, кирпиче
и других неорганических материалах.
Поверхность неорганических материалов в большинстве случаев имеет поры и трещины. Поэтому улучшение адгезии покрытия и материала можно добиться путём проникновения адгезива в поры и его механического закрепления. Так как в большинстве практически интересных задач поверхность бетона (так для краткости будем называть все неорганические материалы) имеет высокую влажность, то задача нанесения долговечного покрытия вроде бы усложняется. В самом деле, большинство гид-роизоляционных материалов это органические жидкости, которые имеют худшую адгезию к бетону чем вода. Поэтому прослойка воды будет препятствовать склеиванию гидроизоляционного покрытия с бетоном. Имеется два способа гидроизоляции таких поверхностей. Первый- это водорастворимые кремнийорганические полимеры, которые проникают в поры и начинают полимеризоваться прямо в порах бетона. Второй менее дорогой – применение эмульсий. Но, оказывается, достижения совре-менной химии сделали из воды не противника, а помощника в деле приклеивания гидроизоляци-онных покрытий. Во-первых, появились вододисперсионные материалы типа жидкой резины (по научному битумно-латексные мастики) которые к мокрому материалу приклеиваются лучше чем к сухому!!!
Эмульсиями называют смесь двух жидких, не смешивающихся друг с другом, веществ, например, минеральное масло- вода. Эмульсии могут существовать в виде мелких капель (1-10 мкм) одной жидкости (называемой дисперсной фазой) в другой (называемой дисперсионной средой). Прямыми эмульсиями называются растворы масло в воде, обратными - вода в масле (смотри рисунок 7). Без каких-либо специальных добавок такая система неустойчива и мгновенно распадается на две фазы. Чтобы стабилизировать такую систему необходимо мелко диспергировать одну жидкость в другой и ввести вещества называемые стабилизаторами. Они изменяют только свойства поверхности мелких капелек (поэтому их необходимо добавлять в незначительных количествах 0,2-0,5%) и препятствуют слипанию капель. Эмульгаторами являются поверхностно-активные вещества, которые имеют характерное молекулярное строение: углеводородный (гидрофобный) хвост состоящий из 10-15 атомов и в конце молекулы обязательно должна быть полярная связь типа: OH, NH2, COOH, COMe. Полярная часть молекулы притягивается к воде, гидрофобная к маслу и поэтому эти молекулы располагаются на границе раздела двух сред. Конкретное расположение молекул эмульгатора на поверхности раздела зависит от активности атомов водорода, этот параметр называется pH воды. Изменение pH может привести к распаду эмульсии или к превращению прямой в обратную, и наоборот. При нанесении эмульсии на поверхность металла или каменного материала происходит распад эмульсии. Эмульсионные смазки наиболее дешёвые и удобные в применении: жидкую эмульсию можно наносить пульверизатором, а при распаде она резко загустевает. Подбором масла можно обеспечить достаточно хорошее качество поверхности изделий. Эмульсию необходимо хранить при определённой температуре (нельзя подвергать замораживанию) и периодически встряхивать или перемешивать. Эмульсии бывают катионные и анионные, в катионных эмульсиях вода имеет кислую реакцию, в анионных щелочную. Соответственно и эмульгаторы подразделяются на катионные и анионные, одни работают только в кислой среде (обычно раствор соляной кислоты), другие – только в щелочной (раствор гидроокиси натрия или извести).

Рис.7 Строение эмульсий.
В настоящее время эмульсии получают при смешении компонентов в роторно-пульсационных аппаратах (коллоидные мельницы), таким способом получаются эмульсии с очень широким диапазоном концентраций компонентов и их вязкости.
|
|
|





 .
.

