 |
Реальные газы. Уравнение Ван – дер - Вальса .
|
|
|
|
Вязкость. Коэффициент вязкости.

 Явл. вязкости в газе - это направленный перенос импульса упорядоченного движения молекул за счет их хаотичного движ при наличии градиента скорости упорядочн движ
Явл. вязкости в газе - это направленный перенос импульса упорядоченного движения молекул за счет их хаотичного движ при наличии градиента скорости упорядочн движ 

Импульс упорядочен. движ равен переносимый через ∆S:

По 2 закону Ньютона: изменение импульса слоя = импульсу силы трения, действ за  в направлении скор
в направлении скор  параллельной
параллельной 
т.е. Fтр  =
= 
fтр =  =
= 
Закон Внутр трения(вязкости) Ньютона:
fтр= -  ; η – к-т динамической вяз-ти
; η – к-т динамической вяз-ти


 Сила внутр тр при макроскопич движении газа пропорциональна градиенту скор газа упорядочн движ. Возникает за счёт переноса импульса. Коэффициент вязкости численно равен силе внутр тр, на ед S при градиенте скор = -1,
Сила внутр тр при макроскопич движении газа пропорциональна градиенту скор газа упорядочн движ. Возникает за счёт переноса импульса. Коэффициент вязкости численно равен силе внутр тр, на ед S при градиенте скор = -1, 
Киниматич коэф вязкости есть динамич дел на 
 , [м2 /с]
, [м2 /с]
Не Ньтоновская вязкость жидкости:

Фазовые равновесия и превращения. Фазы и фазовые превращения.
 Фазой наз. Макроскопическое физически однородная часть вещества, отделенная границами от остальн части сист. В сист может быть несколько ТВ и жидк фаз, но газообразн только 1. Различн фазы явл агрегатн сост вещва (ж, т, г). Фаза - более широкое понятие, чем агрегатное сост вещва могут сущ различн фазы одного агр сост. Различн фазы одного и того же вещва могутнаходиться в тепловом и механич равновесии. При тепловом равновесии темпер фаз одинакова, при механич равновес существование 2 фаз возможно при опр знач t и p. Переход вещва из 1 фазы в 2 – это фазовый переход. Различают фазовый переход 1 и 2 –го рода. Примеры: сублимация, испарение, кристаллизация, плавление.
Фазой наз. Макроскопическое физически однородная часть вещества, отделенная границами от остальн части сист. В сист может быть несколько ТВ и жидк фаз, но газообразн только 1. Различн фазы явл агрегатн сост вещва (ж, т, г). Фаза - более широкое понятие, чем агрегатное сост вещва могут сущ различн фазы одного агр сост. Различн фазы одного и того же вещва могутнаходиться в тепловом и механич равновесии. При тепловом равновесии темпер фаз одинакова, при механич равновес существование 2 фаз возможно при опр знач t и p. Переход вещва из 1 фазы в 2 – это фазовый переход. Различают фазовый переход 1 и 2 –го рода. Примеры: сублимация, испарение, кристаллизация, плавление.
Равновесие 2 фаз возможно только вдоль определённой линии: p = p(t). Равновесие 3 фаз – в одной точке (тройной):
 tтр = 0,01оС
tтр = 0,01оС
pТР = 4,62 мм рт ст
|
|
|
возможно существование нескольких тройных точек.
Фазовый переход 2-го рода не связаны с теплотой фаз перехода, они связаны с модификацией кристалл решетки при этом могут меняться скачком такие характеристики: теплоемкость, коэф тепл расшир
Фазовый переход 2-го рода, пример:
1) Переход некоторметаловпри сверхнизких темпер в сверх проводящ расстояния
2) Переход ферромагнетика железа в обычн паростаметик со слабым магн свовами.
3) Переход Гелий 1 в Гелий 2 (где энта=0)
Уравнение Клайперона - Клаузиса.
Получим зависимость давления от темпер при котор возможно равновесие 2 фаз вещва
Переход из фаз1 в фазу 2 происходит изотермически при темпер t. Адиабатический процесс СВ.
Цикл Карно.
Переход из 1 в 2 вдоль изотермы
T + dT.
Работа  такого цикла:
такого цикла: 
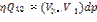




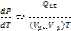 -Урние Клайперона-Клаузиса
-Урние Клайперона-Клаузиса
Показ как меняется давление и темпер.
Пусть объём и тепло отнесены к 1 моль в-ва, тогда говор об удельных вел-ах. При переходе воды в пар V > (V2 > V1), T > 0, dp/dt > 0
Процесс возможен если он имеет след зависимость:
Реальные газы. Уравнение Ван – дер - Вальса.
При больших давлениях (р>200атм) и низких темп (Т<50К) наблюд знач отклон в поведении реальн газа от состояния идеальн газа опис-ми ур Клайп - Менделева. Это отношение обусл 2 причинами:
1) Нельзя пренебрегать собств размерами молекул. Расчет показ, что при давл 5 тыс атм на собств оббьем мол-кул приходиться половина всего обьема газа.
2) Мол-лы взаимодеств. Между собой силами притяж и отталкив
Потенциальн энергия взаимодеств мол в зависим от раст – энерг описыв потенциалом Леннарда – Джонса:



С1 и С2 – полож компоненты, знач на близк раст. На близких расстояниях силы отталкивания мощные dA=Fdr =-  F= -
F= - 
Из больш чилса урний сост (>100) описыв поведение реальных газов наиболее удачным оказыв урние ВдВ для 1 моль:
(P+  Урние ВДВ
Урние ВДВ
a и b постоянные ВДВ. Различные для разн газов
Покажем, что поправка в – есть 4-ный собственный объём всех молекул 1 моль газа.
|
|
|
 Для движ сталкив мол-л оказ недоступный объём (шара – пунктир).
Для движ сталкив мол-л оказ недоступный объём (шара – пунктир).
V = 4/3*πd3
V1 =4/3*π(d/2)3=4/3*πd3*1/8
V = 8 V1
Недоступн для движ оказ 8-ный объём мол-лы (на 2 мол-лы). Для 1 моль у 4-ный (V=4V1)
Поскольку число мол NA/VO, то недост для движ оказ объём: в = NA4V1. тогда (VO – в) – объём доступн для движ мол-лы газа. покажем, что 2-ая попр а связ с учётом сил сцепления, притяж мол-л между собой. В силу сил притяж м-л удары мол-л о стенки сосуда несколько смягчены и газ заним меньш объём, чем по зак Боуля – Мариотта, как если бы он наход под несколько больш давлен.
 Мол-ное давлен прямопропорц как числу м-л в 1-ом слое, так и числу м-л во 2-ом слое, те пропорц произвед числа м-л в слое 1 и 2:
Мол-ное давлен прямопропорц как числу м-л в 1-ом слое, так и числу м-л во 2-ом слое, те пропорц произвед числа м-л в слое 1 и 2:
р ~ N·N, p ~ n·n ~ NА/ VO * NА/ VO
р = 1/ VO → р* = а / VO – мол-ное избыт давл.
ВдВ для числа молей ν, V = ν VO, VO = V/ ν
(р + (а ν2)/ V2)(V - в ν) = νRT
Из ВдВ как частн случ выт ур Менд–Клайп:
р V(1 +(а ν2)/ рV·V)(1 – (в ν)/ V) = νRT
V→∞, р V = const, р V = νRT – ур М-Кл.
1о. Кинематика поступательного движения.
2о. Кинематика вращательного движения.
3о. Динамика частиц. Закон ньютона.
4о. Неинерциальные системы отсчета (НСО). Силы инерции.
5о. Основное ур-ние динамики вращательного движения тв. тела.
6о. Момент инерции тела. Теорема Штейнера.
7о. Закон сохранения импульса.
8о. Работа. Мощность. Кинетическая энергия системы.
9о. Потенциальная энергия системы.
|
|
|


