 |
Занятие № 2. 1.Тестовый контроль знаний по теме «Законы идеальных газов». 1. В идеальном газе частицы. 2. В идеальном газе частицы рассматриваются как
|
|
|
|
Занятие № 2.
План занятия:
1. Тестовый контроль знаний по теме «Законы идеальных газов».
2. Первое начало термодинамики. Расчет теплоты, работы и изменения внутренней энергии системы идеального газа в различных термодинамических процессах.
3. Решение задач на тему «Расчет теплоты, работы и изменения внутренней энергии системы идеального газа в различных термодинамических процессах».
1. Тестовый контроль знаний по теме «Законы идеальных газов».
1. В идеальном газе частицы
1. взаимодействуют друг с другом одинаково.
2. взаимодействуют друг с другом по разному, в зависимости от природы газа.
3. взаимодействуют друг с другом по разному, в зависимости от размера частиц.
4. не взаимодействуют друг с другом.
2. В идеальном газе частицы рассматриваются как
1. реальные молекулы и атомы, с различными размерами.
2. точки, не имеющие размеры.
3. реальные молекулы и атомы с одинаковыми размерами.
4. идеальные молекулы и атомы.
3. В изотермическом процессе
1. давление прямо пропорционально объему.
2. давление обратно пропорционально объему.
3. давление равно объему.
4. давление и объем постоянны.
4. В изохорном процессе
1. давление прямо пропорционально температуре.
2. давление обратно пропорционально температуре.
3. давление равно температуре.
4. давление и температура постоянны.
5. В изобарном процессе
1. объем прямо пропорционален температуре.
2. объем обратно пропорционален температуре.
3. объем равен температуре.
4. объем и температура постоянны.
6. Общее давление газовой смеси равно
1. давлению каждого газа в индивидуальном состоянии при данной температуре.
|
|
|
2. сумме парциальных давлений всех газов.
3. атмосферному давлению.
4. всегда постоянно и не зависит от состава газовой смеси.
7. Давлению 740 мм. рт. ст. соответствует
1. 1 атмосфера.
2. 1, 03 атмосферы.
3. 0, 97 атмосферы.
4. 0, 03 атмосферы.
8. Давлению 780 мм. рт. ст. соответствует
1. 101, 3 кПа.
2. 98, 7 кПа.
3. 103, 96 кПа.
4. 65, 67 кПа.
9. Средняя квадратичная скорость молекул вещества
1. прямо пропорциональна температуре.
2. обратно пропорциональная температуре.
3. прямо пропорциональна корню квадратному из температуры.
4. обратно пропорциональна корню квадратному из температуры.
10. Средняя квадратичная скорость молекул вещества при постоянной температуре
1. прямо пропорциональна молекулярной массе.
2. обратно пропорциональная молекулярной массе.
3. прямо пропорциональна корню квадратному из молекулярной массе.
4. обратно пропорциональна корню квадратному из молекулярной массе.
Задача №1. Какой объем займет 123 г водорода при 123 º С и 123 кПа?
Задача № 2. Вычислите значение универсальной газовой постоянной в л·атм/моль·К. (R = 62, 36 л·мм. рт. ст. /моль·К)
Задача № 3. Определите молекулярную массу и установите формулу вещества СхНy, если плотность его пара при T = 373К и P = l01, 3 кПа равна 2, 55 г/л. X: Y = 12: 1.
Задача № 4. Какое количество СО2 может вместить стальной сосуд емкостью 0, 5 л при Т = 473К, Р= 162100 кПа?
Задача № 5. Какое количество СО2 при Р = 506, 6 кПа и T = 323К занимает одинаковый объем с 1 г гелия при 10, 13 кПа и 273, 1 К?
Задача № 6. Вычислите среднюю квадратичную скорость молекул хлора при 20 °С.
Задача № 7. Какой объем занимает газ при 20 °С и давлении 91, 2 кПа, если при 25 °С и давлении 100 кПа его объем составил 23 л?
Задача № 8. Вычислите плотность воздуха при нормальных условиях.
Задача № 9. Вычислите плотность воздуха при 100 °С и давлении 202, 6 кПа.
|
|
|
Задача № 10. Вычислите молекулярную массу воздуха при н. у.
Тестовое задание считается выполненным, если решена задача и даны 6 правильных ответов на тестовые вопросы.
2. Первое начало термодинамики. Расчет теплоты, работы и изменения внутренней энергии системы идеального газа в различных термодинамических процессах.
Первое начало термодинамики утверждает, что энергия изолированной системы постоянна.
Первое начало термодинамики устанавливает взаимосвязь между теплотой, работой и внутренней энергией.
Внутренняя энергия – сумма потенциальной энергии взаимодействия всех частиц тела между собой и кинетической энергии их движения. Внутренняя энергия является функцией состояния (dU).
Работа процесса – это энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры этих тел и не связанная с переносом вещества от одного тела к другому. Работа является функцией перехода (δ W).
Теплота – это энергия, передаваемая одним телом другому при их взаимодействии, зависящая только от температуры этих тел и не связанная с переносом вещества от одного тела к другому. Теплота является функцией перехода (δ Q).
Математическая формулировка первого закона:
dU = δ Q - δ W (дифференциальная форма); Δ U = Q - W (интегральная форма)
Расчет работы расширения идеального газа в некоторых процессах
| Процесс | Работа W | Изменение внутренней энергии Δ U | Теплота Q |
| Изобарный | p (V2-V1) | nCVΔ T | nCр(T2-T1) |
| Изотермический | nRT ln(V2/V1) | 0 | nRT ln(V2/V1) |
| Изохорный | nCV(T2-T1) | nCV(T2-T1) | |
| Адиабатический | nCV(T1-T2) | nCV(T2-T1) | 0 |
| Изобарно-изотермический (химическая реакция) | Δ nRT | 0 | Δ nRT |
Для расчета теплоты используют понятие теплоемкости, которая определяется следующим образом: 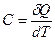
Если нагревание происходит при постоянном объеме или давлении, то теплоемкость обозначают соответствующим нижним индексом:  ;
; 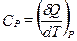 .
.
Теплоемкость – количество теплоты, которое необходимо сообщить 1 моль вещества, чтобы нагреть его на 1 К.
Для некоторых веществ теплоемкость можно также оценить теоретически методами статистической термодинамики. Так, при комнатной температуре для одноатомных идеальных газов мольная теплоемкость CV = 3/2 R, для двухатомных газов CV = 5/2 R (Cр = 5/2 R – для одноатомных газов, Cр = 7/2 R - для двухатомных газов. )
|
|
|
Cp - CV = R
При обратимом адиабатическом расширении идеального газа давление и объем связаны соотношением (уравнением адиабаты): pV γ = const, где γ = Cp / CV
TV γ -1 = const T γ p1- γ = const.
|
|
|


