 |
Системы, образующие в жидком состоянии неидеальные растворы. Перегонка и ректификация.
|
|
|
|
Различные модели растворов: идеальные, регулярные, субрегулярные. Парциальные величины. Функции смешения. Избыточные ТД функции.
Системы, образующие в жидком состоянии неидеальные растворы. Перегонка и ректификация.
Подчинение всех компонентов раствора закону Рауля во всей области концентраций наблюдается редко, поэтому к идеальным растворам можно отнести лишь небольшое количество смесей.
Неидеальные растворы не подчиняются закону Рауля во всем диапазоне составов и проявляют либо положительные, либо отрицательные отклонения от него. На рис. 24.1 приведены зависимости давления пара компонентов и общего давления пара от состава раствора для различных систем: идеальных (рис. 24.1 а), с положительными отклонениями (рис. 24.1 b ) и с отрицательными отклонениями (рис. 24.1 с ) от закона Рауля. Такой характер зависимости давления пара связан с межчастичными взаимодействиями в растворе.
Если в растворе энергии взаимодействия между однородными молекулами больше, чем между разнородными, то образование раствора обычно сопровождается поглощением тепла (АЯ>0) и увеличением объема [Vр_ ра >VA + VB.
Это облегчает процесс испарения, и экспериментально определенные значения давления пара оказываются выше рассчитанных по закону Рауля (рис. 24.1 b ) -раствор проявляет положительные отклонения от закона Рауля. В этом случае
температура кипения в этих системах ниже, чем в идеальных. Такие растворы встречаются часто. К их числу относятся, например, смеси этиловый эфир – этанол, ацетон – сероуглерод, бензол – ацетон и др.

Рис. 24.1. Зависимость общего и парциальных давлений пара от состава раствора в идеальных системах (a), с положительными (b) и с отрицательными (c) отклонениями от закона Рауля.
|
|
|
Если в растворе энергии взаимодействия между однородными молекулами меньше, чем между разнородными, то образование раствора обычно сопровождается выделением тепла (ДЖО) и уменьшением объема [Vр_ ра <VA + VB.
Это затрудняет процесс испарения, и экспериментально определенные значения давления пара оказываются ниже рассчитанных по закону Рауля (рис.3.25 с) -раствор проявляет отрицательные отклонения от закона Рауля. Температура кипения в этих системах выше, чем в идеальных. Такие растворы встречаются сравнительно редко. К их числу относятся, например, смеси вода - серная кислота, вода - азотная кислота, хлороформ - бензол и др.
Наконец, существуют растворы (например, пиридин - вода, ацетонитрил - вода), для которых в различных областях концентраций знак отклонения от закона Рауля различен.
У многих изученных смесей положительные или отрицательные отклонения от закона Рауля настолько велики, что на кривой зависимости давления насыщенного пара от состава раствора появляется экстремальная точка (максимум или минимум соответственно).
Вид различных типов диаграмм равновесия давление - состав, температура кипения - состав, состав жидкой фазы - состав паровой фазы для неидеальных систем приведен на рис. 24.2. Во всех случаях на диаграммах равновесия, которые представлены на этом рисунке, более летучим является компонент
A (при T=const p 0, A > p 0, B и при p=const T кип., A < T кип., B). Сопоставление показывает, что диаграммы состав – температура кипения представляют собой как бы искаженное зеркальное изображение диаграмм состав – давление пара: высокому давлению пара соответствует низкая температура кипения, минимуму на кривой давления пара – максимум на кривой температура кипения и т.д.

Рис. 24.2. Диаграммы равновесия жидкость – пар для неидеальных систем: a, c – с положительными отклонениями от закона Рауля; b, d – с отрицательными отклонениями от закона Рауля; c, d – с образованием азеотропа
|
|
|
Диаграммы температура кипения – состав, называемые также диаграммами кипения, лежат в основе перегонки и ректификации – процессов, используемых при очистке жидкостей и разделении их на индивидуальные компоненты. Для иллюстрации рассмотрим, как будут изменяться составы фаз в процессе испарения жидкости и конденсации пара (рис. 24.3).
| вен составу исходной жидкой системы. |
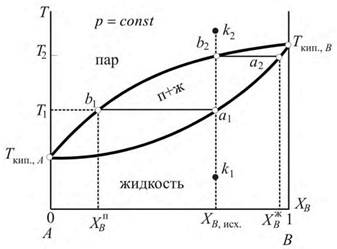
|
| Рис. 24.3. Изменение составов жидкой и паровой фаз при нагревании жидкости и охлаждении пара. |
Если нагревать гомогенную жидкую систему, исходный состав которой характеризуется точкой k 1 (рис. 24.3), то кипение жидкости начнется при температуре T 1, соответствующей точке a 1 на линии испарения. Другой конец ноды a 1 b 1 (точка b 1, лежащая на линии конденсации) показывает состав первых пузырьков пара. При дальнейшем повышении температуры состав жидкости изменяется по кривой a 1 a 2, а пара, равновесного с ней, – по кривой b 1 b 2 (жидкость, по сравнению с исходной системой, обогащена менее летучим компонентом B, а пар – легколетучим компонентом A). В результате при температуре T 2, соответствующей точке b 2, вся жидкость перейдет в пар, состав которого ра-Аналогично, если охлаждать пар, исходный состав которого характеризуется точкой k 2, то его конденсация начнется при температуре T 2, соответствующей точке b 2; точка a 2 характеризует состав первых капель жидкости. При дальнейшем понижении температуры состав пара изменяется по кривой b 2 b 1, а состав жидкости – по кривой a 2 a 1. При температуре T 1, соответствующей точке a 1, процесс конденсации завершится. Система будет представлять собой гомогенную жидкость, состав которой равен составу исходного пара.
В результате этих процессов не происходит разделения исходной системы на чистые компоненты. Чтобы добиться разделения исходного жидкого раствора или пара на чистые компоненты (или фракции, отличающиеся температурой кипения), нужно отводить пар (или жидкость) и многократно повторять процесс испарения или конденсации, т. е. провести так называемую простую перегонку.

|
| Рис. 24.4. Простая перегонка |
Раствор, обозначенный на рис. 24.4 точкой c, нагревается до температуры T 1; при этом испарение не доходит до конца и в системе будут сосуществовать в равновесии жидкость состава f 1 и пар состава g 1, которые разделяются в сепараторе. Затем жидкую фазу состава f 1 нагревают до температуры T 2, получают новую жидкую фазу состава f 2 и пар состава g 2 и опять
|
|
|
отделяют пар от жидкости, и т. д. После многократного повторения этой операции в жидкой фазе (называемой кубовым остатком) останется только чистый компонент B. Аналогично (путем ступенчатой конденсации пара исходного состава g 1 и отделения на каждой ступени конденсата) при конденсации последней порции пара будет получен только чистый компонент A.
Таким образом, из жидкой смеси, у которой на кривых испарения и конденсации нет экстремальных точек, методом простой перегонки можно получить чистый компонент A и чистый компонент B (хотя их количество будет невелико).
Устранить потери жидкости и пара на каждой ступени перегонки можно, если для разделения компонентов не использовать по отдельности процессы испарения и конденсации, а осуществлять их одновременно и многократно в противоточной колонне с большим количеством ступеней. Такой процесс разделения жидких смесей называют ректификацией. В ректификационных колоннах пар, поднимаясь вверх, барботирует через слой жидкости, охлаждается, частично конденсируется и обогащается легкокипящим компонентом, а стекающая ему навстречу жидкость, попадая в область все более высоких температур, частично испаряется и обогащается высококипящим компонентом. В конечном итоге в конденсате (дистилляте) оказывается чистый низкокипящий компонент, а в кубовом остатке – высококипящий.
|
|
|


