 |
Данные для расчёта общего порядка реакции
|
|
|
|
| номер | τ, с | CA, моль/л | ln(CA) | ΔСА, моль/л | Δτ, | υ, моль/л·с | ln(υ) | n |
1. На кинетической кривой (рис. 4.2) выбирают 4–5 точек и проводят касательные.
2. Рассчитывают скорости реакции по веществу А в соответствующий момент времени по тангенсам угла наклона касательных υr = dCA/d τ или приближенно
υr = ΔCA/Δ τ;
3. Рассчитывают логарифмы ln CA и ln υr;
4. Строят график зависимости ln CA от ln υr и по тангенсу угла определяют порядок реакции.
Расчёт активационных параметров реакции
1. Провести три опыта при различных температурах (задаётся преподавателем) и рассчитать значения К в соответствии с п.п. 1-3.
2. Рассчитать значения логарифмов К и обратных температур 1/Т. Построить график зависимости lg K – 1/T и по тангенсу угла наклона определить энергию активации Еакт.
3. По найденному значению энергии активации рассчитывают энтальпию реакции (Δ HоТ) по уравнению (3.12), энтропию реакции (Δ SоТ) по уравнению (3.13) и изобарно-изотермический потенциал (Δ GоТ) по уравнению (3.14).
4. Записывают полученное кинетическое уравнение (см. уравнение 3.15).
ПРАВИЛА БЕЗОПАСНОЙ РАБОТЫ
1. Перед началом эксперимента проверить включение вытяжного шкафа.
2. Проверить с преподавателем правильность собранной установки.
3. Не допускать попадания раствора щелочи на кожу рук и в глаза.
4. Работу выполнять с использованием защитных очков.
5. Не допускать пролива хлорангидрида бензойной кислоты, а также попадания его на кожу рук и одежду.
|
|
|
6. При загрузке хлорангидрида бензойной кислоты пользоваться резиновыми перчатками.
7. Не допускается использование открытого огня вблизи лабораторной установки.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Ход работы и порядок расчетов.
2. Методы синтеза и технология процессов получения сложных эфиров.
3. Механизм и кинетика реакций хлорангидридов карбоновых кислот со спиртами.
4. Экспериментальные методы исследования кинетики гомогенных химических процессов.
5. Методы определения порядка реакции.
6. Влияние температуры на скорость химических реакций.
7. Методы определения энергии активации.
Лабораторная работа № 3
Экспериментальное определение
Химического равновесия в гомогенных
Системах и термодинамический анализ
Химических процессов
ЦЕЛЬ РАБОТЫ
Цель работы: Экспериментальное изучение закономерностей обратимых реакции на примере этерификации уксусной кислоты этиловым спиртом, и расчет основных термодинамических показателей химического процесса.
Задачи:
– Знакомство с экспериментальными методами исследования химического равновесия.
– Изучение методов расчета константы равновесия реакции по полученным экспериментальным данным и по справочным термодинамическим величинам.
Знания: Студент должен знать теоретические основы химического равновесия, влияние технологических параметров на его смещение.
Умения: На основе полученных экспериментальных данных провести расчеты константы равновесия реакции.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Химическое равновесие
Химические процессы подразделяются на обратимые и на необратимые. Понятие химическое равновесие применимо только к обратимым реакциям. В действительности же все химические процессы обратимы, так как при соответствующих условиях любой процесс может протекать с заметной скоростью, как в прямом, так и в обратном направлении.
|
|
|
Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции равна скорости обратной реакции.
К обратимым реакциям можно отнести синтез аммиака из элементов его составляющих: 
N2 + 3H2 «2NH3 
окисление сернистого альдегида до серного
SO2 + 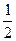 O2 «SO3
O2 «SO3
Синтез сложных эфиров из соответствующих органических кислот и спиртов, например:
CH3COOH + C2H5OH «CH3COOC2H5 + H2O
Все обратимые процессы во времени стремятся к равновесию, при котором скорости прямого и обратного процесса уравниваются, в результате чего соотношение компонентов в реакционной массе остается неизменным, пока в элементе не изменяются параметры технологического режима.
Устойчивое равновесие характеризуется:
a) неизменностью равновесного состояния системы во времени при постоянных внешних условиях;
b) подвижностью равновесия, т.е. самопроизвольным восстановлением состояния равновесия после снятия внешнего воздействия, вызвавшего отклонение системы от положения равновесия;
c) динамическим характером равновесия, т.е. установлением и сохранением равновесия вследствие равенства скоростей прямого и обратного процессов;
d) минимальным значением энергии Гиббса /G/ в изобарно-изотермических и энергией Гельмгольца /F/ в изохорно- изотермических процессах (DG=0, DG<0; DF<0).
Качественно подвижное равновесие определяется принципом Ле-Шателье, а количественно – константой равновесия.
При анализе идеальных обратимых химических процессов константу равновесия выражают через концентрации газов (жидкостей) в молях•литр-1
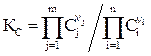 (2.1)
(2.1)
через парциальные давления газов, участвующих в реакции
 (2.2)
(2.2)
через мольные доли
 (2.3)
(2.3)
а также через число молей веществ участников реакции
 (2.4)
(2.4)
В уравнениях (2.1-2.4) П – символ произведения; n – стехиометрический коэффициент; j,i – индексы, соответственно относящиеся к продуктам реакции и исходным веществам.
Для реальных процессов константу равновесия выражают через летучести и активности
 (2.5)
(2.5)
 (2.6)
(2.6)
При небольших давлениях и практически при любых температурах
Ka = Kf = Kp = KN·P Dn = Kn 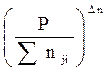 (2.7)
(2.7)
Константа равновесия является величиной постоянной (при данных Р и Т) для каждой реакции. Однако, также как и тепловой эффект константа равновесия зависит от температуры.
|
|
|
|
|
|


