 |
Опыт №2. Химические свойства металлов. Взаимодействие металлов с концентрированными и разбавленными кислотами.
|
|
|
|
| Кислота | Активные металлы H2 Неактивные металлы |
| Li Al | |
| HCl(к), (р) (H2SO4(p) H3PO4 CH3COOH) | H+ 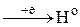  │ │
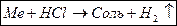 │ Не реагируют
j<0 │ Ag + HCl ¹ │ Не реагируют
j<0 │ Ag + HCl ¹
|
| H2SO4(к) |  Не реагирует
↓ ↓ ↓ только с Pt, Au
SO2 S H2S
Продукты восстановления Не реагирует
↓ ↓ ↓ только с Pt, Au
SO2 S H2S
Продукты восстановления
 Увеличение активности металла.
Увеличение активности металла.
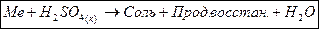 Пассивируются Al, Fe
Пассивируются Al, Fe 
|
| HNO3(р) |  Не реагирует
↓ ↓ ↓ ↓ с Pt, Au
NO N2O N2 NH3(NH4+)
Продукты восстановления Не реагирует
↓ ↓ ↓ ↓ с Pt, Au
NO N2O N2 NH3(NH4+)
Продукты восстановления
 Уменьшение концентрации кислоты
Увеличение активности металла.
Уменьшение концентрации кислоты
Увеличение активности металла.
 Пассивируется Ti
Пассивируется Ti
|
| HNO3(к) |  Не реагирует с
↓ Pt, Au
NO2 Не реагирует с
↓ Pt, Au
NO2
 Пассивируюся Fe, Ni, Cr, Ti, Al
Пассивируюся Fe, Ni, Cr, Ti, Al
|
Лабораторная работа № 11
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
(Глинка Н.Л., 2000, 9.3.1, Коровин Н.В., 2000, §9.2-9.5, 9.8)
Цель занятия: изучить условия возникновения и работы гальванических пар в различных средах.
Теоретические сведения
Под электрохимическими процессами понимаются процессы, сопровождающиеся превращением химической энергии в электрическую и электрической энергии в химическую.
Электрохимические процессы относятся к окислительно-восстановительным. В окислительно-восстановительных реакциях электроны непосредственно переходят от восстановителя к окислителю. При электрохимических процессах полуреакции окисления и восстановления пространственно разделены, а электроны переходят от восстановителя к окислителю по внешнему проводнику.
При погружении металлической пластинки в раствор собственной соли образуется металлический электрод (см.рис.6), при этом возникает двойной электрический слой на границе раздела двух фаз: металл-раствор, это обусловлено тем, что под действием полярных молекул растворителя ионы кристаллической решетки металла переходят в раствор электролита, а избыток электронов заряжают поверхность металлической пластины отрицательно (в случае цинкового электрода, т.к.  ). В случае с медной пластинкой, ее поверхность будет заряжаться положительно, т.к.
). В случае с медной пластинкой, ее поверхность будет заряжаться положительно, т.к.  и ионы Cu2+ из раствора будут осаждаться на ее поверхности.
и ионы Cu2+ из раствора будут осаждаться на ее поверхности.
|
|
|
 Рис.6 Рис.6
|
Преобразование химической энергии в электрическую осуществляется в устройствах, называемых гальваническими элементами.
Один из типов гальванических элементов представляет собой систему (см. рис.7), состоящую из двух металлических пластин – проводников I рода (электронный проводник), погруженных в растворы электролитов- проводников II рода (ионный проводник).
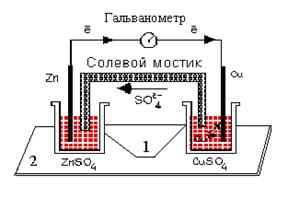
| Рис. 7. Гальванический элемент. Солевой мостик заполнен электролитом, обычно KCl или NH4NO3, который является проводником ионов. |
Электроды, соединенные проводником, образуют внешнюю электрическую цепь гальванического элемента. Растворы электролитов соединяются посредством электролитического мостика (полупроницаемой мембраной) и образуют внутреннюю цепь.
Металл с меньшим значением электродного потенциала является источником электронов, поступающих во внешнюю цепь гальванического элемента. Этот электрод заряжается отрицательно за счет избытка электронов. Металл с большим значением электродного потенциала принято считать положительным электродом.
Отрицательно заряженный электрод в гальваническом элементе называется анодом. На аноде протекает процесс окисления атомов металла.
Положительно заряженный электрод называется катодом. На катоде протекает процесс восстановления ионов из раствора электролита и выделение их на электроде.
Непременным условием работы гальванического элемента является разность потенциалов его электродов. Она называется электродвижущей силой гальванического элемента – ЭДС (Е). Е = φк – φА, В.
|
|
|
ЭДС всякого работающего элемента – величина положительная (E>0, а DGг.э<0).
Для вычисления ЭДС гальванического элемента в условиях, отличных от стандартных, используют уравнение Нернста, которое позволяет первоначально рассчитать значение электродных потенциалов катода и анода, применительно к данным условиям, а затем уже и ЭДС элемента.
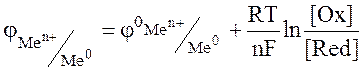 или
или
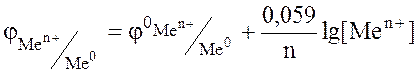
где  стандартный электродный потенциал металла, В; n – заряд иона металла; [Ox] и [Red] – концентрация окисленной и восстановленной формы ионов металла в растворе его соли, моль/л; R- универсальная газовая постоянная, R=8,31 Дж/моль.К; Т - температура, Т=298 К; F- постоянная Фарадея, F=96500 Кл/моль.
стандартный электродный потенциал металла, В; n – заряд иона металла; [Ox] и [Red] – концентрация окисленной и восстановленной формы ионов металла в растворе его соли, моль/л; R- универсальная газовая постоянная, R=8,31 Дж/моль.К; Т - температура, Т=298 К; F- постоянная Фарадея, F=96500 Кл/моль.
D Gг.э = – n FE
Переход химической энергии системы в электрическую будет осуществляться самопроизвольно, если изменение свободной энергии системы, при переходе ее из начального состояния, в конечное меньше нуля.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Выполнение работы: Один из стаканчиков 1 (см.рис.2) заполнить доверху 1М раствором сульфата цинка, другой – 1М раствором сульфата меди. Оба стаканчика поставить в углубления подставки 2. Соединить стаканчики электролитическим мостиком, заполненным насыщенным раствором хлорида калия в смеси с агар-агаром. Опустить в раствор сульфата цинка узкую цинковую пластинку, а в раствор сульфата меди – медную. Соединить электрическим проводом опущенные пластинки с гальванометром. Наблюдать отклонение стрелки гальванометра, указывающее на возникновение электрического тока вследствие разных значений электродных потенциалов цинка и меди.
Запись данных опыта. Изобразить двойной электрический слой на границе раздела металл-раствор его соли на цинковом и медном электродах. Чем они отличаются качественно? Написать уравнения реакций, протекающих на электродах, и суммарное уравнение химической реакции, лежащее в основе работы гальванического элемента. В каком направлении переносятся электроны во внешней цепи? Вычислить стандартную ЭДС элемента. Какие ионы и в каком направлении перемещаются в растворе?
Простейший гальванический элемент состоит из 2-х металлов, различной степени активности, погруженных в растворы собственных солей (электроды I рода). Например: цинковая и медная пластины соединены проводником и погружены соответственно в растворы сульфата цинка и сульфата меди. Найдем значения стандартных потенциалов для меди и цинка:
|
|
|
 0, 76В
0, 76В 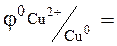 0,34 B.
0,34 B.
Цинковый электрод, имеющий меньшее значение электродного потенциала, будет выполнять роль анода, медь – катода.
|
|
|


