 |
Биологическая роль макроэргов
|
|
|
|
Энергия, накопленная в одних макроэргах, может передаваться от одной молекулы к другой. Для некоторых макроэргов характерным является то, что накопленная в них энергия может непосредственно использоваться для совершения различных видов работы. Например, 1,3-дифосфоглицерат, фосфоенолпируват и креатинфосфат принимают участие в реакциях субстратного фосфорилирования, в которых эти субстраты передают свою макроэргическую связь на АДФ с образованием АТФ. Креатинфосфат находится в больших концентрациях в мышцах, где выполняет функцию депо энергии для мышечного сокращения. Карбамоилфосфат используется в клетках печени для синтеза мочевины.
АТФ является универсальной энергетической валютой клетки, потому что только это соединение способно непосредственно отдавать свою энергию, накопленную в макроэргических связях, на совершение любого вида работы или энергозависимого процесса.
 |
Рис. 1. Строение макроэргов.
Исключения составляют только ГТФ (его энергия используется для синтеза белка), ЦТФ (его энергия используется для синтеза сложных липидов) и УТФ (его энергия расходуется для синтеза полисахаридов).
Тиоэфиры участвуют в реакциях цикла трикарбоновых кислот (сукцинил-КоА), обмена липидов, аэробного гликолиза.
АТФ: ПУТИ СИНТЕЗА И ИСПОЛЬЗОВАНИЯ
АТФ содержит 3 фосфорных остатка и 2 макроэргические связи (рис. 1).
В клетке существует два пути синтеза АТФ: окислительное фосфорилирование и субстратное фосфорилирование.
Окислительное фосфорилирование – это синтез АТФ из АДФ и Фн (неорганического фосфата) с использованием энергии, образующейся в цепи тканевого дыхания (ЦТД). Около 90 % АТФ клетки образуется этим путем.
|
|
|
Субстратное фосфорилирование – это синтез АТФ из АДФ и Фн с использованием энергии макроэргической связи макроэргического субстрата. Этим путем образуется около 10 % АТФ клетки. Схему субстратного фосфорилирования можно представить следующим образом:

В реакции субстратного фосфорилирования АДФ может принимать макроэргическую фосфатную группу от 1,3-дифосфоглицерата, фосфоенолпирувата, креатинфосфата с образованием АТФ.
АТФ играет центральную роль в энергетическом обмене в организме. АТФ постоянно синтезируется и расходуется. АТФ является универсальным источником энергии в клетке. Свободная энергия, выделяющаяся при гидролизе АТФ, используется для выполнения в организме различных видов работы (энергозависимых процессов). Пути образования и использования АТФ представлены на рис. 2.
 |
Рис. 2. Пути образования и использования АТФ.
ЦЕПЬ ТКАНЕВОГО ДЫХАНИЯ
Цепь тканевого дыхания (ЦТД) находится в клетке на внутренней митохондриальной мембране.
ЦТД состоит из нескольких компонентов (переносчиков), которые располагаются друг за другом в определенной последовательности. Компоненты ЦТД переносят протоны и электроны (или только электроны) от восстановленных субстратов (SH2) или от восстановленных коферментов (НАДH2, ФАДH2, ФМН-Н2) на кислород (O2) с образованием воды. Таким образом, в цепи тканевого дыхания происходит ряд окислительно-восстановительных реакций. Окисление субстратов или коферментов означает потерю двух электронов или двух атомов водорода; восстановление означает их приобретение. Компоненты ЦТД окисляют восстановленные субстраты и восстановленные коферменты постепенно, в несколько этапов, и в каждой из этих стадий любой переносчик может служить то донором, то акцептором протонов и электронов. При протекании последовательных окислительно-восстановительных реакций, которые имеют место в ЦТД, выделяется свободная энергия. Значительная часть этой энергии (50-75%) накапливается в макроэргических фосфатных связях АТФ, а остальная часть рассеивается в виде тепла.
|
|
|
Различают два типа ЦТД: длинную и короткую.
Последовательность переносчиков в длинной цепи такова: НАД-дегидрогеназа, ФМН-дегидрогеназа, кофермент Q и цитохромы (b, c1, c, aa3). В длинной цепи имеется три места, в которых количество образованной энергии оказывается достаточным для синтеза АТФ из АДФ и неорганического фосфата (Фн). Таким образом, в длинной цепи тканевого дыхания 3 молекулы АТФ.
Короткая цепь содержит следующие компоненты: ФАД-дегидрогеназа, кофермент Q и цитохромы (b, c1, c, aa3). В короткой цепи имеется два места, в которых образуется энергия, достаточная для синтеза АТФ из АДФ и Фн. Таким образом, в короткой цепи образуется две молекулы АТФ.
Другими словами, при окислении НАДН2 в ЦТД образуется 3 молекулы АТФ, при окислении ФАДН2в ЦТД образуется 2 молекулы АТФ. Схема ЦТД представлена на рис. 3.
 |
Рис. 3. Схема цепи тканевого дыхания.
SН2 – восстановленный субстрат, S – окисленный субстрат.
НАД (НАДФ) – ЗАВИСИМЫЕ ДЕГИДРОГЕНАЗЫ
НАД (НАДФ)-зависимые дегидрогеназы являются сложными ферментами. Их небелковую часть составляет НАД (никотинамидадениндинуклеотид) или НАДФ (никотинамид-адениндинуклеотидфосфат), которые являются производными никотинамида (витамина РР). Строение НАД (НАДФ) и функционирование их активной части представлено на рис. 4.

Рис. 4. Строение НАД(Ф) и функционирование его активной части.
Реакции, катализируемые НАД-дегидрогеназами:
 |
Субстратами (донорами водорода) для НАД-дегидрогеназ являются: изолимонная кислота (изоцитрат), яблочная кислота (малат), пировиноградная кислота (пируват), α-кетоглутаровая кислота (α-кетоглутарат), глутаминовая кислота (глутамат).
Присоединение двух атомов водорода (2H+ и 2ē) к НАД происходит в активной части молекулы НАД (рис. 4). При этом один атом водорода (один протон и один электрон) внедряется в пиридиновое кольцо, второй электрон нейтрализует положительный заряд на атоме азота, а другой свободный ион H+ (протон) остается в среде. Для простоты изложения, восстановленная форма НАД (то есть НАДH+H+) обозначается как НАДH2.
|
|
|
НАД-дегидрогеназы принимают водород от субстратов и переносят его на ФМН в длинной цепи (рис. 3).
В клетках имеются также НАДФ-дегидрогеназы. Они отличаются от НАД-дегидрогеназ по структуре, локализации в клетке и функциям. В молекуле НАДФ имеется дополнительный остаток фосфорной кислоты, присоединенный к 2′-углероду рибозы, входящей в состав АМФ (рис. 4). НАД-зависимые дегидрогеназы участвуют, главным образом, в переносе электронов и протонов от субстратов к кислороду, т.е. связаны с функционированием ЦТД. В отличие от них, НАДФ-зависимые дегидрогеназы участвуют в реакциях биосинтеза (например, синтез жирных кислот, синтез холестерина и т.д.), микросомальном окислении, обезвреживании аммиака в организме. В соответствии с выполняемой функцией НАД локализуется, главным образом, в митохондриях, а НАДФ – в цитоплазме.
ФАД (ФМН) – ЗАВИСИМЫЕ ДЕГИДРОГЕНАЗЫ
ФАД (ФМН)-зависимые дегидрогеназы также являются сложными ферментами. Их небелковая часть представлена ФАД (флавинадениндинуклеотид) или ФМН (флавинмононуклеотид), которые являются производными витамина В2 (рибофлавин).
Структура ФАД и ФМН представлена на рис. 5.
ФМН-дегидрогеназы находятся в короткой ЦТД. Реакция, каталтзируемая ФМН-дегидрогеназой:
  |
Рис. 5. Строение ФАД и ФМН.
ФАД-дегидрогеназы локализуются в длинной ЦТД.
Реакция, катализируемая ФАД-дегидрогеназами:
 |
В этой реакции субстрат окисляется, а ФАД восстанавливается. Субстратами для ФАД-дегидрогеназ являются сукцинат и активная форма жирных кислот – ацил-КоА.
Активной частью ФАД и ФМН является изоаллоксазиновое кольцо рибофлавина. Ее функционирование представлено на рис. 6. Активная часть ФАД и ФМН принимает два атома водорода (т.е. два протона и два электрона) с соответствующей перегруппировкой двойных связей и образованием восстановленных форм коферментов.
 |
|
|
|
Рис. 6. Функционирование активной части ФАД и ФМН.
Таким образом, ФАД-дегидрогеназы принимают два атома водорода от субстратов в короткой цепи и переносят водород на кофермент Q. ФМН-дегидрогеназы принимают два атома водорода от НАД2 в длинной цепи и переносят водород на кофермент Q.
КОФЕРМЕНТ Q
Кофермент Q (КоQ), или убихинон, представляет собой жирорастворимый компонент ЦТД и не является ферментом.
Кофермент Q принимает два атома водорода от ФМН-Н2 (в длинной цепи) или от ФАДН2 (в короткой цепи) и делит поток водорода на две части: протоны и электроны. Протоны выходят в среду, а электроны передаются на цитохромы (первым акцептором электронов в ряду цитохромов является цитохром b). Структура кофермента Q и функционирование его активной части представлено на рис. 7.
 |
Рис. 7. Строение кофермента Q и функционирование его активной части.
ЦИТОХРОМЫ
Цитохромы переносят электроны от КоQH2 на кислород. Последовательность цитохромов в ЦТД следующая: b, c 1, c, aa 3. Цитохромы являются сложными ферментами, которые в качестве простетической группы содержат геминовую группу, подобную строению гема гемоглобина.
Строение простетической группы цитохрома b представлено на рис. 8.
 |
Рис. 8. Строение простетической группы цитохрома b.
Цитохромы ЦТД отличаются друг от друга своими простетическими группами, белковой частью, спектрами поглощения и окислительно-восстановительными потенциалами.
При переносе электронов в цепи цитохромов происходит обратимое изменение валентности железа в геминовой группе между Fe2+ и Fe3+:
 |
Цитохромы b, c 1, и c являются промежуточными переносчиками электронов, цитохром aa 3 (называемый также цитохромоксидазой) переносит электроны непосредственно на кислород. Атом кислорода является конечным акцептором электронов в ЦТД.
Цитохромоксидаза состоит из 6 субъединиц, 2 из которых составляют цитохром а и 4 – цитохром а 3.
Атом кислорода принимает два электрона от цитохрома aa 3 и затем связывается с двумя протонами (выделенными в среду на уровне кофермента Q), образуя молекулу воды.
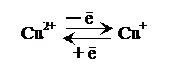
Кроме железа, цитохром aa 3 содержит медь, которая обратимо окисляется и восстанавливается между Cu2+ и Cu+:
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
Окислительное фосфорилирование характеризуется как процесс синтеза АТФ из АДФ и Фн (неорганического фосфата) за счет энергии, образующейся в цепи тканевого дыхания. Этот процесс протекает в митохондриях.
Компоненты ЦТД образуют три больших белковых комплекса во внутренней митохондриальной мембране. Каждый комплекс использует энергию переноса электронов для перекачивания протонов из матрикса на наружную поверхность внутренней мембраны митохондрий.
|
|
|
Механизм окислительного фосфорилирования описывается хемиосмотической теорией, предложенной П. Митчеллом. Согласно теории, митохондриальный транспорт электронов сопряжен с синтезом АТФ через протонный градиент. Это означает, что энергия, образованная в результате переноса каждой пары электронов по ЦТД, через внутреннюю мембрану митохондрий из матрикса в межмембранное пространство (рис. 9).
В соответствии с этим, наружная поверхность внутренней мембраны митохондрий приобретает положительный заряд, а внутренняя поверхность внутренней мембраны – отрицательный. В результате на внутренней митохондриальной мембране возникает электрохимический потенциал. Поскольку внутренняя мембрана митохондрий непроницаема для протонов, то они могут выйти назад, в матрикс, только через АТФ-синтазный комплекс, локализованный в этой мембране.

Рис. 9. Механизм окислительного фосфорилирования АДФ (теория П. Митчелла).
АТФ-синтазный комплекс содержит белки, которые образуют канал во внутренней митохондриальной мембране. Через этот канал протоны могут проходить из межмембранного пространства в матрикс митохондрии. Перенос протонов из зоны с большей концентрацией H+ в зону с меньшей концентрацией протонов сопровождается выделением свободной энергии, которая используется для образования АТФ из АДФ и Фн. Таким образом, АТФ можно рассматривать как электрическую батарею (аккумулятор), в которой энергия для синтеза АТФ запасается в виде протонного градиента.
В норме при переносе электронов по ЦТД около 50-75% образующейся энергии запасается в макроэргических фосфатных связях АТФ, и приблизительно 25-50% образованной энергии рассеивается в виде тепла.
Коэффициент P/O. Коэффициент P/O используется для характеристики энергопродукции в обоих типах ЦТД)длинной и короткой). В коэффициенте P/O символ P обозначает фосфат, символ O означает атом кислорода. Коэффициент P/O показывает количество молекул неорганического фосфата, связавшихся с АДФ (с образованием АТФ), в расчете на один атом поглощенного кислорода.
В длинной цепи коэффициент Р/О равен 3; в короткой цепи он равен 2.
РЕГУЛЯЦИЯ ЦТД: АКТИВАТОРЫ И ИНГИБИТОРЫ ЦТД. РАЗОБЩИТЕЛИ
При функционирования ЦТД в ней происходит окисление субстратов, потребление кислорода, образование энергии и синтез АТФ. Цепь тканевого дыхания функционирует тогда, когда есть необходимость в наработке АТФ. Активаторами ЦТД являются: АДФ, Фн, кислород и восстановленные субстраты (SH2). Активаторы активируют ЦТД и увеличивают синтез АТФ.
Ингибиторы ингибируют ЦТД, и АТФ не образуется. Ингибиторами ЦТД являются:
снотворные (барбитураты, амитал, хлорпромазин и др.);
антибиотики (антимицин);
пирицидин;
нафтохинон;
некоторые яды, такие как цианиды и угарный газ (СО).
Амитал и хлорпромазин ингибируют перенос водорода от ФМН-Н2 к коферменту Q. Антимицин и нафтохинон блокируют перенос электронов от цитохрома b к цитохрому c 1.Цианиды и СО связываются с железом (медью) в цитохроме aa 3 (цитохромоксидазе) и ингибируют фермент. В результате кислород не может принимать электроны, потребление кислорода снижается, прекращается наработка энергии, и быстро наступает смерть.
Разобщители разобщают ЦТД и окислительное фосфорилирование.
В норме существует сопряжение между ЦТД и окислительным фосфорилированием (т.е. между окислительными процессами в ЦТД и синтезом АТФ за счет энергии, образующейся в ЦТД). Это означает, что в норме при функционировании ЦТД происходит синтез АТФ.
В нормальных условиях из всей энергии, которая образуется при протекании окислительно-восстановительных реакций в ЦТД, около половины энергии (50-75 %) запасается в виде АТФ, а остальная часть рассеивается в виде тепла.
Разобщители способны переносить протоны из межмембранного пространства в матрикс и, таким образом, обходить АТФ-синтазный комплекс. При действии разобщителей ЦТД продолжает работать: субстраты окисляются, кислород потребляется, энергия образуется. Но из-за действия разобщителей протонный градиент на внутренней митохондриальной мембране исчезает; поэтому АТФ не образуется, и вся энергия ЦТД рассеивается в виде тепла.
Поэтому симптомами действия разобщителей являются повышение температуры тела и мышечная слабость (из-за снижения образования АТФ, необходимого для мышечного сокращения и поддержания тонуса мышц). Примерами разобщителей ЦТД и окислительного фосфорилирования могут быть: 2,4-динитрофенол, гормоны тироксин и прогестерон, некоторые антибиотики, ионы кальция, дикумарол (антикоагулянт), жирные кислоты, компоненты микробных клеток, бурой жировой ткани (у животных, впадающих в зимнюю спячку, у новорожденных).
НАРУШЕНИЯ ЭНЕРГЕТИЧЕСКОГО ОБМЕНА
Молекулы АТФ постоянно расходуются в организме на энергозависимые процессы, поэтому клетки постоянно нуждаются в АТФ. Вместе с тем, в клетках не существуют запасы АТФ. Поэтому для поддержания синтеза АТФ на должном уровне в организм должны поступать пищевые вещества (субстраты для окисления в ЦТД) и кислород. При недостатке питания (голодание) эндогенные субстраты тканей служат донорами субстратов для наработки энергии.
Нарушения энергетического обмена (гипоэнергетические состояния) возникают при недостатке субстратов в организме, гипоксии (недостаточное поступление кислорода), а также дефиците витаминов (гиповитаминозы), производные которых составляют основу структурной организации ЦТД.
Гипоксия
Гипоксия является наиболее частой причиной гипоэнергетических состояний.
Выделяют гипоксии экзогенные и эндогенные.
Экзогенная гипоксия возникает вследствие пониженного содержания кислорода (сниженное парциальное давление кислорода, рО2) во вдыхаемом воздухе. Это наблюдается при подъеме на значительную высоту или при разгерметизации летательных аппаратов.
Эндогенная гипоксия возникает при наличии патологических процессов, связанных с нарушением снабжения тканей кислородом или вызванных нарушением утилизации (использования) кислорода тканями. Различают несколько видов гипоксии.
1) Дыхательная гипоксия возникает в результате снижения вентиляции альвеол легких (обструкция дыхательных путей инородным телом, отек легкого, спазм бронхов при астме, воспалительные процессы – пневмонии, бронхиты, плевриты).
2) Сердечно-сосудистая (циркуляторная) гипоксия возникает при нарушении кровообращения, что приводит к недостаточному поступлению крови к органам и тканям (сердечная недостаточность, выраженная кровопотеря, тромбозы, спазм артерии).
3) Гемическая гипоксия наблюдается при анемии и связана с уменьшением количества эритроцитов или сниженным содержанием гемоглобина в эритроцитах. Причины гемической гипоксии:
а) гемоглобинопатии (генетические дефекты гемоглобина, такие как серповидноклеточная анемия, талассемия и др.);
б) отравление угарным газом, СО (в результате образуется карбоксигемоглобин, который не способен переносить кислород);
в) отравление метгемоглобин-образующими агентами, такими как нитраты, анилиновые красители, некоторые лекарства (сульфаниламиды, амилнитрит и др.).
4) Гистотоксическая гипоксия возникает при нарушении поступления кислорода из крови в ткани. Этот тип гипоксии вызывается ингибиторами ЦТД, например, при отравлении цианидами. После проникновения в клетку ионов CNˉ они взаимодействуют с Fe3+ и приводят к ингибированию цитохромоксидазы, что в свою очередь снижает потребление кислорода клеткой.
|
|
|


