 |
Опыт № 1. Получение золя фенолфталеина методом замены растворителя.
|
|
|
|
Дорожном материаловедении»
Лабораторный практикум
для студентов специальности 291000 «Автомобильные дороги и аэродромы» очной и заочной формы обучения
Тюмень – 2008
УДК 625.07(075.8)
ББК
Пимнева Л.А. Физическая химия в дорожном материаловедении: Лабораторный практикум для студентов специальности 291000 «Автомобильные дороги и аэродромы» дневной и заочной формы обучения. - Тюмень: РИЦ ГОУ ВПО ТюмГАСУ, 2008, 44 с.
Лабораторный практикум разработан на основании рабочей программы ГОУ ВПО ТюмГАСУ дисциплины «Физическая химия в дорожном материаловедении» для студентов специальности 291000 «Автомобильные дороги и аэродромы» дневной и заочной формы обучения. Практикум содержит методические указания к выполнению лабораторных работ, описание выполнения опытов, к каждой теме дается краткое теоретическое введение, в конце каждой темы представлены контрольные вопросы.
Рецензент: доцент, к.х.н. Краева Н.В.
Тираж 100 экз.
© ГОУ ВПО «Тюменский государственный архитектурно-строительный университет»
© Пимнева Л.А.
Редакционно-издательский центр ГОУ ВПО «Тюменский государственный архитектурно-строительный университет»
предисловие
Лабораторный практикум составлен в соответствии с программой по Физический химии в дорожном материаловедении для студентов специальности 291000 «Автомобильные дороги и аэродромы».
Работы в практикуме подобраны таким образом, что время их выполнения не превышало двух часов. К каждой теме дается краткое теоретическое введение, которое должно при самостоятельной подготовке помочь выполнению предложенных работ.
В конце каждой темы приведены контрольные вопросы.
|
|
|
Общие правила работы в лаборатории
Для успешного выполнения лабораторных работ каждый работающий в лаборатории обязан содержать свое место в чистоте и порядке. Приступая к работе, необходимо ознакомиться с устройством приборов и аппаратов, их принципов действия. Знать свойства применяемых веществ и методы безопасной работы с ними. Пользоваться можно только реактивами, имеющими этикетки и стоящими на полке рабочего стола. Некоторые реактивы, необходимые для выполнения работы, могут находиться в вытяжном шкафу. Излишек взятого реактива не возвращать в посуду, из которой он был взят, а перенести в специальную емкость.
Правила техники безопасности
- Запрещается пробовать на вкус химические вещества.
- Щелочи, кислоты и другие ядовитые вещества необходимо набирать в пипетку только при помощи резиновой груши во избежание химических ожогов полости рта или отравления.
- При взбалтывании растворов в колбах или пробирках необходимо закрывать их пробкой.
- При нагревании жидкостей пробирку следует держать отверстием в сторону от себя и соседей по работе (нагревание вести только в вытяжном шкафу).
- Во избежание ожогов от брызг и выбросов не наклоняться над сосудом, в котором кипит или налита какая-либо жидкость
- При работе с горячими и легковоспламеняющимися веществами (эфиры, спирты, бензин, керосин и т.д.) нельзя нагревать их на открытом огне или сетке.
- При определении запаха вещества не следует делать глубокого вздоха, а лишь движением руки направлять к себе воздух.
- Концентрированную серную кислоту следует приливать в воду тонкой струей при непрерывном перемешивании.
- Нельзя оставлять без присмотра работающие установки, включенные электронагревательные приборы, газовые горелки.
Оказание первой помощи
- При термических ожогах осторожно обнажить обожженный участок и закрыть сухой асептической повязкой. Обожженный участок нельзя как-либо очищать и мочить водой, этиловым спиртом, перекисью водорода или смазывать мазью.
|
|
|
- при химических ожогах промыть обожженное место, не обращая внимания на боль, большим количеством проточной воды (10-15 минут), в случае кислых реагентов – раствором бикарбоната натрия (2%-ным), в случае щелочных – разбавленным раствором борной или уксусной кислот.
- При порезах стеклом: а) промыть рану можно только в случае попадания в нее едких или ядовитых веществ, в остальных случаях, даже если в рану попал песок, ржавчина и т.п., промывать ее водой нельзя; б) нельзя смазывать рану мазями; перед наложением повязки смазать настойкой йода участок вокруг раны; в) удалять из раны мелкие осколки стекла может только врач.
- При отравлении химическими веществами немедленно вызвать врача и одновременно приступить к оказанию к оказанию первой помощи – если яд попал внутрь – вызвать рвоту, дать противоядие.
В лаборатории должен быть список веществ, вызывающих отравление и применяемые противоядия.
В лаборатории должна быть аптечка с набором медикаментов.
Порядок оформления работ
В процессе выполнения лабораторной работы студент должен наблюдать за ходом эксперимента, отмечая все его особенности: изменение цвета, появление запаха, показания прибора и т.д. Результаты наблюдений записываются в тетради для выполнения лабораторных работ, придерживаясь определенной последовательности:
- названия лабораторной работы, даты выполнения;
- цель работы;
- начертить рисунок прибора или схему установки с кратким ее описанием;
- результаты эксперимента должны быть внесены в таблицы;
- должны быть записаны все уравнения реакций для данного опыта
- выводы по каждому опыту.
Лабораторная работа № 1. Определение адсорбции растворенного вещества на границе жидкость – газ (воздух)
Цель работы – построение изотермы поверхностного натяжения 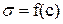 по экспериментальным данным; вычисление адсорбции по графику
по экспериментальным данным; вычисление адсорбции по графику 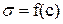 и построение изотермы адсорбции
и построение изотермы адсорбции 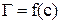 ; вычисление максимальной адсорбции, толщины адсорбционного слоя и площади, занимаемой одной молекулой.
; вычисление максимальной адсорбции, толщины адсорбционного слоя и площади, занимаемой одной молекулой.
|
|
|
Поверхностное натяжение. Поверхностный слой жидкости по своим физико-химическим свойствам отличается от внутренних слоев.
Каждая молекула внутри жидкости притягивает к себе все окружающие ее молекулы и одновременно с такой же силой притягивается равномерно во все стороны окружающими ее молекулами. Следовательно, силовое поле каждой молекулы внутри жидкости симметрично насыщенно (рисунок 1.1). Равнодействующая сил притяжения равна нулю.
 В ином положении оказываются молекулы, расположенные в поверхностном слое. В этом случае на них действуют силы притяжения только со стороны молекул, находящихся в нижней полусфере. Действием молекул газа или пара, находящегося над поверхностью жидкости, можно пренебречь, так как их концентрация несравнимо меньше, чем в жидкости. Равнодействующая молекулярных сил в этом случае не равна нулю и направлена вниз. Таким образом, поверхностные молекулы жидкости находятся под действием силы, стремящейся втянуть их внутрь. Это приводит к тому, что поверхность жидкости стремится сократиться.
В ином положении оказываются молекулы, расположенные в поверхностном слое. В этом случае на них действуют силы притяжения только со стороны молекул, находящихся в нижней полусфере. Действием молекул газа или пара, находящегося над поверхностью жидкости, можно пренебречь, так как их концентрация несравнимо меньше, чем в жидкости. Равнодействующая молекулярных сил в этом случае не равна нулю и направлена вниз. Таким образом, поверхностные молекулы жидкости находятся под действием силы, стремящейся втянуть их внутрь. Это приводит к тому, что поверхность жидкости стремится сократиться.
У молекул поверхностного слоя (рисунок 1.1) неиспользованные силы межмолекулярного притяжения (обозначены пунктирными стрелками) являются источником избыточной энергии, называемой свободной поверхностной энергией. Свободная энергия единицы поверхности называется поверхностным натяжением и обозначается  . Поверхностное натяжение
. Поверхностное натяжение  может быть измерено той работой, которую нужно затратить на преодоление сил сцепления между молекулами для создания новой единицы поверхности.
может быть измерено той работой, которую нужно затратить на преодоление сил сцепления между молекулами для создания новой единицы поверхности.
Поверхностное натяжение можно рассматривать как силу, действующую на единицу длины линии, ограничивающей поверхность жидкости, и направленную в сторону сокращения поверхности.
 Поверхностное натяжение можно определить опытным путем. Наиболее простым является метод «счета капель» при помощи прибора сталагмометра (рисунок 2), который представляет собой пипетку, имеющую две метки; нижняя часть сталагмометра переходит в капилляр, конец которого утолщен и отшлифован для получения одинаковых капель. Метод основан на том, что образующаяся на конце капиллярной трубки сталагмометра капля удерживается силой поверхностного натяжения. Отрывается капля в тот момент, когда ее вес станет равным или превысит на бесконечно малую величину силу поверхностного натяжения, удерживающую каплю. Для жидкостей с большим поверхностным натяжением отрыв капель затруднен, и образующиеся капли будут более крупными, чем у жидкостей с меньшим поверхностным натяжением.
Поверхностное натяжение можно определить опытным путем. Наиболее простым является метод «счета капель» при помощи прибора сталагмометра (рисунок 2), который представляет собой пипетку, имеющую две метки; нижняя часть сталагмометра переходит в капилляр, конец которого утолщен и отшлифован для получения одинаковых капель. Метод основан на том, что образующаяся на конце капиллярной трубки сталагмометра капля удерживается силой поверхностного натяжения. Отрывается капля в тот момент, когда ее вес станет равным или превысит на бесконечно малую величину силу поверхностного натяжения, удерживающую каплю. Для жидкостей с большим поверхностным натяжением отрыв капель затруднен, и образующиеся капли будут более крупными, чем у жидкостей с меньшим поверхностным натяжением.
|
|
|
Таким образом, число капель  , вытекающих из объема
, вытекающих из объема  для жидкости с большим поверхностным натяжением, будет меньше, чем для жидкости с меньшим поверхностным натяжением.
для жидкости с большим поверхностным натяжением, будет меньше, чем для жидкости с меньшим поверхностным натяжением.
Сталагмометр заполняют исследуемой жидкостью и считают число капель  , вытекающих из объема
, вытекающих из объема  . Затем его заполняют дистиллированной водой и считают число капель воды
. Затем его заполняют дистиллированной водой и считают число капель воды 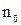 , вытекающих из этого же объема
, вытекающих из этого же объема  . В момент отрыва капли ее вес равен силе поверхностного натяжения. Если из объема
. В момент отрыва капли ее вес равен силе поверхностного натяжения. Если из объема  вытекает
вытекает  капель жидкости, имеющей плотность
капель жидкости, имеющей плотность 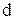 , то вес капли определяется по уравнению
, то вес капли определяется по уравнению  , где
, где 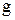 - ускорение силы тяжести.
- ускорение силы тяжести.
Сила поверхностного натяжения, удерживающая каплю, равна 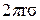 ;
; 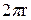 - длина окружности капилляра, от которого отрывается капля.
- длина окружности капилляра, от которого отрывается капля.
В момент отрыва капли ее вес равен силе поверхностного натяжения.
Для исследуемой жидкости
 . (1)
. (1)
Для воды
 , (2)
, (2)
где 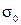 - поверхностное натяжение;
- поверхностное натяжение;  - плотность;
- плотность; 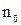 - число капель воды.
- число капель воды.
Поделив уравнение (1) на (2), получим  , откуда
, откуда 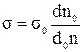 .
.
Величины плотностей жидкости, воды и поверхностное натяжение воды 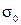 находят по таблицам для соответствующей температуры, при которой производятся измерения.
находят по таблицам для соответствующей температуры, при которой производятся измерения.
Выполнение работы.
Поверхностный слой на границе раздела фаз обладает избыточной энергией. Количественной мерой избытка энергии, отнесенной к единице площади поверхности, является поверхностное натяжение  .
.
Накопление вещества на границе раздела фаз может происходить в результате адсорбции. Различают два случая адсорбции: адсорбцию на жидкой поверхности (границы раздела фаз: жидкость – газ и жидкость – жидкость), адсорбцию на твердой поверхности (границы раздела фаз: твердое вещество – газ и твердое вещество – жидкость). Адсорбция на жидкой поверхности может быть вычислена по уравнению изотермы адсорбции Гиббса
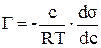 .
.
Как видно из уравнения Гиббса для вычисления адсорбции необходимо определить поверхностное натяжение растворов при различных концентрациях.
Для вычисления адсорбции сделайте следующее графическое построение. По данным таблицы 1.1 построить зависимость поверхностного натяжения водных растворов амилового спирта (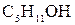 ) от концентрации при
) от концентрации при  С, как показано на рисунок 1.1.
С, как показано на рисунок 1.1.
|
|
|
Таблица 1.1. Значение поверхностного натяжения водных растворов амилового спирта
| Концентрация, моль/л | 0,0019 | 0,0038 | 0,0075 | 0,015 | 0,030 | 0,060 | 0,120 | |
| Поверхностное натяжение, мН/м | 72,0 | 70,4 | 69,2 | 66,7 | 61,7 | 55,3 | 46,6 | 38,0 |
 К полученной кривой (рисунок 1.2) в разных точках, отвечающих взятым концентрациям, постройте касательные до пересечения их с осью ординат. Например, точка а на изотерме соответствует поверхностному натяжению раствора амилового спирта (ПАВ) с концентрацией
К полученной кривой (рисунок 1.2) в разных точках, отвечающих взятым концентрациям, постройте касательные до пересечения их с осью ординат. Например, точка а на изотерме соответствует поверхностному натяжению раствора амилового спирта (ПАВ) с концентрацией 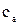 =0,030 моль/л. Через точку а проведите касательную ав и линию, параллельную оси абсцисс аd.
=0,030 моль/л. Через точку а проведите касательную ав и линию, параллельную оси абсцисс аd.
Получаем на оси ординат отрезок bd, который обозначим через 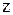 .
.
При графическом решении уравнения Гиббса можно доказать, что  , следовательно, уравнение Гиббса преобразуется к виду
, следовательно, уравнение Гиббса преобразуется к виду  .
.
По этому уравнению рассчитайте адсорбцию для концентраций, приведенных в таблице 1.1.
Результаты расчетов представить в виде таблицы 1.2.
Таблица 1.2. Расчет величины адсорбции
| № п/п | с | 1/с | z | Г | 1/Г |
| 0,002 | |||||
| 0,004 | |||||
| 0,006 | |||||
| 0,008 | |||||
| 0,015 | |||||
| 0,030 | |||||
| 0,060 | |||||
| 0,120 |
По полученным данным постройте изотерму адсорбции 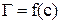 на этом же графике.
на этом же графике.
Вычисление максимальной адсорбции, толщины адсорбционного слоя и площади, занимаемой одной молекулой. Максимальная адсорбция соответствует полному насыщению поверхностного слоя. Мономолекулярная адсорбция на твердой поверхности подчиняется уравнению Ленгмюра
 .
.
Для определения 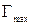 преобразуем уравнение Ленгмюра. Получаем уравнение прямой линии
преобразуем уравнение Ленгмюра. Получаем уравнение прямой линии
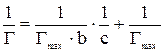 ,
,
не проходящей через начало координат. Для нахождения констант уравнения Ленгмюра построить график в координатах  и
и 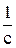 . Отрезок, отсекаемый на оси ординат, равен 1/
. Отрезок, отсекаемый на оси ординат, равен 1/ 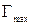 , а угловой коэффициент этой прямой равен
, а угловой коэффициент этой прямой равен  . Данные для построения графика в таблице 2.
. Данные для построения графика в таблице 2.
Площадь  , приходящуюся на одну молекулу, рассчитать по формуле:
, приходящуюся на одну молекулу, рассчитать по формуле:
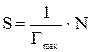 ,
,
где 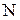 =
= 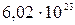 молекул – число Авогадро.
молекул – число Авогадро.
Толщину адсорбционного слоя рассчитать по формуле
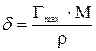 ,
,
где  - молекулярная масса растворенного вещества;
- молекулярная масса растворенного вещества; 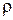 - плотность растворенного вещества (для амилового спирта
- плотность растворенного вещества (для амилового спирта 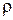 =0,184
=0,184 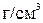 ).
).
Контрольные вопросы
1. В чем проявляется особенность поверхностного слоя на границе раздела фаз? Что такое адсорбция?
2. В каких единицах измеряется адсорбция?
3. По какому уравнению можно рассчитать адсорбцию на границе раздела жидкость – газ?
4. Как определить  , толщину адсорбционного слоя и площадь, занимаемую одной молекулой на границе жидкость – газ?
, толщину адсорбционного слоя и площадь, занимаемую одной молекулой на границе жидкость – газ?
5. Один грамм силикагеля имеет поверхность, равную 465 м2. Сколько молекул брома поглощается 1 см2 поверхности адсорбента при адсорбции на 10 г силикагеля 5 мг брома?
6. Коробка противогаза содержит 40 г активированного угля. Какое весовое количество хлора может быть поглощено противогазом, если 1 г активированного угля адсорбирует 235 мл хлора при нормальных условиях?
7. Охарактеризуйте понятие «поверхностное натяжение», каковы единицы его измерения?
8. Как рассчитать полную поверхностную энергию? Какие данные для этого необходимы?
Лабораторная работа № 2. Адсорбция и десорбция. Избирательная адсорбция.
Цель работы – качественно проследить адсорбцию нескольких слабоокрашенных растворов и возможность обратного процесса – десорбции; избирательность адсорбции. Ознакомление с хроматографическим методом анализа.
Адсорбция. Концентрирование газообразного или растворенного вещества на границе раздела фаз – на поверхности твердого тела или жидкости – называется адсорбцией.
Адсорбция обусловлена наличием адсорбционных сил, имеющих различную природу. Различают межмолекулярные (ванн-дер-ваальсовы) и химические (ионные, ковалентные) силы у атомов и молекул, находящихся на поверхности.
Вещество, способное поглощать (адсорбировать) другое вещество на своей поверхности, называется адсорбентом.
Адсорбируемое вещество называется адсорбтивом.
В некоторых случаях поглощение, начавшееся на поверхности, распространяется в глубь поглотителя и называется абсорбцией.
Если поглощение сопровождается химическим взаимодействием поглощаемого вещества с веществом поглотителем, то такой процесс носит название хемосорбции.
Адсорбция, абсорбция и хемосорбция объединяются общим понятием сорбции.
Процесс адсорбции характеризуется рядом признаков:
- Обратимость. Частицы в адсорбционных слоях не закреплены жестко, они совершают колебательные движения, то приближаясь к поверхности адсорбента, то удаляясь от нее. Некоторые из них могут выходить за пределы действия сил притяжения адсорбента. В таком случае наблюдается обратный процесс – десорбция, то есть отрыв молекул или ионов адсорбционных веществ от поверхности адсорбента и уход их в окружающее пространство.
Со временем система приходит в состояние адсорбционного равновесия:
Адсорбция  Десорбция,
Десорбция,
При котором среднее число частиц, покидающих поверхностный слой, становится равным среднему числу адсорбируемых частиц за тот же отрезок времени.
- Адсорбция носит избирательный характер. Например, активированный уголь хорошо поглощает хлор, но не адсорбирует окись углерода.
- Процесс адсорбции экзотермичен и, следовательно, в соответствии с принципом Ле-Шателье, с ростом температуры адсорбция падает. При этом колебание частиц, адсорбированных поверхностью, увеличиваются, в результате равновесие сдвигается в сторону процесса десорбции.
Адсорбция делится на динамическую и статическую. Адсорбция, проводимая при относительном покое или беспорядочном механическом перемешивании, называется статической. Если адсорбция осуществляется в условиях направленного относительного перемещения фаз, то ее называют динамической. Примером такой адсорбции может служить поглощение токсических веществ из воздушного потока слоем активированного угля в противогазе. На этом основано применение различных методов хроматографии.
Хроматографический анализ – физико-химический метод разделения и анализа многокомпонентных смесей. Этот метод основан на распределении компонентов между двумя фазами – неподвижной (адсорбент) и подвижной (элюент), протекающей через неподвижную.
Существует несколько разновидностей хроматографического метода, различающихся между собой агрегатным состоянием фаз, из которых осуществляется поглощение веществ, аппаратурным оформлением процесса, типами поглотителей.
Хроматографическое разделение с использованием стеклянных или пластмассовых колонок называется колоночной хроматографией. Колонки заполняют поглотителем и пропускают через нее смесь исследуемых веществ. Эта смесь может находиться в газовой фазе (газовая хроматография) или в жидкости (жидкостная хроматография). В качестве поглотителей используют твердые материалы, на поверхности которых специальными методами наносят тонкую пленку жидкости.
Хроматографическое разделение веществ может сопровождаться всеми типами сорбционных процессов: адсорбцией, абсорбцией и хемосорбцией.
Выполнение работы.
Приборы: пробирки, воронки, фильтры, активированный уголь,
Реактивы: разбавленные растворы (0,1%-ный) фуксина, метилового оранжевого, 2% раствор сульфата меди 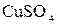 , 2% раствор дихромата калия
, 2% раствор дихромата калия 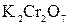 , 2% раствор гидроксида железа
, 2% раствор гидроксида железа 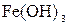 , 1% раствор берлинской лазури, 2% раствор уксуснокислого свинца
, 1% раствор берлинской лазури, 2% раствор уксуснокислого свинца
Опыт № 1. Адсорбция и десорбция.
Выполнение опыта. Для каждой концентрации адсорбата (вещество, которое адсорбируется) при данной температуре существует адсорбционное равновесие
адсорбция 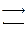 десорбция
десорбция
при котором среднее число частиц, покидающих поверхностный слой, становится равным среднему числу адсорбируемых частиц за тот же отрезок времени.
В пробирки налить по 5 мл сильно разбавленных окрашенных растворов фуксина, метилового оранжевого, сульфата меди, дихромата калия, гидроксида железа, берлинской лазури. В каждую пробирку внести по 1,0 г растертого активированного угля. После взбалтывания в течение 5-10 минут смеси отфильтровать через обыкновенные фильтры. Получим бесцветные фильтраты.
Объясните наблюдаемые явления.
Часть угля с фильтра, через который отфильтровывали смесь угля с фуксином, перенести в пробирку с водой, а другую часть – в пробирку со спиртом и взболтать. Вода в первой пробирке остается бесцветной, во второй – спирт окрасится. Таким образом, фуксин сохранился на поверхности угля, откуда и был извлечен подходящим растворителем, произошла десорбция фуксина.
Опыт № 2. Определение адсорбции различных веществ из растворов углем
Выполнение опыта. В две пробирки налить по 10 мл 2 %-ного раствора уксуснокислого свинца. В первую пробирку добавить раствор дихромата калия. Выпадает объемный осадок 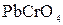 . Во вторую пробирку внести 1,0 г растертого активированного угля, взболтать в течение 3-5 минут, затем отфильтровать в чистую пробирку. В фильтрат добавить раствор дихромата калия. Какие изменения происходят в пробирке?
. Во вторую пробирку внести 1,0 г растертого активированного угля, взболтать в течение 3-5 минут, затем отфильтровать в чистую пробирку. В фильтрат добавить раствор дихромата калия. Какие изменения происходят в пробирке?
Напишите ионное уравнение качественной реакции на ионы свинца ( ) и объясните наблюдаемое явление.
) и объясните наблюдаемое явление.
Опыт № 3. Избирательность адсорбции
Выполнение опыта. Адсорбция носит избирательный характер.
В одну пробирку налить 5 мл слабоокрашенного водного раствора фуксина, в другую такое же количество спиртового раствора фуксина. В обе пробирки внести по 1,0 г активированного угля и взболтать в течение 5 мин. Отфильтровать растворы.
Почему в одном случае адсорбция идет хорошо, а в другом плохо?
Опыт № 4. Хроматографическое разделение солей
Выполнение опыта. В качестве адсорбента используем оксид алюминия. Для проведения опыта возьмем стеклянную колонку. Заполним ее оксидом алюминия слоем около 5 см. В пробирку налить по 1 мл 2% растворов солей меди ( ), железа (
), железа (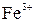 ), кобальта (
), кобальта ( ), полученную смесь пропустить через колонку с оксидом алюминия. Указанные ионы будут избирательно адсорбироваться на поверхности зерен оксида алюминия и распределяться в виде окрашенных слоев по высоте адсорбента. Зная, в какой цвет окрашены соли ионов меди, кобальта и железа, укажите, в каком порядке эти ионы адсорбируются из раствора.
), полученную смесь пропустить через колонку с оксидом алюминия. Указанные ионы будут избирательно адсорбироваться на поверхности зерен оксида алюминия и распределяться в виде окрашенных слоев по высоте адсорбента. Зная, в какой цвет окрашены соли ионов меди, кобальта и железа, укажите, в каком порядке эти ионы адсорбируются из раствора.
Контрольные вопросы
1. Опишите процесс адсорбции.
2. В чем разница между абсолютной и избыточной адсорбцией?
3.Что такое десорбция?
4. Одинаковые объемы 1 М и 0,1 М растворов уксусной кислоты взбалтывались с одинаковыми навесками активированного угля. Одинаковые ли количества уксусной кислоты адсорбировались из обоих растворов?
Лабораторная работа № 3. Получение и свойства коллоидных систем.
Цель работы: Ознакомление с методами конденсации и пептизации. На примере иодида калия и нитрата серебра проследить процесс взаимной коагуляцией.
Коллоидный раствор (золь) состоит из дисперсной фазы и дисперсионной среды. Дисперсная фаза образована коллоидными частицами, называемыми мицеллами.
Мицелла имеет сложное строение. В основе ее лежит нерастворимое в данной дисперсионной среде ядро. Обычно ядро - это микрокристалл или агрегат из микрокристаллов. Поверхность ядра за счет свободной межфазной энергии адсорбирует из окружающей среды ионы в соответствии с правилом Фаянса: на поверхности твердого вещества предпочтительно адсорбируются ионы, способные достраивать его кристаллическую решетку или образующие с ионами, входящими в состав кристаллической решетки, наиболее трудно растворимые соединения. Эти ионы называются потенциалобразующими, так как сообщают частице определенный заряд. При адсорбции ионов снижается межфазная свободная энергия, что приводит систему в устойчивое состояние.
Строение коллоидной частицы имеет следующий вид

Ядром мицеллы является кремневая кислота 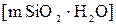 . На твердой поверхности ядра будут адсорбироваться родственные ионы
. На твердой поверхности ядра будут адсорбироваться родственные ионы 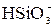 , которые внедряются в кристаллическую решетку ядра и придают поверхности отрицательный заряд и сообщает коллоидной частице отрицательный заряд. Отрицательно заряженная частица будет притягивать к себе противоположно заряженные частицы, протоны водорода, которые являются противоионами. Противоионы испытывают на себе две силы: электростатическую, притягивающую их к ядру коллоидной частицы, и диффузионную, стремящуюся рассеять их по раствору. В результате совместного действия указанных сил состояние отдельных протонов водорода. Часть из них прочно связана с ядром коллоидной частицы, образуя на нем плотный адсорбционный слой (n-х). Другая часть образует диффузионный слой х - ионную атмосферу частицы.
, которые внедряются в кристаллическую решетку ядра и придают поверхности отрицательный заряд и сообщает коллоидной частице отрицательный заряд. Отрицательно заряженная частица будет притягивать к себе противоположно заряженные частицы, протоны водорода, которые являются противоионами. Противоионы испытывают на себе две силы: электростатическую, притягивающую их к ядру коллоидной частицы, и диффузионную, стремящуюся рассеять их по раствору. В результате совместного действия указанных сил состояние отдельных протонов водорода. Часть из них прочно связана с ядром коллоидной частицы, образуя на нем плотный адсорбционный слой (n-х). Другая часть образует диффузионный слой х - ионную атмосферу частицы.
Совокупность диффузионного и адсорбционного слоев представляет собой двойной электрический слой.
Ионы диффузионного слоя непрерывно обмениваются с одноименными ионами адсорбционного слоя, поэтому их называют обменными.
Ядро с адсорбционным слоем образуют гранулу, а система, состоящая из гранулы и диффузного слоя, называется мицеллой (рисунок 3.3).

В плотном слое потенциалы твердой частицы и жидкости скомпенсированы, а при диффузном строении слоя, которое имеет место жидкости, потенциал твердой частицы компенсируется частично, так как около нее удерживается неподвижным слоем жидкости только часть противоионов.
На границе подвижного и неподвижного слоев возникает разность  – потенциалов, которую называют электрокинетическим потенциалом или дзета-потенциал. Следовательно, электрокинетический потенциал, есть разность потенциалов на границе неподвижного слоя жидкости и подвижного диффузионного.
– потенциалов, которую называют электрокинетическим потенциалом или дзета-потенциал. Следовательно, электрокинетический потенциал, есть разность потенциалов на границе неподвижного слоя жидкости и подвижного диффузионного.
Коллоидные системы обладают различной устойчивостью, одни из них существуют доли минуты, другие сохраняют устойчивость годами. По своей природе коллоидные системы агрегативно неустойчивы. При потере агрегативной устойчивости происходит коагуляция. Коагуляция - нарушение агрегативной устойчивости коллоидной системы в сторону укрупнения частицза счет их слипания под влиянием молекулярных сил притяжения.
Коагуляция приводит к потере кинетической устойчивости, то есть неспособности укрупнившихся коллоидных частиц равномерно распределяться по всему объему.
Факторы, вызывающие коагуляцию, могут быть самыми разнообразными: изменение температуры, механическое воздействие, облучение, добавление электролитов и другого золя, частицы которого имеют противоположный заряд.
Под действием электролита различают две стадии коагуляции: скрытую и явную. Начальная стадия процесса коагуляции протекает незаметно для вооруженного глаза и называется скрытой коагуляцией. Увеличение концентрации электролита ведет к дальнейшему развитию коагуляции, повышение ее скорости и сопровождается образованием более крупных частиц. При этом золь мутнеет. Эта стадия процесса называется явной коагуляцией.
То наименьшее количество электролита, которое вызывает начало явной коагуляции, определяет порог коагуляции. У золей порог коагуляции обычно невелик и выражается в долях миллимолей электролита на литр золя
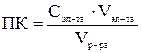 , ммоль/л
, ммоль/л
При коагуляции электролитов существует ряд общих правил.
- Коагулирующим действием обладает не весь электролит, а только тот ион, который имеет заряд, противоположный заряду коллоидной частицы. Например, на отрицательно заряженные частицы золя кремневой кислоты, коагулирующие действие оказывают катионы.
- Коагулирующая способность иона тем больше, чем выше его заряд, тем сильнее выражена его коагулирующая способность и тем ниже порог коагуляции (правило Шульце - Гарди).
Значение порогов коагуляции для одно-, двух-, трех-, четырехвалентных ионов относятся как 1 (1/2)6: (1/3)6: (1/4)6 или 1:0,016:0,0013:0,00024. Но порог коагуляции является относительной характеристикой устойчивости золя по отношению к данному электролиту, так как он зависит от:
природы коагулируемого золя;
природы иона коагулятора;
концентрации золя.
- Для ионов с одинаковым зарядом коагулирующая способность возрастает с увеличением радиуса иона. По коагулирующей способности катионы щелочных металлов можно расположить в следующий лиотропный ряд:

Различие в действии этих ионов объясняется их гидратационной способностью.
Коагуляцию можно наблюдать и в том случае, если к одному золю добавить другой золь с противоположным зарядом (взаимная коагуляция). Взаимную коагуляцию можно наблюдать и в грунтах. Частицы песка и глины, а также все глинистые минералы, входящие в состав грунтов имеют мицеллярное строение.
Растворы солей, образованные слабыми основаниями и сильными кислотами, подвергаются гидролизу и образуют коллоидный раствор с положительно заряженной гранулой. Гранула частиц грунта имеет отрицательный заряд. При попадании таких растворов в грунт, происходит взаимная коагуляции. Рассмотрим пример.
Грунт имеет следующее строение гранулы
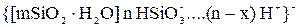
В растворе сульфата алюминия гранула имеет строение
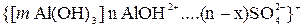 .
.
Вследствие взаимной коагуляции происходит оседание частиц грунта совместно с осадком гидроксида алюминия.

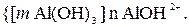
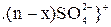
Выполнение работы.
Опыт № 1. Получение золя фенолфталеина методом замены растворителя.
Приборы: пробирки
Реактивы: 2% спиртовый раствор фенолфталеина, дистиллированная вода
Выполнение опыта. В пробирку налить 10 мл воды и добавить по каплям 2% спиртовый раствор фенолфталеина. Полученный раствор энергично перемешать. Образуется опалесцирующий золь. Объяснить, что происходит при образовании золя.
|
|
|


