 |
Лабораторная работа «Физические свойства и химический состав подземных вод»
|
|
|
|
СОДЕРЖАНИЕ
Стр.
| Введение | |
| 1 Основы гидрогеологии | |
| 1.1 Лабораторная работа «Состав и свойства подземных вод» | |
| 1.2 Лабораторная работа «Построение карт гидроизогипс. Определение направления фильтрационного потока» | |
| 1.3 Лабораторная работа «Определение параметров водоносных горизонтов по данным откачек из скважин. Расчеты водопритоков к скважинам и горным выработкам» | |
| 2 Основы инженерной геологии | |
| 2.1 Лабораторная работа «Определение водных свойств грунтов» | |
| 2.2 Лабораторная работа «Вычисление классификационных показателей грунтов» | |
| 3 Инженерно-геологическая карта. Построение инженерно-геологических разрезов. Оценка инженерно-геологических условий территории | |
| 3.1 Лабораторная работа «Построение геологической колонки буровой скважины» | |
| 3.2 Лабораторная работа «Построение инженерно-геологического разреза по данным буровых скважин» | |
| Список литературы | |
| Приложение А | |
| Приложение Б | |
| Приложение В | |
| Приложение Г | |
| Приложение Д |
ВВЕДЕНИЕ
Лабораторные занятия по курсу «Гидрогеология и инженерная геология» представляют собой весьма важную и сложную часть этого курса. Они имеют своей задачей ознакомить студентов специальности 050706 – «Геология и разведка месторождений полезных ископаемых» с условиями формирования химического состава подземных вод, основами расчетов, определяющих движение подземных вод в естественных условиях и при откачках воды из скважин. В методических указаниях изложены сведения об инженерно-геологических и гидрогеологических картах и разрезах. Даны основные приемы гидрогеологической и инженерно-геологической оценки территорий месторождений полезных ископаемых.
|
|
|
ОСНОВЫ ГИДРОГЕОЛОГИИ
Лабораторная работа «Физические свойства и химический состав подземных вод»
1.1.1 Теоретическая часть
Свойства и химический состав подземных вод
Вода представляет собой химическое соединение водорода (11,11%) и кислорода (88,89%). Показателями физического состояния и свойств подземных вод служат: температура, прозрачность, цвет, запах, вкус, плотность, сжимаемость, вязкость, электропроводность, радиоактивность.
Состав подземных вод отражает историю геологического развития Земли, условия взаимодействия их с горными породами, органическим веществом, микроорганизмами газами, характер и интенсивность антропогенных воздействий на геологическую среду.
В природных водах в той или иной степени рассеяния присутствует более 60 из известных устойчивых элементов периодической системы Д.И. Менделеева. В состав подземных вод входят: ионы, недиссоциированные молекулы, коллоиды, органические вещества и микроорганизмы, нерастворенные взвешенные частицы, газы.
Среди ионов различают: макрокомпоненты, включающие элементы и комплексные соединения, составляющие основу подземных вод; микрокомпоненты, включающие элементы или соединения в количестве менее 10, редко 100 мг/л; ультрамикрокомпоненты (Rb, Au, Hg), содержание которых редко превышает 0,1 мг/л.
Макрокомпоненты (О, Ca, Mg, Na, K, Cl, S) составляют основную часть минерального состава природных вод. В пресных водах содержится свыше 90-95% макрокомпонентов, в высокоминерализованных более 99%. Микрокомпоненты (Li, B, F, Ti, V, Cr, Mn, Co, Ni, Cu, Zn, Ba) не определяют химический тип воды, однако оказывают значительное влияние на специфические особенности их состава.
Типизация и классификация подземных вод по химическому составу производится по макрокомпонентам. В одной из классификаций (О.А. Алехина) подземные воды разделены на классы, группы и типы в зависимости от преобладающих ионов и соотношений между главными ионами (Приложение В).
|
|
|
Воды первого типа – маломинерализованные, второго – мало- и среднеминерализованные (подземные воды, воды рек и озер), третьего типа – сильноминерализованные (воды океанов, морей, реликтовые воды), четвертого типа – кислые.
Из недиссоциированных соединений в подземных водах распространены SIO2, Fe2 O3, Al2O3, из газов – O2, H2S, CO2, H2, CH4 и тяжелые углеводороды (этан, пропан, бутан).
Для выявления химического состава выполняют химические анализы подземных вод (полевые, сокращенные, полные и специальные). Выбор типа анализа определяется целевым назначением и требуемой точностью определений.
Сумма минеральных веществ, выделенных из воды при помощи химических анализов, определяет ее химическую минерализацию. Величину минерализации оценивают по сухому остатку, получаемому путем выпаривания и высушивания пробы воды или по сумме ионов, определенных химическим анализом. Общая минерализация подземных вод изменяется от нескольких десятков мг на литр до 650 г/л.
Содержание компонентов выражается в миллиграммах на литр и процентах, содержание обменного комплекса и жесткость воды - в миллиграмм-эквивалентахна литр. Принимая эквивалентное содержание суммы катионов и анионов за 100%, можно найти процентное содержание каждого иона.
При сопоставлении целого ряда анализов, выяснении генезиса вод удобно выражать анализы в виде предложенного Н.И. Толстихиным графика–квадрата, иногда комбинированного с треугольником Ферре (Приложение Г).
В практике производственных лабораторий для обозначения единичных химических анализов широко используются формулы М.Г. Курлова, И.Ю. Соколова.
Формула Курлова записывается в виде псевдодроби:
А; М 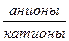 рH; Т; Q,
рH; Т; Q,
где А - специфический элемент, содержащийся в воде, мг/л; М - общая минерализация, г/л; Т - температура воды, оС; Q - расход источника (дебит скважины), м3/сут.
Анионы и катионы выражают в процентах в убывающем порядке их содержания; ионы с содержанием менее 10 в формуле не учитываются.
Оценка качества воды для питьевых целей производится по ГОСТ 2874-82, определяющим пределы допустимых концентраций (ПДК) тех или иных компонентов в воде. В качестве предельно допустимой, принимается концентрация отдельных компонентов, которая полностью исключает вредное воздействие на организм человека.
|
|
|
Органические примеси установливаются по окисляемости - количество кислорода или марганциево-кислого калия, расходуемого на окисление этих примесей. В питьевой воде окисленность должна быть не более 10 мг/л.
О концентрации микроорганизмов судят по результатам анализов, определяющих количество бактерий в данном объеме жидкости. Общее количество бактерий в 1 см3 воды не должно превышать 100. Наиболее важный показатель бактериальной чистоты воды - коли-титр - количество воды, содержащее одну кишечную палочку.Для водоснабжения пригодна вода с коли-титром 300.
Жесткость воды
Жесткостью оценивается возможность использования воды для хозяйственно-питьевых целей. Она зависит от присутствия Ca2+ и Mg2+. Различают общую жесткость, связанную с содержанием в воде всех солей кальция и магния; карбонатную (временную), связанную с наличием бикарбонатов кальция и магния; постоянную, остающуюся после удаления бикарбонатов. Жесткость воды оценивают в мг экв/л Ca и Mg. 1 мг экв/л соответствует содержанию 20,04 мг/л Ca или 12,16 мг/ л Mg. Жесткость природных вод изменяется от нескольких до десятков сотен мг экв/л.
Щелочность воды
Наличие в воде гидратов натрия, карбонатов и бикарбонатов натрия определяет ее щелочность. Различают гидратную, карбонатную, бикарбонатную, фосфатную и силикатную щелочности.
Концентрация иона водорода (pH воды)
Концентрацией водородных ионов оценивается степень кислотности воды. При нейтральной реакции воды рН = 7, при кислой - меньше 7, при щелочной - больше 7. Для выражения концентрации водородных ионов принято пользоваться логарифмом концентрации их (т.е количества грамм эквивалентов этого иона в 1 л воды), взятым с обратным знаком:
pН= - lg(Н+)
Оценка агрессивных свойств воды
Агрессивной является вода, содержащая сверх допустимого количества сульфаты и агрессивную углекислоту. Разрушающее действие вода может оказывать на бетон в виде: кристаллизации в бетоне новых соединений с увеличением его объема или выщелачивания из бетона его составных частей, растворимых в воде. И то и другое приводит к разрушению бетона.
|
|
|
Сульфатная агрессия наблюдается при наличии в воде сульфатов SО42- свыше 250 мг/л и одновременном содержании иона Cl- свыше 1000 мг/л. При этом в бетоне образуется гипс с увеличением объема в 2-3 раза и сульфат-алюминат кальция – бетонная бацилла с увеличением объема в 2,5 раза.
При углекислой агрессии происходит растворение и выщелачивание извести CaSO4, составляющей основу цемента.
Агрессивность выщелачивания – агрессия по временной (бикарбонатной) жесткости. Если содержание щелочи меньше 1,5 мг экв/л, происходит растворение и вымыв из бетона извести.
Общекислотная агрессия обусловлена низкими значениями водородного показателя рН (менее 7 при временной жесткости менее 8,6 мг экв/л и менее 6-7 при временной жесткости более 8,6 мг экв/л), вызывающее усиленное растворение извести.
Магнезиальная агрессия приводит к разрушению бетона при проникновении в него воды с содержанием Mg +2,более 1000 мг экв/л.
1.1.2 Задания для лабораторных работ
Задание 1
Химическим анализом установлена приведенная концентрация водородных ионов. Определите рН и наименование воды по его значению в соответствии с вариантом таблицы 1.
Таблица 1 - Исходные данные к заданию 1
| № варианта | ||||||||||
| Концентрация водородных ионов, г-моль/л | 10-5 | 10-6 | 10-8 | 10-10 | 10-3 | 10-2 | 10-3 | 10-6 | 10-9 | 10-8 |
| 10-7 | 10-9 | 10-4 | 10-5 | 10-6 | 10-7 | 10-9 | 10-5 | 10-4 | 10-2 | 10-9 |
Пример решения задачи для варианта № 0
Дано:
Н+ = 10-5 г-моль/л
 Найти: рН, наименование воды
Найти: рН, наименование воды
Решение:
Для выражения концентрации водородных ионов принято пользоваться логарифмом концентрации их, взятым с обратным знаком pН= - lg (Н+), следовательно pН= - lg (10-5) = 5.
Для ответа используйте классификацию воды по значению водородного показателя (приложение А).
Вывод: по величине pH - вода кислая.
Задание 2
Используя результаты химического анализа подземной воды, приведенные в таблице 2, определите ее класс, группу и тип по классификации О.А. Алекина и номер воды по графику-квадрату Н.И. Толстихина.
Таблица 2 - Исходные данные к заданию 2
| № варианта | Содержание ионов, мг экв/л | |||||
| HCO3- | SO42- | Cl- | Na+ | Ca2+ | Mg2+ | |
| 5,79 | 2,62 | 4,74 | 10,74 | 0,40 | 2,14 | |
| 5,00 | 1,56 | 1,64 | 5,22 | 2,46 | 0,46 | |
| 6,32 | 10,42 | 1,86 | 3,67 | 12,29 | 2,60 | |
| 2,31 | 3,67 | 5,14 | 2,42 | 6,07 | 2,63 | |
| 2,87 | 0,12 | 0,39 | 0,26 | 2,30 | 0,82 | |
| 2,45 | 4,11 | 0,54 | 5,62 | 3,21 | 0,68 | |
| - | 3,43 | 60,69 | 52,94 | 1,23 | 5,10 | |
| 5,79 | 2,45 | 1,65 | 3,21 | 2,13 | 3,422 | |
| 2,62 | 6,51 | 6,24 | 2,13 | 4,12 | 3,54 | |
| 4,74 | 4,32 | 2,34 | 1.24 | 2,56 | 2,45 | |
| 15,25 | 4,32 | 3,12 | 5,22 | 0,87 | 0,98 | |
| 2,30 | 2,34 | 3,12 | 3,72 | 1,28 | 0,76 | |
| 2,86 | 5,24 | 0,96 | 2,34 | 2,69 | 1,25 | |
| - | 4,12 | 60,68 | 51,23 | 5,43 | 4,91 | |
| 6,33 | 1,26 | 1,23 | 0,34 | 5,23 | 2,13 | |
| 2,56 | 2,34 | 3,24 | 5,34 | 4,90 | 2,14 | |
| 5,46 | 3,42 | 6,45 | 3,56 | 5,01 | 1,24 | |
| 4,78 | 1,32 | 2,34 | 5,12 | 4,32 | 5,12 | |
| 3,65 | 1,53 | 5,43 | 3,21 | 1,09 | 2,34 | |
| 7,65 | 2,31 | 6,12 | 4,21 | 1,34 | 1,80 | |
| 2,55 | 3,12 | 2,67 | 1,23 | 2,09 | 1,09 |
Пример решения задачи для варианта № 0
|
|
|
Дано:
HCO3- = 5,79 мг экв/л;
SO42- = 2,62 мг экв/л;
Cl- = 4,74 мг экв/л;
Na+= 10,74 мг экв/л;
Ca2+ = 0,40 мг экв/л;
Mg2+ = 2,14 мг экв/л;
 Найти: наименование воды по классификации О.А. Алекина и номер воды по графику-квадрату Н.И. Толстихина
Найти: наименование воды по классификации О.А. Алекина и номер воды по графику-квадрату Н.И. Толстихина
Решение:
Выразите химический состав воды в % экв. Сумма катионов и анионов каждая в отдельности принимается равной 100%. Далее рассчитывается % экв каждого аниона и катиона.
Сумма анионов-13,15 мг экв/л – 100%, 5,79 мг экв/л HCO3- равен 5,79 ´ 100% и разделить на 13,15. Равно 44%. Данные заносят в таблицу 3.
Таблица 3 – Химический состав подземных вод
| Анионы | Содержание | Катионы | Содержание | ||||
| мг/л | мг-экв/л | %-экв | мг/л | мг-экв/л | %-экв | ||
| HCO3- | 5,79 | Na+ | 10,74 | ||||
| SO42- | 2,62 | Ca2+ | 0,40 | ||||
| Cl- | 4,74 | Mg2+ | 2,14 | ||||
| итого | 13,15 | итого | 13,28 |
Затем по приложениям В, Г определите наименование и номер.
Вывод: по классификации О.А. Алекина вода относится к классу - гидрокарбонатной, группе – натриевой, I типа (HCO3-> Ca2+ + Mg2+). По Н.И. Толстихину № 58.
Задание 3
Запишите приведенные ниже в таблице 4 результаты химического анализа подземной воды в виде формулы М.Г. Курлова. Определите вид жесткости и дайте наименование воды с учетом информации, полученной в результате химического анализа.
Таблица 4 - Исходные данные к заданию 3
| № варианта | Сухой остаток | рН | Температура, оС | Содержание ионов, мг/л | |||||
| HCO3- | SO42- | Cl- | Na+ | Ca2+ | Mg2+ | ||||
| 7,3 | |||||||||
| 8,3 | |||||||||
| 7,6 | |||||||||
| 8,4 | - | ||||||||
| 7,9 | |||||||||
| 7,0 | |||||||||
| 6,6 | |||||||||
| 3,1 | - | ||||||||
| 2,3 | |||||||||
| 4,5 | |||||||||
| 6,4 | |||||||||
| 7,5 | |||||||||
| 8,6 | |||||||||
| 9,7 | |||||||||
| 8,5 | |||||||||
| 7,6 | |||||||||
| 8,5 | - | ||||||||
| 4,5 | |||||||||
| 3,7 | |||||||||
| 8,4 | |||||||||
| 4,6 |
Пример решения задачи для варианта № 0
Дано:
М = 1000 мг/л;
рН = 7,3;
Т = 12 оС;
HCO3- = 930 мг/л;
SO42- = 76 мг/л;
Cl- = 24 мг/л;
Na+= 81,09 мг/л;
Ca2+ = 194 мг/л;
Mg2+ = 45 мг/л;
 Найти: вид жесткости, написать формулу Курлова, наименование воды
Найти: вид жесткости, написать формулу Курлова, наименование воды
Решение:
Теоретические суммы анионов и катионов, выраженные в мг-экв форме должны быть равны, поэтому для решения задачи необходимо пересчитать данные анализа из мг/л в мг-экв/л, используя пересчетные коэффициенты (приложение Б). Результаты вычислений записывают в таблицу 5 и суммируют содержание катионов и анионов. Далее выражают химический состав воды в % -экв форме.
Таблица 5 – Химический состав подземных вод
| Анионы | Содержание | Катионы | Содержание | ||||
| мг/л | мг-экв/л | %-экв | мг/л | мг-экв/л | %-экв | ||
| HCO3- | 15,25 | Na+ | 4,05 | ||||
| SO42- | 1,58 | Ca2+ | 9,68 | ||||
| Cl- | 0,68 | Mg2+ | 3,70 | ||||
| итого | 17,51 | итого | 17,43 |
Формула М.Г. Курлова представляет собой дробь (ложную), в числителе которой записывают анионный состав воды (в %-экв) в убывающем порядке, а в знаменателе- катионный. Запись ионов с содержанием менее 10 %-экв не производится. Перед дробью записывают содержание газов и специфических элементов, если они имеются в воде и общую минерализацию М в г/л, после дроби указывают температуру воды и дебит источника или скважины. Название воды записывают через черточку: сначала анионный, затем катионный составы.
В данном случае формула имеет вид:
М1,0  t º12, pH 7,3
t º12, pH 7,3
Общую жесткость определяют как сумму катионов кальция и магния, выраженных в мг-экв/л: 9,68+3,70=13,38 мг-экв/л. По этому показателю вода классифицируется как очень жесткая (приложение А).
Учитывая общую минерализацию, химический состав, содержание ионов водорода (рН), температуру и вычисленную жесткость, окончательно дают воде наименование по приложению А.
Вывод: вода пресная, гидрокарбонатная кальциево-натриево-магниевая, холодная, щелочная, очень жесткая.
|
|
|


