 |
Структура молекул флокулянтов и их состояние в водном растворе
|
|
|
|
Высокомолекулярные флокулянты могут иметь молекулы с линейной и с разветвленной структурой. Условно, по структуре молекул, флокулянты разделяют на несколько типов:

Рис.1. Структура молекул флокулянтов:
А - линейная;
Б - разветвленная с небольшими ответвлениями;
В - разветвленная с большими ответвлениями;
Г - хаотичная;
Д - звездообразная.
Длина полимерной молекулы флокулянта может составлять 75...11000 нм.
В растворе молекулы флокулянта находятся в виде свернутых клубков, которые могут разворачиваться вплоть до линейной формы.
Большинство флокулянтов имеют линейную структуру макромолекул. Разветвленные структуры характерны для активной кремниевой кислоты, амилопектина и некоторых синтетических флокулянтов – полиэтиленимина и замещенных возле азота полиакриламидов.
Молекулы флокулянтов довольно гибкие и находятся в воде, обычно, в виде молекулярных клубков.
Размеры и форму (конформацию) макромолекул полимера определяет:
- химическая структура полимера,
- его молекулярная масса,
- наличие в цепи тех или других полярных групп,
- содержание в воде низковалентных катионов и анионов, а также
- расстояние между макромолекулами и их взаимной ориентации.
Вследствие движения и вращения отдельных звеньев форма и размеры макромолекул беспрерывно изменяются, поэтому можно говорить только про наиболее вероятную статистическую характеристику.

Рис.2. Форма макромолекулы флокулянта:
h - расстояние между конечными атомами;
Н и D - габаритные размеры макромолекул.
Размер и форму макромолекул характеризуют следующие параметры:
1. среднестатистическое расстояние между концами молекулярной цепочки h,
|
|
|
2. гибкость, равную отношению h к молекулярной массе M,

где  - расстояние между конечными атомами в молекуле,
- расстояние между конечными атомами в молекуле,  - молекулярная масса молекулы.
- молекулярная масса молекулы.
3. среднестатистический радиус, то есть расстояние атомов до центра массы молекулы.
В общем случае о состоянии макромолекулы в растворе можно судить по расстоянию между конечными атомами (h) в молекуле, гибкости молекулы и по коэффициенту асимметрии молекулы, который определяется соотношением:
 ,
,
где 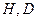 - габаритные размеры клубка, который образует макромолекулу,
- габаритные размеры клубка, который образует макромолекулу,
Форма полимерных макромолекул в растворе зависит от многих факторов, таких как:
- структура,
- наличие ионных групп в полимере,
- ионного состава раствора,
- реакции среды и т.п.
Как правило, при снижении концентрации флокулянта заряженные участки молекулы, которые имеют одинаковый по знаку заряд, отталкиваются между собой, что приводит к развертыванию молекулы и приближению ее к линейной структуре. Этот эффект усиливается с повышением степени ионизации ионогенных групп. В особенности это характерно для катионных или анионных флокулянтов.
Повышение степени диссоциации ионогенных групп происходит при снижении концентрации раствора и с уменьшением количества ионогенных групп в полимерной молекуле. Как правило, в полимерных молекулах, которые содержат большое количество ионогенных групп, полная диссоциация этих групп не достигается практически никогда. Это связано с тем, что вокруг ионов, которые получаются в молекуле, находятся противоионы, которые компенсируют их заряд. Противоионы в данном случае образуют структуры подобно лиофобным коллоидным частицам. Именно благодаря большой плотности противоионов вблизи полимерных молекул замедляются процессы диссоциации ионогенных групп.
Полиакриловая кислота:

Диссоциация анионного полимера:

Диссоциация катионного полимера:

При повышении концентрации индифферентного электролита процесс диссоциации замедляется т.к. увеличивается концентрация противоионов, а снижение степени диссоциации функциональных групп сопровождается сворачиванием молекулы и уменьшением ее линейных размеров.
|
|
|
(Электролит может быть индифферентным или чужеродным, то есть не содержащим ионов, подобных ионам твердой фазы, а также неиндифферентным или родственным, способным достраивать кристаллическую решетку твердой фазы.)
На форму катионных и анионных флокулянтов влияет реакция среды.
При увеличении рн анионные флокулянты разворачиваются, то есть линейные размеры увеличиваются, что связано с повышением степени диссоциации анионных групп.

При повышении рн катионные флокулянты сворачиваются, поскольку уменьшается степень диссоциации ионогенных групп.
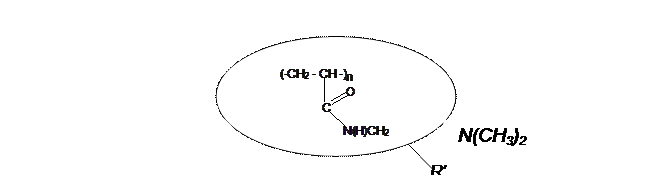


Н
При снижении рн, наоборот, молекулы анионных флокулянтов сворачиваются в клубки, уменьшая свои линейные размеры:
 - анионный флокулянт
- анионный флокулянт
а катионные флокулянты переходят в ионную форму, увеличивая свои линейные размеры.
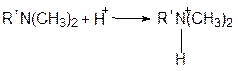 - катионный флокулянт
- катионный флокулянт
При повышении концентраций флокулянтов в воде они образуют пространственные гелеобразные структуры в виде фибрилл или глобул.
Фибрилы - пакеты линейных молекул, которые образовывают ассоциаты в воде. Глобулы - клубки из нескольких макромолекул.
Механизм флокуляции
Флокуляция – это процесс укрупнения коллоидных и взвешенных примесей при использовании флокулянтов.
Считается, что этот процесс в основном проходит по мостиковому механизму.
Согласно с этим механизмом, процесс укрупнения происходит за счет адсорбции отдельных сегментов флокулянта на взвешенных частичках. При этом, сорбируясь отдельными фрагментами на различных частичках, молекула флокулянта связывает несколько (не менее двух) взвешенных частичек.
Процесс фиксации сегментов макромолекулы на взвешенных частичках происходит за счет:
адсорбции,
действия сил межмолекулярного притяжения (Ван-дер-Ваальса) или за счет
электростатического притяжения и
ионного обмена.
Электростатическое притяжение имеет место, когда катионные флокулянты взаимодействуют с частичками с отрицательным значением электрокинетического потенциала или, наоборот, когда анионные флокулянты взаимодействуют с положительно заряженными частичками.
|
|
|
Механизм ионного обмена реализуется, когда флокулянт, который является полиэлектролитом (катионный или анионный) вступает в реакции ионного обмена со взвешенными частичками. Процесс флокуляции за счет ионного обмена характеризуется высокой скоростью агрегации частичек и флокулянта (процесс практически завершается при смешивании реагентов с водой).
Как правило, процесс флокуляции происходит последовательно. Сначала молекула флокулянта сорбируется на 1 частичке (первичная адсорбция), затем свободные сегменты закрепляются на поверхности других частиц, связывая их полимерными мостиками (вторичная адсорбция).
Возможны различные механизмы закрепления макромолекул флокулянтов на поверхности частиц. Неионогенные полиэлектролиты закрепляются на частицах с помощью полярных групп (чаще всего гидроксильных) благодаря образованию водородных связей между водородом гидроксила и кислородом, азотом и другими атомами, находящимися на поверхности частиц. Наличие водородных связей установлено экспериментально с помощью инфракрасной спектроскопии. Хотя энергия водородной связи значительно меньше энергии химической связи, большое количество гидроксильных групп способствует прочному закреплению молекул флокулянта.
Анионные флокулянты способны закрепляться на поверхности частиц не только с помощью водородных связей, но и благодаря химическому взаимодействию (хемосорбции) анионов с катионами, находящимися на поверхности частиц.
Катионные полиэлектролиты, помимо образования агрегатов по механизмам, аналогичным вышеизложенным, способствуют флокуляции благодаря нейтрализации отрицательного заряда частиц.
На эффективность взаимодействия флокулянта и взвешенных частичек значительно влияет величина поверхностного заряда и наличие ионогенных групп в молекуле флокулянта.
Кроме мостикового механизма флокуляции, при использовании флокулянтов может быть реализован и другой механизм. Например, уменьшение величины поверхностного заряда взвешенных частичек при адсорбции на их поверхности флокулянтов, за счет противоположного заряда потенциал определяющих ионов флокулянтов.
|
|
|
Известно, что противоионы лучше сорбируются с увеличением величины их заряда, а флокулянт можно рассматривать как полизарядный ион, поэтому он будет достаточно эффективно взаимодействовать с заряженными коллоидными частичками. Не обязательно, чтобы в процессе флокуляции молекулы флокулянта покрывали всю поверхность частички, иногда достаточно 40–60% площади поверхности частички. Данный процесс имеет очень важное значение при обезвоживании гидрофильных осадков, влажность которых достигает 99 и более %.
При введении флокулянта с дозой 1г/кг сухого вещества осадка, происходит эффективная агрегация частичек твердой фазы осадка с легким отделением воды. В основном, эффект отделения от воды достигается за счет того, что флокулянт лучше, по сравнению с водой, адсорбируется на поверхности частичек и при их адсорбции разрушаются кластерные структуры воды в гидратной оболочке. Именно благодаря такому эффекту процесс обезвоживания реализуется при очень низких концентрациях флокулянта (от 100 мг до 1 г/кг сухого вещества осадка).
Доза флокулянта в значительной мере влияет на эффективность процесса флокуляции. При оптимальных дозах процесс происходит максимально быстро. При недостаточной концентрации флокулянта процесс не заканчивается и очистка недостаточная. А при избытке флокулянта эффект очистки может быть не достигнут, так как происходит перезарядка поверхности частичек на противоположный знак или за счет образования пространственных сеток из флокулянтов в растворе, которые будут препятствовать сближению и агрегации частичек.
На практике водоочистки флокуляцию применяют вместе с коагуляцией в случае, когда необходимо достичь гидрофобизации частичек осадка. Кроме того, флокулянты используются индивидуально или в композициях с другими флокулянтами, в зависимости от характеристики взвешенных частичек.
В современных процессах водоочистки флокулянты широко применяют в процессах обезвоживания осадков, которые образуются при очистке воды. В данных процессах наилучшими являются флокулянты на основе полиакриламидов.
Исходя из рассмотренного механизма флокуляции можно сказать, что эффективность флокуляции будет увеличиваться с увеличением линейных размеров молекулы флокулянта, что достигается за счет возрастания степени полимеризации и молекулярной массы, а также за счет разворачивания молекул в растворах. Этому способствуют ионогенные фрагменты (группы) в макромолекуле флокулянта.
|
|
|
Наибольшей молекулярной массой характеризуются флокулянты на основе полиакриламида (молекулярная масса достигает 30 млн. углеродных единиц). Вследствие высокой молекулярной массы флокулянтов их растворимость в воде достаточно ограничена, поэтому рабочие растворы имеют концентрацию = 0,05 – 0,5%. При использовании флокулянтов с большой молекулярной массой не допускается их дозирование перед насосами, так как при прохождении через насос, вследствие кавитационных явлений, происходит разрушение молекул и уменьшается эффективность флокуляции.
***Кавитация (от лат. cavitas — пустота), образование в капельной жидкости полостей, заполненных газом, паром или их смесью (так называемых кавитационных пузырьков, или каверн).
 Технологическая схема реагентного умягчения воды
Технологическая схема реагентного умягчения воды
1 - растворный бак извести;
2 - расходный бак извести;
3 - растворный бак коагулянта;
4 - расходный бак коагулянта;
5 - расходный бак флокулянта;
6 - осветлитель со взвешенным слоем осадка;
7 - резервуар известковой осветленной воды;
8, 11 - насосы;
9 - насыпные механические фильтры;
10 - резервуар умягченной очищенной воды;
12 - отстойник-накопитель промывных вод;
13 - шламохранилище;
14 - фильтр-пресс для обезвоживания осадка;
15 - подача воды на разведение реагентов;
16 - подача извести;
17 - подача коагулянта;
18 - подача флокулянта;
19 - подача природной воды на умягчение;
20 - подача воды на промывку;
21 - транспортирование обезвоженного шлама на захоронение;
22 - сброс фильтрата в канализацию; 23 - подача воды к потребителю.
Эта технология основана на преобразовании растворимых соединений Са и Мg в нерастворимое состояние и удалении их из воды. В основном соединения Са и Мg в природной воде находятся в виде гидрокарбонатов или солей сильных кислот.
В нерастворимое состояние Са и Мg переходят за счет повышения реакции среды до рН > 9 и за счет внесения в раствор анионов, которые образуют нерастворимые соединения из Са и Мg.
Са(НСО3)2 + Са(ОН)2 → СаСО3↓ + 2Н2О
Мg(НСО3)2 + Са(ОН)2 → Мg (ОН)2↓ + Са(НСО3)2
3СаCl2 + 2Nа3РО4 → Са3(РО4)2↓ + 6NаCl
3МgSO4 + 2Nа2РО3 → Мg3(РО4)2↓ + 3Nа2SО4
СаCl2 + Nа2СО3 → СаCO3↓ + 2NаCl.
Методы умягчения называются по типу используемого реагента:
- щелочной;
- известковый;
- фосфатный;
- комбинированный.
При реагентном умягчении воды для предотвращения "защелачивания воды" рН редко превышает 10.
Применение фосфатов ограничено их высокой стоимостью, поэтому в реальных технологиях остаточная жесткость умягченной воды достигает 0.8-1.5 мг-екв/л (этот показатель зависит от содержиния Мg в воде и от величины постоянной жесткости воды).
Технологическая схема реагентного умягчения воды приведена на рис.
В данной технологии вода и реагенты подаются в осветлитель со взвешенным слоем осадка. В этом сооружении совмещены функции смесителя, камеры хлопьеобразования и отстойника.
В нижней части, где площадь поперечного сечения потока воды маленькая и постоянно изменяется с высотой, происходит интенсивное перемешивание реагентов с водой за счет гидравлических факторов.
На высоте от 1 до 2-2.5 м происходит процесс хлопьеобразования осадка. Здесь скорость оседания осадка близкая к скорости подъема воды, поэтому осадок находится во взвешенном состоянии.
В верхней части над зоной отделения осадка резко возрастает площадь поперечного сечения, поэтому снижается скорость подъема воды и потому в этой зоне происходит осветление воды. Осадок постепенно выносится в зону накопления осадка.
Осветленная вода собирается в верхней части осветлителя и поступает в резервуар известковой осветленной воды и после доочистки на механических фильтрах собирается в резервуаре умягченной очищенной воды.
Концентрация взвешенных веществ в известковой воде после осветлителя -
8-15 мг/дм3, а после механической очистки - 0.5-3 мг/дм3. Жесткость воды после умягчения - 0.8-15 мг-екв/дм3 (для умягчения используют природную воду с жесткостью 3-7 мг-екв/дм3).
|
|
|


