 |
Перечень лабораторных работ
|
|
|
|
1. Основные классы неорганических соединений.
2. Строение атома.
3. Химическая термодинамика.
4. Окислительно-восстановительные реакции.
5. Гальванические элементы.
6. Электролиз.
7. Коррозия металлов.
Вопросы к экзамену
1. Квантовые числа: главное и орбитальное. Энергетические уровни и подуровни.
2. Квантовые числа: магнитное и спиновое. Энергетические уровни, подуровни и орбитали.
3. Формы s- и р-орбиталей.
4. Принципы формирования электронных оболочек атомов: принцип Паули, правило Хунда, принцип минимума энергии.
5. Максимальная заселённость электронами энергетических подуровней.
6. Электронные формулы строения атомов элементов. Графическое изображение электронного строения атомов.
7. Ковалентная неполярная химическая связь.
8. Ковалентная полярная химическая связь.
9. Ионная химическая связь.
10. Способы перекрывания электронных облаков: s-связи и p-связи
11. Гибридизация атомных орбиталей и строение молекул.
12. Первый закон термодинамики. Закон Гесса и следствие из него.
13. Расчёт изменения энтальпии реакции и теплового эффекта по стандартным энтальпиям вещества.
14. Расчёт изменения энтропии реакции. Энтропийно выгодные и невыгодные реакции.
15. Свободная энергия Гиббса и её изменение в ходе реакций.
16. Межмолекулярные окислительно-восстановительные реакции.
17. Внутримолекулярные окислительно-восстановительные реакции.
18. Реакции самоокисления-самовосстановления (диспропорционирования).
19. Окислительно-восстановительные реакции. Окислители и восстановители.
20. Электродные потенциалы. Уравнение Нернста.
21. Ряд напряжений металлов.
22. Гальванический элемент Вольта.
23. Электродвижущая сила гальванических элементов.
|
|
|
24. Гальванический элемент Якоби-Даниэля.
25. Концентрационный гальванический элемент.
26. Электрохимическая коррозия. Деполяризация.
27. Коррозия при контакте двух металлов.
28. Коррозия под каплей воды.
29. Защита металлов от коррозии.
30. Электролиз расплавов и растворов электролитов. Инертный и растворимый аноды.
31. Законы электролиза.
32. Скорость химической реакции. Кинетические уравнения. Уравнение Аррениуса. Колебательные реакции.
33. Гомогенный и гетерогенный катализ. Ферментативный катализ.
34. Химическое равновесие. Константа равновесия.
35. Смещение химического равновесия. Принцип Ле Шателье.
36. Фазовые равновесия. Правило фаз Гиббса. Диаграммы состояния.
37. Дисперсные системы: грубодисперсные системы, коллоидные растворы, истинные растворы. Свойства коллоидных растворов.
38. Концентрация растворов. Законы идеальных растворов.
39. Растворы электролитов. Вода как растворитель. РН среды.
40. Углерод. Алмаз, графит, карбин. Стеклоуглерод и углеволокно.
41. Кремний. Кремнезем. Силикаты. Стекло. Стекловолокно. Стеклопластики.
42. Легкие конструкционные металлы: Be, Mg, Al, Ti.
43. Тяжелые конструкционные металлы: Cr, Mn, Fe, Co, Ni, Cu.
44. Основные классы органических соединений.
45. Олигомеры и полимеры. Классификация, получение, свойства, применение.
46. Биохимические системы: углеводы, жиры, белки, нуклеиновые кислоты.
47. Мембраны и мембранные технологии.
48. Биотехнология. Достижения, основные направления и перспективы развития.
49. Химический анализ. Физико-химический и физический анализ.
50. Роль химии в решении экологических проблем.
Л И Т Е Р А Т У Р А
1. Коровин Н.В. Общая химия. – М.: Высш. школа. 2000.
2. Глинка Н.Л. Общая химия. - Л.: Химия, 1983 -1988 гг.
3. Ахметов Н.С. Общая и неорганическая химия. - М.: Высш. школа, 1985.
4. Фролов В.В. Химия. - М.: Высш. школа. 1979.
5. Глинка Н.Л. Задачи и упражнения по общей химии.- Л.: Химия, 1985.
|
|
|
6. Химия: Методические указания и контрольное задание. - Л.: СЗПИ, 1990.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
Тема 1. Строение атома и периодическая система элементов Д.И.Менделеева
Литература: [1] c.17-34; [2] с. 47-102; [3] с.10-40.
Теоретические основы
Атом химического элемента состоит из положительного ядра и двигающихся в поле его действия отрицательно заряженных электронов. Сам атом является электронейтральной частицей. Ядро атома состоит из нуклонов: протонов (условный заряд +1; массовое число 1) и нейтронов (заряд 0; массовое число 1). Заряд ядра равен порядковому номеру элемента в периодической системе Менделеева и совпадает с числом протонов. Массовое число ядра (сумма количества протонов и нейтронов: А = Z + N) примерно определяет относительную массу атома по причине легкости электронов (электрон в 1840 раз легче протона).
Состояние электронов в атоме волновую природу и согласно квантовой (или волновой) механике описывается плотностью вероятности обнаружения электрона в данной области пространства относительно ядра. Граничная поверхность, внутри которой расположена область наибольшей вероятности обнаружения электрона, называется атомной орбиталью. Атомная орбиталь характеризуется параметрами, которые получили название квантовых чисел: n - главное квантовое число описывает энергию и размеры атомной орбитали; l - орбитальное квантовое число - форму орбитали; m -магнитное квантовое число - ее ориентацию в пространстве.
Условная запись, которая представляет распределение электронов по энергетическим уровням и подуровням (атомным орбиталям), называется электронной формулой атома. Для написания электронной формулы, в которой с помощью квантовых чисел зашифровано состояние каждого электрона необходимо знать:
- систему обозначений;
- последовательность заполнения подуровней электронами (принцип наименьшей энергии);
- максимальную ёмкость каждого подуровня (принцип Паули).
Система обозначений в общем виде выглядит так: nlx , где n - главное квантовое число, соответствующее номеру энергетического уровня; l - орбитальное квантовое число - подуровню, который обозначается буквами s, p, d или f; х -количество электронов в данном квантовом состоянии. Например, запись 3d5 (читается: три дэ пять) означает, что пять электронов находятся на d -подуровне третьего энергетического уровня.
|
|
|
Первый энергетический уровень (n = 1) состоит из одного s -подуровня, второй энергетический уровень (n = 2) - из s - и p -подуровней, при n = 3 имеем три подуровня: s -, p - и d -, а при n = 4 - четыре: s -, p -, d - и f -подуровни. Последовательность заполнения энергетических подуровней имеет вид: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 5d=4f, 6p, 7s, 6d=5f,...
Максимальная ёмкость энергетических подуровней: s - два электрона; p - шесть; d - десять; f - четырнадцать. Заполнение последующих энергетических подуровней происходит только после полной застройки предыдущих. Например, электронная формула углерода имеет вид:
С 1s22s22p2.
Валентными электронами атома считаются электроны внешнего энергетического уровня, а также предпоследнего d -подуровня, если он заполнен частично. В атоме углерода валентными являются электроны второго энергетического уровня: С 2s22p2. В атоме марганца (электронная формула Mn 1s22s22p63s23p63d54s2) к валентным относятся 7 электронов: два на подуровне 4s и пять на подуровне 3d.



 Электронное строение атома можно представить также в виде схемы, в которой электронная орбиталь символически представлена квантовой ячейкой, а собственный спиновый момент электрона - стрелкой, направление которой соответствует значению спинового квантового числа (стрелка вверх +1/2, стрелка вниз -1/2):
Электронное строение атома можно представить также в виде схемы, в которой электронная орбиталь символически представлена квантовой ячейкой, а собственный спиновый момент электрона - стрелкой, направление которой соответствует значению спинового квантового числа (стрелка вверх +1/2, стрелка вниз -1/2):
 При распределении электронов по квантовым ячейкам следует руководствоваться принципом Паули и правилом Хунда. В каждой ячейке может быть не более двух электронов с противоположными спинами:
При распределении электронов по квантовым ячейкам следует руководствоваться принципом Паули и правилом Хунда. В каждой ячейке может быть не более двух электронов с противоположными спинами:
¯
Такая пара электронов называется спаренной. Суммарное спиновое число электронов данного подуровня должно быть максимальным (сначала каждая ячейка заполняется по одному электрону с параллельными спинами, а затем производится парное размещение электронов со спинами, противоположными к уже имеющимся в ячейке электронам). Например, для валентных электронов атома углерода:
|
|
|
 |  |
С ¯
2s 2p





 Для атома марганца:
Для атома марганца:
Mn ¯
3d 4s
Если на внешнем энергетическом уровне имеются вакантные, не занятые электронами квантовые ячейки, то при возбуждении атома происходят переходы электронов из занятых ячеек в свободные. При этом изменяется значение спиновой валентности (числа неспаренных электронов). Например, для стационарного, отвечающего минимальной энергии атома, состояние атома хлора распределение по квантовым ячейкам таково:
 Cl 1s22s22p63s23p5 ¯ ¯ ¯
Cl 1s22s22p63s23p5 ¯ ¯ ¯
S 3p 3d
3d ячейки при этом остаются свободными. Спиновая валентность хлора в основном (стационарном) состоянии равна 1. При возбуждении атома в результате приобретения им дополнительной энергии электроны из 3p- состояния переходят в одну из пустых 3d- ячеек:
 |  |  |
Сl *1s22s22p63s23p43d1 ¯ ¯
S 3p 3d
Спиновая валентность становится равной 3. При получении новой порции энергии атомом возбуждается следующая электронная пара:
электрон из второй 3p -ячейки переходит в свободную ячейку 3d- подуровня.При этом спиновая валентность станет равной 5. Наконец, третье возбуждённое состояние атома хлора характеризуется переходом из электронов 3s- состояния в ячейку 3d. Хлор приобретает максимальную валентность 7:
 |  |  |
Сl ** ¯
S 3p 3d
 |  |  |
Сl ***
S 3p 3d
Характер застройки энергетических подуровней определяет принадлежность элемента к тому или иному электронному семейству:
s -элементы - застройка внешнего s -подуровня, например:
Калий К 1s22s22p63s23p64s1
р -элементы - застройка внешнего р -подуровня, например:
Фосфор Р 1s22s22p63s23p3
d -элементы - застройка предвнешнего d -подуровня, например:
Ванадий V 1s22s22p63s23p63d34s2
f -элементы - застройка третьего снаружи f -подуровня, например:
Церий Се 1s22s22p63s23p63d104s24p64d104f25s25p65d06s2
Естественной классификацией элементов по электронным конфигурациям их атомов является периодическая система элементов Менделеева. Причина периодичности свойств элементов заключается в периодической повторяемости сходных электронных конфигураций.
В периодах (горизонтальных строках таблицы) свойства элементов изменяются в связи с закономерным изменением электронных структур их атомов.
В группах (вертикальных строках таблицы) свойства элементов сходны благодаря аналогии в электронном строении внешнего валентного уровня.
Номер периода определяет номер внешнего энергетического уровня в электронных формулах элементов. Количество элементов в каждом периоде соответствует минимальной ёмкости застраивающихся энергетических подуровней.
|
|
|
Номер группы отвечает числу валентных электронов в атоме элемента. Кроме первого, каждый период начинается с двух s -элементов и заканчивается шестью р -элементами. В больших периодах между этими семействами располагаются десять d- элементов (4....6 периоды). В 6 периоде к ним добавляется четырнадцать f- элементов, 7 период не завершён.
Указанные закономерности позволяют составить электронную формулу элемента. Например, элемент тантал находится в 6 периоде, V группе, побочной подгруппе. Это говорит о том, что в атоме этого элемента шесть энергетических уровней, пять валентных электронов. Перед танталом в 6 периоде стоят два s -элемента и два d -элемента. Сам тантал - третий по счёту d -элемент. Следовательно, его валентные электроны имеют конфигурацию 5d36s2. Предыдущие энергетические уровни застроены полностью. Полная электронная формула этого элемента имеет вид:
Та 1s22s22p63s23p63d104s24p64d104f145s25p65d36s2.
В периодической зависимости от зарядов ядер атомов находится валентность (степень окисления), атомные и ионные радиусы, энергия ионизации, энергия сродства к электрону, электроотрицательность и другие свойства.
В простейшей трактовке валентности как степени окисления атомов её отождествляют с числом электронов, отдаваемых или приобретаемых атомами в процессе взаимодействия.
Высшую степень окисления атом приобретает, отдав все свои валентные электроны, поэтому её величина соответствует номеру группы, в которой находится данный элемент. Так, высшая степень окисления азота - +5 (V группа элементов), серы - +6 (VI группа элементов).
Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении электронов, необходимых ему для приобретения устойчивой восьмиэлектронной оболочки (октета электронов). Отсюда низшую степень окисления можно рассчитать по разности между 8 и номером группы. Например, для азота низшая степень окисления равна -3, для серы -2. Следует учесть, что металлы не проявляют отрицательных степеней окисления, для них минимальным значением этой величины является 0.
Значение высшей и низшей степеней окисления атомов элементов позволяет составлять формулы их соединений: высших оксидов, гидроксидов, солей, водородных соединений. При составлении формул следует учитывать требование электронейтральности. Степени окисления кислорода, как правило, -2, водорода - +1.
Общая формула оксидов - соединений элемента с кислородом - Э+mxО-2y, водородных соединений - Э-mН+1m, гидроксидов - оснований Э+m(ОН)m. Простейшие формулы кислородсодержащих кислот выражаются общими формулами: НЭ+7О4, Н2Э+6О4,
Н3Э+5О4 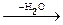 НЭ+5О3, Н4Э+4О4
НЭ+5О3, Н4Э+4О4 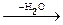 Н2Э+4О3
Н2Э+4О3
орто мета орто мета
Энергия ионизации, энергия сродства к электрону, электроотрицательность являются мерами проявления элементами металлических и неметаллических свойств. Металлические (восстановительные) свойства определяются способностью атомов элементов к отдаче электронов, неметаллические (окислительные) - тенденцией к присоединению электронов.
Металлические свойства наиболее характерны для элементов, в атомах которых на внешнем энергетическом уровне находится небольшое количество электронов: от одного до трёх. Неметаллические свойства, в первую очередь, проявляют элементы, в атомах которых на внешнем уровне от четырёх до семи электронов.
В периоде периодической системы металлические свойства элементов убывают с ростом порядкового номера; неметаллические свойства, напротив, возрастают в том же направлении. Это связано с закономерным ростом числа валентных электронов.
В группе металлические свойства возрастают с ростом порядкового номера, а неметаллические убывают, что связано с увеличением радиуса атома с ростом порядкового номера элемента, удалённостью внешних электронов от ядра и ослаблением сил притяжения между электронами и ядром.
Большинство элементов периодической системы проявляют как металлические, так и неметаллические свойства. Вклад тех или других определяется спецификой электронной структуры атома. Количественно этот вклад можно охарактеризовать с помощью величины электроотрицательности атома, представляющей собой полусумму энергии ионизации и энергии сродства к электрону. Электроотрицательность возрастает в периоде с ростом порядкового номера и убывает в группе с ростом порядкового номера.
Свойства соединений элементов можно рассматривать с двух точек зрения: как кислотно-основные и окислительно-восстановительные. Типичные металлы образуют оксиды и гидроксиды основного характера, типичные неметаллы - кислотные оксиды и кислоты. Кислотно-основной характер остальных элементов, в первую очередь, это относится к d -элементам, зависит от степени окисления их атомов: с ростом степени окисления основной характер соединений сменяется амфотерным и далее переходит в кислотный. Например, хром в степени окисления +2 образует оксид CrO и гидроксид Cr(OH)2, проявляющие основные свойства. Соединения хрома +3 - Cr2O3, Cr(OH)3 -амфотерны, а оксид и гидроксид хрома в степени окисления +6 носят кислотный характер (CrO3, Н2СrO4 и H2Cr2O7).
Задачи 1 - 20
1. Для атомов элементов, порядковые номера которых указаны в табл.1 укажите состав ядер (число протонов и нейтронов), составьте электронные формулы атомов. Укажите валентные электроны, распределите их по квантовым ячейкам в стационарном и возбуждённом состояниях, определите значения спиновой валентности. К какому электронному семейству принадлежит каждый элемент?
2. Исходя из положения элементов в периодической системе элементов Менделеева, выбранных в соответствии с шифром (см. табл.1), охарактеризуйте их свойства. Является ли каждый из них металлом или неметаллом, окислителем или восстановителем? Каковы высшая и низшая степени окисления их атомов? Составьте формулы оксидов и гидроксидов, отвечающих их высшей степени окисления? Какими кислотно-основными свойствами обладают эти соединения? Приведите уравнения соответствующих реакций. Образуют ли данные элементы водородные соединения? Сравните свойства соединений данного элемента со свойствами аналогичных соединений элементов той же подгруппы периодической системы.
Т а б л и ц а 1
| Номер Порядковые задачи номера элементов | Номер Порядковые задачи номера элементов |
| 1 33, 38 2 17, 56 3 20, 35 4 15, 52 5 19, 53 6 20, 51 7 22, 32 8 34, 42 9 21, 31 10 25, 35 | 11 39, 49 12 27, 37 13 16, 55 14 24, 34 15 23, 50 16 14, 48 17 15, 47 18 25, 53 19 40, 50 20 41, 51 |
Тема 2. Химическая связь
Литература: [1] c.35-56; [2] с.115-156; [3] с.41-93.
Теоретические основы
Химическая связь возникает при взаимодействии атомов и приводит к образованию многоатомной системы - молекулы, молекулярного иона, кристалла. Причиной (движущей силой) возникновения химической связи является уменьшение потенциальной энергии при переходе от изолированных атомов к устойчивой многоатомной системе.
Мерой прочности химической связи является её энергия, величина которой определяется количеством энергии, выделившейся при образовании вещества из отдельных атомов. Например, энергия связи Н¾Н в молекуле водорода равна 435 кДж/моль. Это значит, что при образовании 1 моля газообразного водорода по уравнению
Н + Н = Н2 + 435 кДж/моль
выделяется 435 кДж теплоты. Такое же количество энергии должно быть затрачено на распад 1 моля Н2 до атомарного состояния (энергия диссоциации).
Химическая связь характеризуется также длиной, под которой понимают расстояние между ядрами химически связанных атомов. Так, длина химической связи Н¾О в молекуле воды Н2О равна 0.096 нм (1 нм = 1· 10-9 м).
Химическая связь возникает благодаря взаимодействию электромагнитных полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла.
Современная теория химической связи базируется на квантово-механической модели строения атома. В ней можно выделить два метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
В основе метода МО лежат представления об орбитальном строении молекул. Задачей этого метода является характеристика энергетических параметров электронов в молекуле, выходными данными в таком случае является энергетическая диаграмма соответствующих уровней.
Охарактеризовать молекулу методам ВС - это означает представить графически распределение электронной плотности в молекуле. Ниже кратко излагаются основные представления этого метода в применении к ковалентной химической связи.
Ковалентная химическая связь образуется парой электронов с противоположно направленными спинами, для чего каждый атом предоставляет один неспаренный электрон, называемый валентным. Эта пара электронов принадлежит одновременно обоим взаимодействующим атомам, что означает повышение электронной плотности в пространстве между ядрами (центрами) химически связанных атомов. Поэтому ковалентная химическая связь является двухэлектронной и двухцентровой. Процесс «спаривания» электронов при образовании, например, молекулы водорода может быть изображён следующей схемой:
 Н
Н
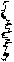

¾® Н2
 | |||
 | |||
Н ¯ ¯
По Льюису указанный механизм наглядно представляют в виде электронной схемы молекулы, где электрон изображают точками. Для молекулы водорода такая схема имеет вид:
Н· + ·Н ¾® Н: Н
В графической формуле молекул пара точек заменяется валентным штрихом, соответствующим одной химической связи: Н¾Н.
Атом хлора имеет на наружном уровне 7 электронов:
Cl 3s23p5, из которых один является неспаренным:








 Cl ¯ ¯ ¯
Cl ¯ ¯ ¯
S 3p 3d
Отсюда получаем следующую электронную схему молекулы хлора Сl2 ::  +:
+:  ¾®:
¾®:  :
:  : или Сl¾Cl
: или Сl¾Cl
Ковалентную связь, образованную посредством одной общей электронной пары, называют ординарной и изображают в структурных формулах одним валентным штрихом. Если же связь образуется за счёт двух или трёх общих электронных пар, она называется двойной или тройной, соответственно.
Кратные ковалентные связи изображают в структурных формулах двумя или тремя валентными штрихами. Так, атом азота имеет три неспаренных электрона:
 |  |
N ¯
S 2p
поэтому молекула N2 образуется в результате обобщения трёх электронных пар (возникает тройная ковалентная связь):
 +
+ 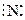 ¾®
¾® 
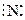 или N ≡ N
или N ≡ N
В молекуле оксида углерода (IV) двойные ковалентные связи:
:  : + ∙
: + ∙  ∙+:
∙+:  : ¾®
: ¾®  ::
::  ::
:: 
или О=С=О
Молекула СО2 образована атомом углерода в возбуждённом состоянии: С* 2s12p3.
Таким образом, валентность химического элемента (как способность его атомов образовывать определённое число химических связей) зависит от количества неспаренных электронов его атома в основном или возбуждённом состояниях.
Одним из свойств ковалентной химической связи является её полярность. Если электроотрицательность (способность к смещению электронной плотности) атомов, образующих молекулу, одинакова или очень близка, то общая электронная пара располагается строго симметрично по отношению к обоим ядрам. Такая ковалентная связь называется неполярной. Неполярная ковалентная связь осуществляется, например, в молекулах Н2, F2, O2, N2, в любых других гомоядерных молекулах, образованных атомами одного и того же элемента.
Если же электроотрицательность атомов различна, электронная пара смещается в сторону более электроотрицательного атома. При этом возникают частичные (дробные) заряды: отрицательный на более электроотрицательном атоме и положительный на атоме с меньшей электроотрицательностью. В молекуле образуются два полюса. Подобные ковалентные связи называют полярными. Например, в молекулах НCl, H2O, NH3 и т.д.
В случае очень большой разницы в электроотрицательностях (численно более 2), поляризация связи приобретает необратимый характер. Это происходит тогда, когда соединение образуют, с одной стороны, атом, легко отдающий свои валентные электроны, имеющий низкий потенциал ионизации (прежде всего, это щелочные и щёлочно-земельные металлы), а с другой стороны, атом, проявляющий тенденцию к присоединению электронов, обладающий высоким сродством к электрону (галогены, кислород, азот и, отчасти, сера и фосфор). При этом электрон полностью переходит от первого атома ко второму. Атомы превращаются в заряженные частицы - ионы. Атом, отдавший один электрон, приобретает заряд +1 и называется катионом. Атом, приобретший дополнительный электрон, получает заряд -1 и называется анионом. Электростатическое притяжение, возникшее между разноименно заряженными ионами, называют ионной химической связью. Примерами ионных соединений являются галогениды и оксиды щелочных металлов: LiCl, K2O, CsI и т.п.
Повышение электронной плотности в результате образования общей электронной пары (ковалентная химическая связь) можно представить с помощью области перекрывания атомных орбиталей, занятых неспаренными валентными электронами, образующих данную молекулу. Перекрывание орбиталей происходит в том направлении, которое обеспечивает образование максимальной области перекрывания. По этой причине, а также в связи с тем, что орбитали имеют определённую геометрическую форму, ковалентная связь обладает свойством направленности.
Перекрывание орбиталей может осуществляться разными способами. Например, при образовании s-связи перекрывание происходит
вдоль линии, соединяющей ядра (рис. 1):
 | |||||
 | |||||
 | |||||
















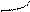


 |  |
s s s p p p
(молекула Н2) (молекула НCl) (молекула Сl2)
Рис. 1. Перекрывание орбиталей s-способом.
При боковом перекрывании орбиталей образуется p-связь. В этом случае возникают две общие области: над и под плоскостью, в которой лежат ядра. На схемах p-связь принято изображать условно (рис. 2, а и б).





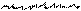




 а) б)
а) б)
 | |||
 | |||








Рис.2. Перекрывание орбиталей p-способом.
s- и p-Способами перекрывания орбиталей характеризу-ется не ионная, а ковалентная связь. Причём, s-способ приводит к образованию более прочной ковалентной связи, поскольку в этом случае реализуется большая степень перекрывания.
Для того чтобы дать характеристику определённой молекулы методом ВС, требуется:
- по величинам электроотрицательности определить тип химической связи (ковалентная неполярная, ковалентная полярная или ионная) в соединении;
- написать электронные формулы атомов, принимающих участие в образовании молекулы;
- выбрать валентные электроны; распределить их по квантовым ячейкам; выбрать неспаренные электроны;
- в случае, если количество неспаренных электронов меньше численного значения валентности многовалентного атома, перевести последний в возбуждённое состояние;
- установить, на каких орбиталях находятся эти неспаренные электроны;
- если связь ковалентная, нарисовать перекрывание этих орбиталей в молекуле;
- если связь ионная, указать, какие атомы и сколько электронов отдают и принимают, указать величину зарядов ионов в соединении.
Пример: молекула сероводорода (H2S).
Электроотрицательность: серы 2.58, водорода 2.10. Связь между атомами Н и S - ковалентная полярная. Обобществленные электронные пары смещены в молекуле сероводорода от атомов водорода (на которых появляется частичный положительный заряд) к атому серы (возникает частичный отрицательный заряд). Электронная формула водорода: Н 1s1; серы: S 1s22s22p63s23p4. Валентные электроны водорода: 1s1; серы: 3s23p4. Распределение электронов по квантовым ячейкам:





Н S ¯ ¯
1s 3s 3p
Неспаренные электроны серы занимают две 3р-орбитали. Поскольку спиновая валентность атома серы соответствует валентности, обусловливающей формульный состав молекулы сероводорода, атом серы образует две химические связи в основном состоянии.
По причине взаимной перпендикулярности двух р-орбиталей одного подуровня, схема перекрывания 3р-орбиталей серы и s-орбиталей двух атомов водорода имеет вид, представленный на рис. 3,а. Соединив ядра атомов водорода и серы прямыми линиями, получаем геометрическую фигуру, дающую представление о форме молекулы: молекула сероводорода имеет угловое строение (рис. 3,б).









 а) S б) S
а) S б) S
 |


 H H
H H 



i i


